羊肚菌硒化多糖结构表征及抗运动疲劳作用
赵伟科,杨逍然,王美华
(1.中国矿业大学(北京)体育教研部,北京 100083;2.北京中医药大学中药学院,北京 100029)
运动性疲劳是机体在长时间或高强度运动后会出现的一种乏力状态,属于正常的生理现象,轻微的运动性疲劳会使机体出现动作不协调、肌肉僵硬、酸痛等症状,经适当休息后可逐渐得到恢复。然而经常处于运动性疲劳状态下,会导致身体出现亚健康,进一步引发机体身心疲劳,甚至对脏器造成一定损伤[1-2]。研究表明,糖原消耗、乳酸和尿素氮堆积、氧化应激水平升高、内环境紊乱等均易导致机体疲劳[3-4]。目前,大量研究显示通过补充外源营养剂可以有效缓解运动疲劳,例如LIU 等[5]研究表明,补充黑豆皮多糖不仅提高小鼠糖原储备,还提高了抗氧化酶活性,同时降低了乳酸等代谢产物的堆积,从而发挥了较好的抗疲劳作用;张锐等[6]研究表明,补充松杉灵芝多糖后小鼠体内糖原含量和血清抗氧化水平均得到了显著提高,小鼠的运动耐力显著高于空白对照组;李英基等[7]研究表明,补充川赤芝多糖后明显提高了小鼠心肌组织的抗氧化能力,改善了运动疲劳诱导的心肌损伤。这些研究表明补充外源营养物可有效缓解机体的运动疲劳。
羊肚菌(Morchella esculenta)是近几年研究较多的一种珍稀食药用真菌,多糖是羊肚菌子实体中最重要的活性物质之一[8]。大量药理研究表明,羊肚菌多糖(Morchellaspp polysaccharides,Msp)具有免疫调节[9]、保肝护肝[10]、预防老年痴呆[11]、抗血栓[12]、降血脂[13]等功效。多糖的诸多药理活性与其分子结构密不可分,一些研究表明,采取一定手段对多糖分子结构进行修饰可以明显提高多糖的药理活性。目前,对多糖的修饰作用有硒酸化、磷酸化、硫酸化、甲基化等[14],这些修饰作用不仅会改变多糖的空间结构,还会改进多糖的生物学特性,使得修饰后的多糖具有更高的生物活性[15]。近年来,多糖的硒酸化修饰研究相对较多,主要因为硒酸化修饰得到的硒多糖不仅具有多糖的特性还具有硒的生物活性,研究表明硒多糖的抗氧化、抗疲劳、免疫调节等作用比单独的多糖和硒元素更强[16-17]。可见,通过硒酸化改性是提高多糖生物活性的一种重要结构修饰方法。
目前对羊肚菌多糖的硒酸化修饰研究较少,对修饰后多糖的结构和抗疲劳作用研究还鲜有报道。鉴于此,本研究为改善羊肚菌多糖的生物活性,拟通过硝酸-亚硒酸钠(HNO3-Na2SeO3)法对羊肚菌多糖进行硒酸化修饰,同时对硒多糖进行结构表征,并建立大鼠运动疲劳模型探讨硒多糖的抗疲劳作用。本研究获得的硒多糖不仅为羊肚菌资源的深入开发提供理论参考,还可作为富硒补充剂和抗疲劳功能食品的潜在来源。
1 材料与方法
1.1 材料与仪器
羊肚菌子实体(品种:川羊肚菌1 号)来源于四川省食用菌研究所;亚硒酸钠(Na2SeO3)西陇科学股份有限公司;氯仿、正丁醇、丙酮、乙醚 分析纯,天津科密欧化学试剂有限公司;盐酸、硝酸、无水乙醇、无水硫酸钠、氯化钡、氢氧化钠、抗坏血酸、冰乙酸等 均为分析纯,国药集团化学试剂有限公司;三氯乙酸、PMP 衍生剂、甲醇、乙腈 均为色谱级,北京京科瑞达科技有限公司;血乳酸(blood lactic acid,BLA)、血尿素氮(blood urea nitrogen,BUN)、肝糖原(hepatic glycogen,HG)、肌糖原(muscle glycogen,MG)、蛋白浓度测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)活性测定试剂盒 南京建成生物工程研究所;线粒体分离试剂盒 北京索莱宝科技有限公司;SPF 级屏障大鼠 雄性大鼠,5 周龄,65 只,质量(120±25)g,大鼠维持饲料,营养成分符合GB 14924.3-2010《实验动物配合饲料营养成分》 斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010,伦理试验批准文号:202 204006;DEAE纤维素层析柱 上海联迈生物工程有限公司;单糖分析标准品、葡聚糖凝胶G-100 上海源叶生物科技有限公司;葡聚糖分子量标准物质 上海阿拉丁生化科技股份有限公司。
Varioskan LUX 多功能酶标仪、傅里叶变换红外光谱仪 赛默飞世尔科技公司;H1850 离心机湖南湘仪实验室仪器开发有限公司;Beta 2-8 LSCplus 真空冷冻干燥机 德国CHRIST 公司;SN-RE-2000B 旋转蒸发仪 上海尚仪科技有限公司;HH-501 水浴锅 常州国华电器有限公司;LC-10A 高效液相色谱仪 日本岛津公司;FFA2204E 电子分析天平 常州幸运电子设备有限公司;PF4250 分离纯化系统 法国Interchim 公司;Zetasizer Nano ZS90 zeta 电位分析仪 英国Malvern 公司。
1.2 实验方法
1.2.1 羊肚菌多糖提取 将羊肚菌子实体45 ℃烘干至恒重,粉碎至颗粒直径小于5 mm,称取1000 g羊肚菌粉末,按照料液比1:30 g/mL,加入30 L 去离子水,在功率200 W 下超声波处理15 min,然后在90 ℃水浴锅中浸提2 h,并重复1 次,将全部滤液旋转蒸发浓缩至约100 mL,向浓缩液中加入Sevag 试剂,漩涡振荡后静置10 min,5000 r/min 离心10 min,取上层液体,重复多次至无蛋白产生为止。加入无水乙醇静置过夜,5000 r/min 离心10 min 收集沉淀,沉淀依次经无水乙醇、丙酮、乙醚洗涤,去离子水溶解沉淀后,7000 Da 滤膜透析24 h,真空冷冻干燥得到羊肚菌粗多糖粉末,备用。
1.2.2 羊肚菌多糖分级纯化 称取粗多糖20 g,配制成100 mg/mL 水溶液,上样到纤维素层析柱,用去离子水和0.1、0.3、0.5 mol/L 的氯化钠溶液洗脱,控制流速0.8 mL/min,自动收集洗脱液,各管收集5 mL,采用苯酚-硫酸法在490 nm 处跟踪检测各管吸光值[18],根据吸光值绘制洗脱曲线。选取收集最多的多糖组分,上样到葡聚糖凝胶G-100 中进一步纯化,合并洗脱液后透析并真空冷冻干燥得到纯化羊肚菌多糖(Msp-1)。根据下式分别计算粗多糖得率和纯化后多糖的纯度。
式中,m0为称取的羊肚菌粉末质量(g);m1为提取的粗多糖质量(g);m2为纯化后多糖质量(g)。
1.2.3 Msp-1 硒酸化处理 参考刘韫滔等[19]HNO3-Na2SeO3方法,准确称取5 g Msp-1 粉末置于250 mL锥形瓶中,加入100 mL 硝酸溶液(0.1 mol/L),45 ℃磁力搅拌使其全部溶解,加入2.5 g 亚硒酸钠,溶解后再加入15 g 氯化钡,密封70 ℃磁力搅拌10 h,冷却至室温,通过碳酸氢钠溶液调节pH 至6.5~7.5,加入足量硫酸钠,振荡使Ba2+全部沉淀,5000 r/min 离心,将上清液置于透析袋中,截留分子量7000 Da,向透析液中加入抗坏血酸至溶液不变色为止。参考1.2.1 方法,加入无水乙醇沉淀,依次经无水乙醇、丙酮、乙醚洗涤,蒸馏水溶解透析,旋转蒸发浓缩并真空冷冻干燥得到硒酸化羊肚菌多糖(Se-Msp1)。
1.2.4 Msp-1 和Se-Msp1 化学组成分析 样品中硒含量测定采用GB 5009.93-2017《食品安全国家标准食品中硒的测定》[20];多糖含量测定以葡聚糖为标准品建立标准曲线,采用苯酚-硫酸法测定[18],y=2.4438x+0.0846,R2=0.9985;蛋白含量测定采用考马斯亮蓝法[21],y=0.0171x+0.0052,R2=0.9991;糖醛酸含量测定采用间羟基联苯法[22],y=0.0022x+0.0014,R2=0.9997。
1.2.5 Msp-1 和Se-Msp1 的傅里叶变换红外光谱测定 分别称取适量Msp-1 和Se-Msp1 样品粉末,加入溴化钾粉末,混合研磨充分,并在油压机上将混合粉末制成透明薄片,在红外光谱仪上扫描,扫描波长为4000~500 cm-1,设置分辨率4 cm-1。
1.2.6 Msp-1 和Se-Msp1 分子量测定 分别配制分子量为4.32×103、1.26×104、6.06×104、1.1×105、2.89×105、5.0×105、2.45×106Da 的葡聚糖标准品溶液1 mg/mL,同时配制1 mg/mL 的样品溶液。参考窦祖满的[23]方法,采用高效凝胶渗透色谱法测定样品重均分子量(Mw)和数均分子量(Mn)大小。
1.2.7 Msp-1 和Se-Msp1 的粒径和电位测定 分别配制浓度为1 mg/mL 的Msp-1 和Se-Msp1 溶液,在室温条件通过纳米粒度电位仪测量样品的粒径大小和Zeta 电位。
1.2.8 Msp-1 和Se-Msp1 的电镜扫描 分别称取Msp-1 和Se-Msp1 粉末0.5 g,均匀喷洒在导电双面胶上,真空喷金处理,在扫描电子显微镜下2000 倍观察。
1.2.9 Msp-1 和Se-Msp1 单糖组成测定 分别配制鼠李糖(rhamnose,Rha)、半乳糖(galactose,Gal)、半乳糖醛酸(galacturonic acid,GalUA)、葡萄糖(glucose,Glu)、葡萄糖醛酸(glucuronic acid,GlcUA)、甘露糖(mannose,Man)、木糖(xylose,Xyl)、岩藻糖(fucose,Fuc)、阿拉伯糖(arabinose,Ara)单糖标准品和Msp-1、Se-Msp1 样品5 mg/mL,参考金鑫等[24]的方法进行PMP 柱前衍生,配制流动相A[0.1 mol/L磷酸盐缓冲液(pH6.8)]和B(乙腈),所有溶液均经0.45 μm 过滤。流动相设置A:B=83:17,柱温40 ℃,流速0.8 mL/min,进样量10 μL,检测波长250 nm。
1.2.10 大鼠抗疲劳能力测定 大鼠适应性饲养5 d 后,通过游泳训练剔除游泳不适大鼠,取30 只随机分成6 组,每组5 只,分别为空白对照组(Con)、阳性对照组(红景天苷)、普通多糖组(Msp-1)、硒多糖低剂量组(Se-Msp1-L)、硒多糖中剂量组(Se-Msp1-M)、硒多糖高剂量组(Se-Msp1-H)。多糖处理组每天灌胃剂量参考曹亮[25]的方法,红景天苷和Msp-1剂量均为100 mg/kg,Se-Msp1-L、Se-Msp1-M、Se-Msp1-H 灌胃剂量分别为50、100 和200 mg/kg,Con组每天灌胃无菌生理盐水,灌胃体积均为0.1 mL/(10g·bw),连续灌胃5 周,并在每周最后一天灌胃前对大鼠称重。试验的最后一次灌胃结束后大鼠休息60 min,在大鼠尾根处系8%体重铅块进行力竭游泳运动,水温(30±2)℃,水深30 cm,当大鼠四肢运动迟缓,头部沉入水下10 s 未浮起时,游泳结束,记录大鼠从放入水中到结束游泳的时间。
1.2.11 大鼠运动疲劳模型建立 取30 只大鼠按体重随机分成6 组,分别为安静对照组(Q-CG)、运动疲劳对照组(E-CG)、阳性对照(红景天苷)、普通多糖组(Msp-1)、硒多糖低剂量组(Se-Msp1-L)、硒多糖中剂量组(Se-Msp1-M)、硒多糖高剂量组(Se-Msp1-H),每组5 只。Q-CG 组、E-CG 组每天灌胃无菌生理盐水,红景天苷、多糖组灌胃剂量同方法1.2.10,Q-CG 组不运动,E-CG 组、红景天苷组、Msp-1组、Se-Msp1 组每天均进行游泳运动。灌胃结束后休息1 h,在大鼠尾根处系5%体重铅块进行力竭游泳运动,游泳结束后吹干毛发放入鼠笼继续饲养,周一至周六上午进行游泳运动,周日休息,连续进行5 周,建立大鼠运动疲劳模型。
1.2.12 大鼠体内糖原、血乳酸、血尿素氮含量测定
在运动疲劳模型试验中,大鼠最后一次力竭运动结束休息1 h 后,通过麻醉处死,迅速使用注射针刺入血管采血,离心后取上清液保存于冻存管中,同时解剖取后肢四头肌肌肉(骨骼肌)、肝脏,使用4 ℃生理盐水清洗干净并用滤纸吸干表面水分后,剪碎保存于冻存管中,液氮预冷30 min,再转入-80 ℃冰箱保存。通过试剂盒测定血清中BLA、BUN 含量,取肝脏和骨骼肌肌肉组织,研磨并加入试剂盒提取液,离心取上清液,试剂盒测定肝脏中HG 和骨骼肌中MG 含量。
1.2.13 骨骼肌线粒体中MDA 含量和抗氧化酶活性测定 取冰箱保存的骨骼肌肌肉组织,使用线粒体提取试剂盒,按照说明书操作提取获得骨骼肌线粒体。取线粒体加入裂解液在冰上研磨,离心取上清液待测,按照试剂盒方法分别测定线粒体中MDA 含量和SOD、GSH-Px、CAT 活性。
1.3 数据处理
Excel 2020 对数据进行整理,采用SPSS 22.0 one-way ANOVA 统计分析,数据用±SD 表示,组间数据采用LSD 检验显著性,P<0.05 表示数据差异显著,使用Origin 2018 进行作图。
2 结果与分析
2.1 羊肚菌多糖分离纯化
经计算,羊肚菌多糖得率为7.21%;图1A 显示,经过纤维素柱层析共洗脱出3 个峰,分别为Msp-1(8~18 管)、Msp-2(25~35 管)、Msp-3(50~53 管),占比分别为85.25%、9.38%和2.74%;选取最大组分Msp-1 经葡聚糖凝胶柱层析得到单一洗脱曲线,如图1B 所示,纯化后总多糖质量为7.35 g,纯化效率为36.75%。研究表明,经去离子水洗脱所得的多糖通常为中性多糖,经NaCl 溶液洗脱所得多糖通常为酸性多糖[26]。羊肚菌多糖分离所得的Msp-1 为去离子水所洗脱,其为中性多糖,Msp-2 和Msp-3 为NaCl 溶液洗脱所得,均为酸性多糖,说明羊肚菌多糖里中性多糖占比最大,同时还含有一定的酸性多糖,这与张景等[27]研究一致。

图1 羊肚菌多糖洗脱曲线Fig.1 Elution curve of Morchella esculenta polysaccharides
2.2 多糖的化学组成分析
从表1 可知,纯化后的羊肚菌多糖(Msp-1)未检出硒元素,而Msp-1 通过硒酸化得到的多糖(Se-Msp1)中硒含量达到9.56 mg/g,说明Msp-1 经过硒酸化处理,Se 与多糖成功结合在一起;Msp-1和Se-Msp1 中多糖含量分别为53.67%和54.34%,Se-Msp1中多糖含量略高于Msp-1,但差异不显著(P>0.05)。两种多糖中均检测出了少量的蛋白质,Msp-1 中蛋白质含量显著高于Se-Msp1(P<0.05),这可能是多糖样品结构中存在少量糖蛋白,使得蛋白质未清除干净,而多糖经过硒酸化改性后可能引起了糖蛋白的降解或新引入的Se 官能团取代了糖蛋白分子,从而使得硒酸化改性后的Se-Msp1 中蛋白质含量显著降低(P<0.05),这与杨燕敏等[28]、童微等[29]研究结果较一致。另外,多糖样品中均含有糖醛酸,Msp-1 中糖醛酸含量较低,而Se-Msp1 中糖醛酸含量高达36.82%,Msp-1 主要为中性多糖,Se-Msp1 为酸性多糖,说明羊肚菌多糖经硒酸化处理可将中性多糖转变成酸性多糖,这与柯宏伟等[30]的研究结果一致。
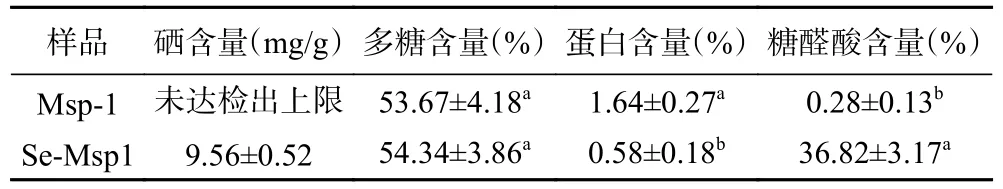
表1 两种多糖的化学组成Table 1 Chemical composition of two polysaccharides
2.3 多糖的红外光谱分析
从图2 可知,Msp-1 和Se-Msp1 两种多糖在3358、2928、1633、1422、1118、889 cm-1处有相同的特征吸收峰,3358 cm-1处由羟基(O-H)伸缩振动引起,2928 cm-1处由C-H 基团(CH-、CH2-、CH3-)伸缩振动引起,1633 cm-1处可能为C=O 不对称拉伸振动,亦或为羧基基团中H 的去质子化和酯化,1422 cm-1处为CH-的变形振动引起、1118 cm-1处为C-O-C 的伸缩振动引起,889 cm-1处为吡喃葡萄糖的特征吸收峰。这些特征吸收峰表明Msp-1 和Se-Msp1 为典型的多糖结构,均存在吡喃糖环,其异头碳为α构型[31-32]。这与TENG 等[10]、LI 等[33]、KUANG 等[34]研究结果一致。同时也说明硒酸化处理得到的Se-Msp1,其红外光谱图与Msp-1 变化较小,硒酸化并未对多糖主链结构引起较大的改变,Se-Msp1 依旧保留了多糖的原有构型。然而,Se-Msp1的光谱图中1189、765、604 cm-1处存在特有的吸收峰,研究表明1189 cm-1多由Se=O 伸缩振动引起,765 cm-1多由O-Se-O 伸缩振动引起,604 cm-1多由Se-O-C 伸缩振动引起[35]。上述结果表明,Msp-1 的硒酸化处理较成功,无机硒(Na2SeO3)通过共价键与多糖较好的结合在一起。

图2 Msp-1 和Se-Msp1 红外光谱分析Fig.2 Infrared spectral analysis of Msp-1 and Se-Msp1
2.4 多糖的分子量、粒径和电位分析
建立葡聚糖标准曲线为lg Mw=0.025x+0.788;图3 可知,Msp-1 的出峰时间为21.88 min,Se-Msp1的出峰时间为20.18 min,分别计算得到Msp-1、Se-Msp1 的Mw分别为1.574×106、3.482×105Da,Mn分别为1.337×106、3.397×105Da。表2 可知,Msp-1 分子量、分散系数(PDI)均大于Se-Msp1,Se-Msp1 的PDI 值接近1,说明硒化改性降低了多糖分子量,提高了多糖均一性和稳定性[36],该结果与柯宏伟等[30]研究结果一致,可能硒化处理破坏了多糖结构,使其分子量变小,更易于与Se 基团结合。研究表明,小分子量多糖在机体内更易被吸收利用,其生物活性往往高于大分子量多糖[37],据此推测Se-Msp1 的生物活性可能高于Msp-1。

表2 Msp-1 和Se-Msp1 的分子量、粒径、电位分析Table 2 Molecular weight,particle size,and potential analysis of Msp-1 and Se-Msp1
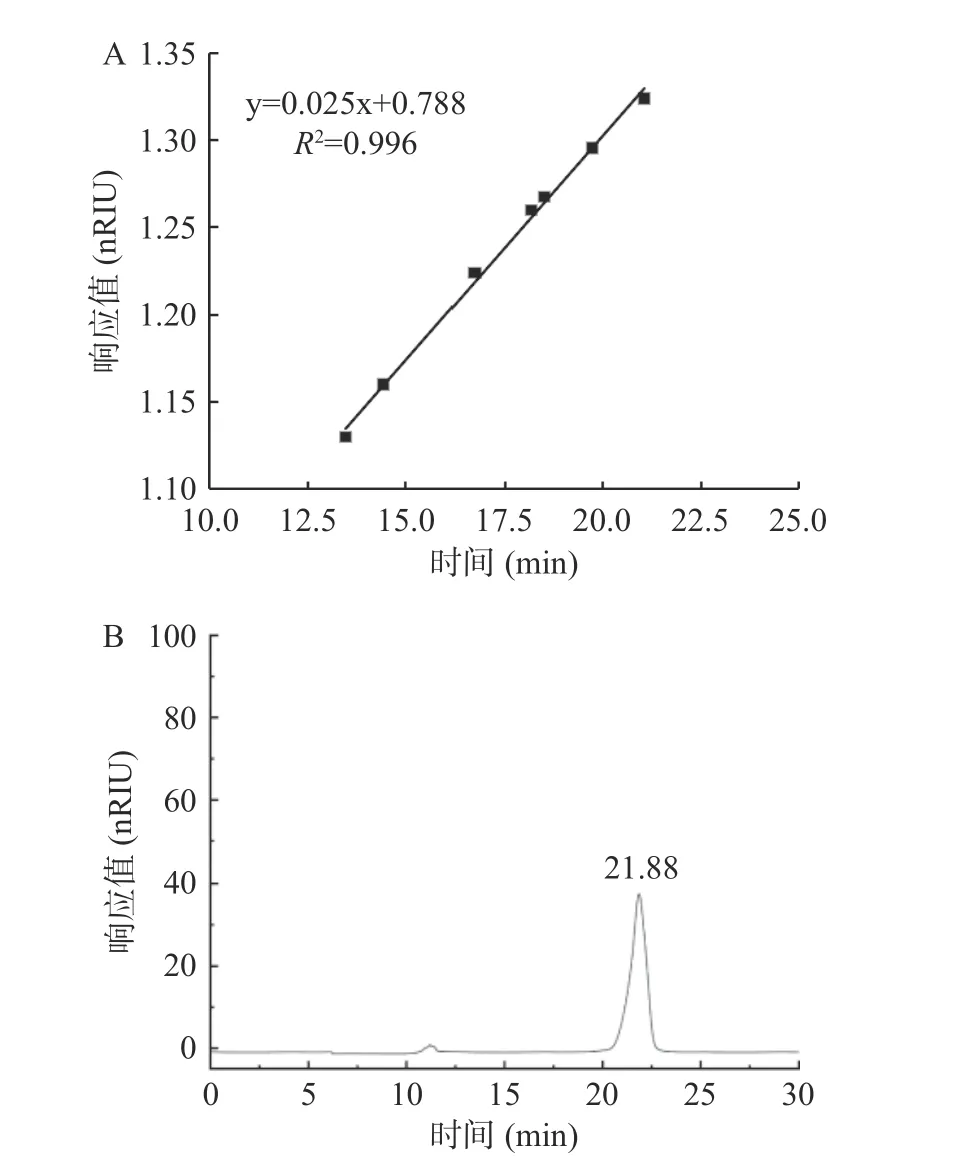
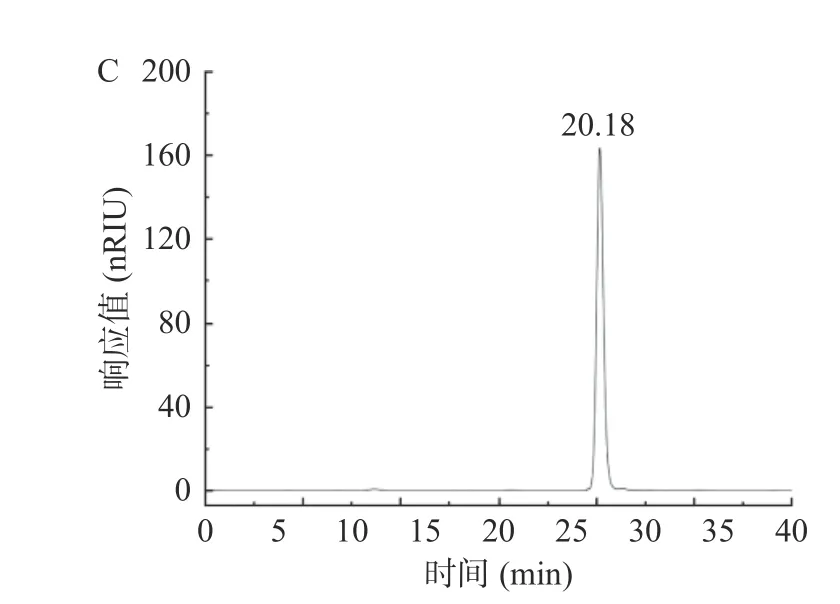
图3 Msp-1 和Se-Msp1 分子量分布Fig.3 Molecular weight distribution of Msp-1 and Se-Msp1
从表2 可知,Msp-1 的粒径显著大于Se-Msp1(P<0.05),Se-Msp1 的粒径降低了49.00%,而Se-Msp1 的绝对电位相比Msp-1 提高了191.22%(P<0.05),可见Se-Msp1 的分散度较高,稳定性好,说明硒酸化修饰使得多糖表面电荷绝对值显著升高,进一步提高了羊肚菌多糖在溶液体系中的稳定性,本研究结果与古佩娴等[38]、LIAO 等[39]研究结果一致。
2.5 多糖电镜观察
图4 为Msp-1 和Se-Msp1 在2000 倍下的扫描电镜图。图中显示,Msp-1 形貌不规则,凹凸不平,紧密连系在一起,粘性较强,在溶液状态下易凝结,刚性较强;Se-Msp1 表面同样凹凸不平,但存在大量的沟壑,表面有很多裂纹,在溶液中易分散溶解,不凝结,稳定性强。说明硒酸化改性使得多糖的结构出现了较大的变化,提高了Se-Msp1 的稳定性。刘韫滔等[19]、古佩娴等[38]分别对牛肝菌和猴头菇多糖硒化改性处理,均发现硒化改变了多糖的结构,硒多糖的稳定性更好,这与本研究结果较一致。

图4 Msp-1 和Se-Msp1 的扫描电镜图(2000×)Fig.4 Scanning electron microscopy of Msp-1 and Se-Msp1(2000×)
2.6 多糖的单糖组成分析
Msp-1 和Se-Msp1 两种多糖的单糖组成见图5。与单糖标准品比对,发现Msp-1 主要由Man、Glc和Gal 组成,根据峰面积归一法,Man:Glc:Gal=1:5.64:3.28。多糖经硒酸化修饰后,发现Se-Msp1主要由Man、GlcUA、Glc、GalUA、Gal 组成,摩尔比1:0.42:3.57:3.34:1.86。Msp-1 未检测到糖醛酸,可能由于含量较低未检测出,说明Msp-1 的主链主要为中性多糖,Se-Msp1 中糖醛酸含量占比为36.91%,其主链可能为中性多糖侧链则为酸性多糖。ZHANG 等[40]和LI 等[33]对羊肚菌多糖进行单糖分析,其结果均显示羊肚菌多糖主要由甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)组成,葡萄糖含量均最高,这与本研究结果一致。杨燕敏等[28]和王丽波等[41]分别对红枣多糖和蒲公英多糖进行硒化改性,结果表明,硒化多糖会改变单糖的组成及摩尔比,且糖醛酸含量明显增高,这与本研究结果相似。本研究中羊肚菌多糖硒酸化处理后,单糖组成中增加了葡萄糖醛酸和半乳糖醛酸,使得多糖从中性变成了酸性,出现这一原因可能是多糖在HNO3和Na2SeO3作用下破坏了糖苷键,多糖得到了修饰和加工[42]。

图5 Msp-1 和Se-Msp1 的单糖组成Fig.5 Monosaccharide composition of Msp-1 and Se-Msp1
2.7 Se-Msp1 对大鼠力竭游泳时间的影响
从图6 可知,在整个试验周期中,各组大鼠体重均呈现大幅升高,在试验前和试验的第1、2、3、4、5 周时,不同处理组间的大鼠体重均不存在显著差异(P>0.05),大鼠体重增加是正常的生长发育引起,说明灌胃红景天苷和Msp-1、Se-Msp1 均对大鼠生长不存在显著的促进或抑制作用。与Con 相比,红景天苷和两种多糖均显著提高了大鼠力竭游泳时间(P<0.01);与红景天苷相比,Msp-1 和Se-Msp1-L 组大鼠力竭游泳时间显著降低(P<0.05),Se-Msp1-M 不存在显著差异(P>0.05),而Se-Msp1-H 组力竭游泳时间显著提高了7.28%,另外,与Se-Msp1-L 相比,Se-Msp1-M、Se-Msp1-H 组力竭游泳时间分别显著提高了9.25%(P<0.05)和20.69%(P<0.01),与Se-Msp1-M 相比,Se-Msp1-H 组大鼠力竭游泳时间显著提高了10.47%(P<0.05)。上述结果表明,Msp-1、Se-Msp1 均具有较好的抗疲劳作用,两者中Se-Msp1 效果更好。
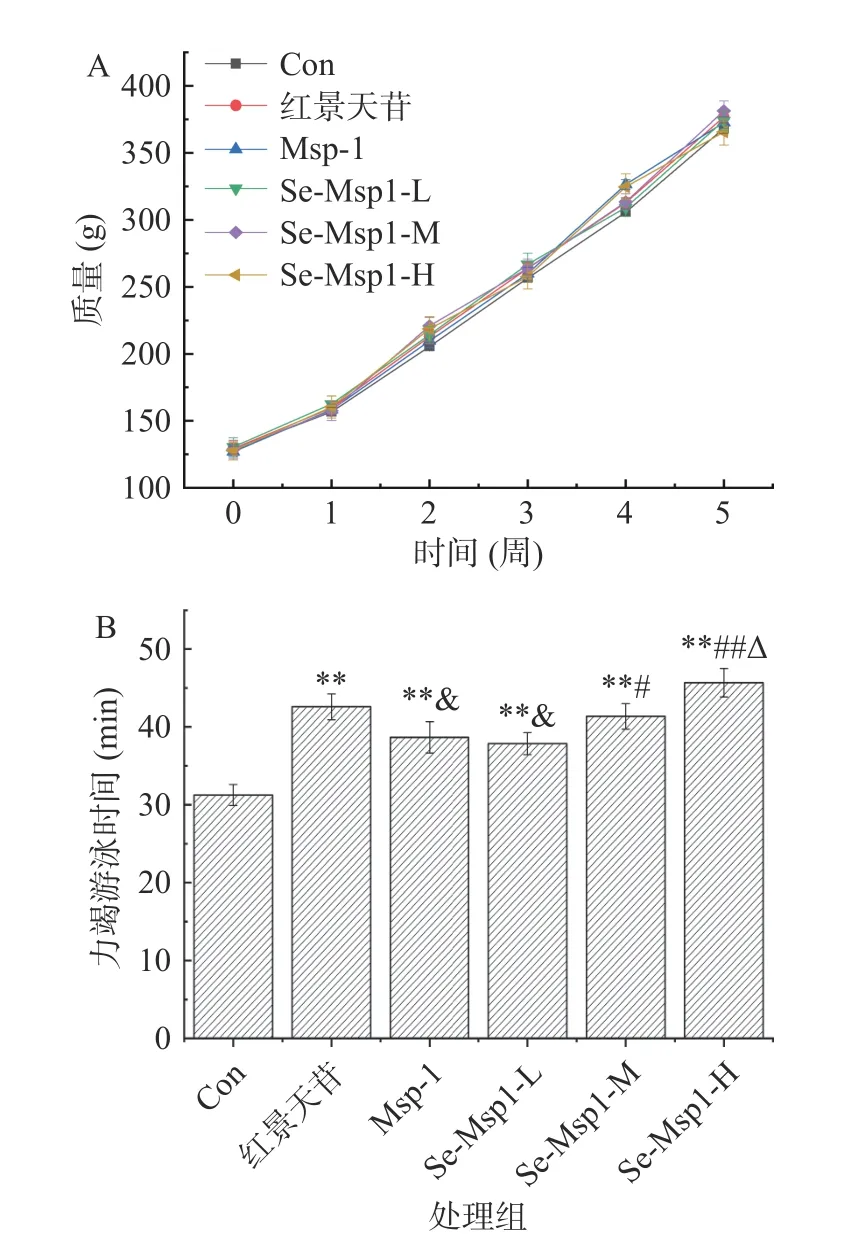
图6 Se-Msp1 对大鼠体重和力竭游泳时间的影响Fig.6 Effect of Se-Msp1 on the weight and exhaustive swimming time in rats
2.8 Se-Msp1 对大鼠肝糖原(HG)和肌糖原(MG)含量的影响
HG 和MG 是给机体提供能量的主要糖原形式,糖原储备与机体的抗疲劳能力呈正相关,糖原储备越多机体的抗疲劳能力越强[43]。从图7 可知,与QCG 相比,E-CG、红景天苷、Msp-1、Se-Msp1 组大鼠体内HG、MG 含量均显著降低(P<0.01),说明力竭游泳运动消耗了体内大量的糖原,运动疲劳模型建立较成功;与E-CG 相比,红景天苷、Msp-1、Se-Msp1的HG 和MG 含量均显著提高(P<0.01),与Se-Msp1-L 相比,Se-Msp1-M、Se-Msp1-H 组HG 含量分别显著提高了18.05%(P<0.05)、30.40%(P<0.01),MG含量分别显著提高了22.12%(P<0.01)、30.91%(P<0.01),说明红景天苷、Msp-1、Se-Msp1 均提高了大鼠体内糖原储备,发挥了较好的抗疲劳作用,且Se-Msp1 的抗疲劳效果与剂量呈依赖关系,这与曹亮[25]的研究结果相一致。另外,在相同剂量下,与Msp-1 相比,Se-Msp1-M 的HG 和MG 含量分别提高了19.04%、8.89%,表明硒酸化得到的酸性多糖Se-Msp1 对提高糖原储备具有更好的效果。SHAO等[44]、吕亚辉等[16]分别在研究茶叶硒多糖和灵芝硒多糖的抗疲劳作用时,发现这两种硒多糖均显著提高了大鼠体内糖原含量,本文研究的羊肚菌硒多糖具有同样的效果。

图7 Se-Msp1 对大鼠体内HG、MG 含量的影响Fig.7 Effect of Se-Msp1 on HG and MG contents in rats
2.9 Se-Msp1 对大鼠血清乳酸(BLA)和尿素氮(BUN)含量的影响
机体在运动过程中会产生BLA 和BUN 等代谢产物,降低了机体的运动耐力[6]。从图8 可知,与QCG 相比,运动疲劳组的E-CG、红景天苷、Msp-1、Se-Msp1 组大鼠血清内BLA、BUN 含量均显著升高(P<0.01),且E-CG 组的增幅最大,说明大鼠在力竭游泳运动过程中体内产生大量的乳酸和尿素氮,堆积的乳酸和尿素氮渗透到了血清中;与E-CG 相比,红景天苷、Msp-1、Se-Msp1 低、中、高剂量组大鼠血清内BLA 和BUN 含量均呈显著降低(P<0.01),在相同剂量下,与Msp-1 相比,Se-Msp1-M 组BLA 和BUN 分别显著降低了8.83%、21.44%(P<0.05、P<0.01);与Se-Msp1-L 相比,Se-Msp1-M、Se-Msp1-H 组BLA 含量分别显著降低了21.45%、28.72%(P<0.01),BUN 含量分别显著降低了14.01%、21.56%(P<0.05、P<0.01)。上述结果说明,红景天苷、Msp-1、Se-Msp1 均显著降低了大鼠体内BLA和BUN 含量,具有较好的抗疲劳效果,Se-Msp1 效果优于Msp-1。QIAN 等[9]发现羊肚菌硒多糖对巨噬细胞的吞噬能力和提高机体的免疫力效果优于普通羊肚菌多糖,这一研究结果与本研究结果共同表明硒化的羊肚菌多糖具有更高的生物活性。

图8 羊肚菌多糖对大鼠血清中BLA 和BUN 含量的影响Fig.8 Effects of Morchella polysaccharide on BLA and BUN in rat serum
2.10 Se-Msp1 对大鼠骨骼肌线粒体内丙二醛(MDA)含量和抗氧化酶活性的影响
机体的运动主要靠骨骼肌完成,骨骼肌内线粒体中氧化应激水平升高会抑制线粒体的合成,进而影响到ATP 的生成,降低机体的运动耐力[45]。从图9 可知,与Q-CG 相比,E-CG 组大鼠骨骼肌线粒体内MDA 含量显著升高(P<0.01),SOD、CAT 和GSH-Px 活性均显著降低(P<0.01),说明大鼠在运动疲劳状态下,骨骼肌线粒体内积累了大量的MDA,使得抗氧化酶活性降低,细胞的氧化应激水平升高。与E-CG 相比,红景天苷、Msp-1、Se-Msp1 低、中、高剂量组MDA 含量均显著降低(P<0.01),抗氧化酶活性均显著升高(P<0.01),与Se-Msp1-L 相比,Se-Msp1-M、Se-Msp1-H 组MDA 含量分别显著降低了8.11%、15.02(P<0.05),SOD、CAT、GSH-Px 活性分别显著升高了24.52%、20.44%、26.45%和38.86%、37.34%、45.06%(P<0.01)。综上,Msp-1、Se-Msp1 在大鼠体内均发挥了较好的抗氧化作用,显著降低了大鼠骨骼肌线粒体的氧化应激水平,从而发挥较好的抗疲劳作用。此外,相同剂量下,Se-Msp1-M 组MDA 含量和抗氧化酶活性均与红景天苷组不存在显著差异(P>0.05),而Se-Msp1-M 组MDA 含量低于Msp-1 组,抗氧化酶活性则均高于Msp-1 组,进一步提示羊肚菌硒化多糖的抗疲劳作用高于普通多糖,吕亚辉等[16]、姚万玲[46]分别对灵芝多糖和党参多糖进行硒化修饰,所得到的硒多糖其清除自由基能力和提高抗氧化酶活性的能力均显著高于普通多糖。
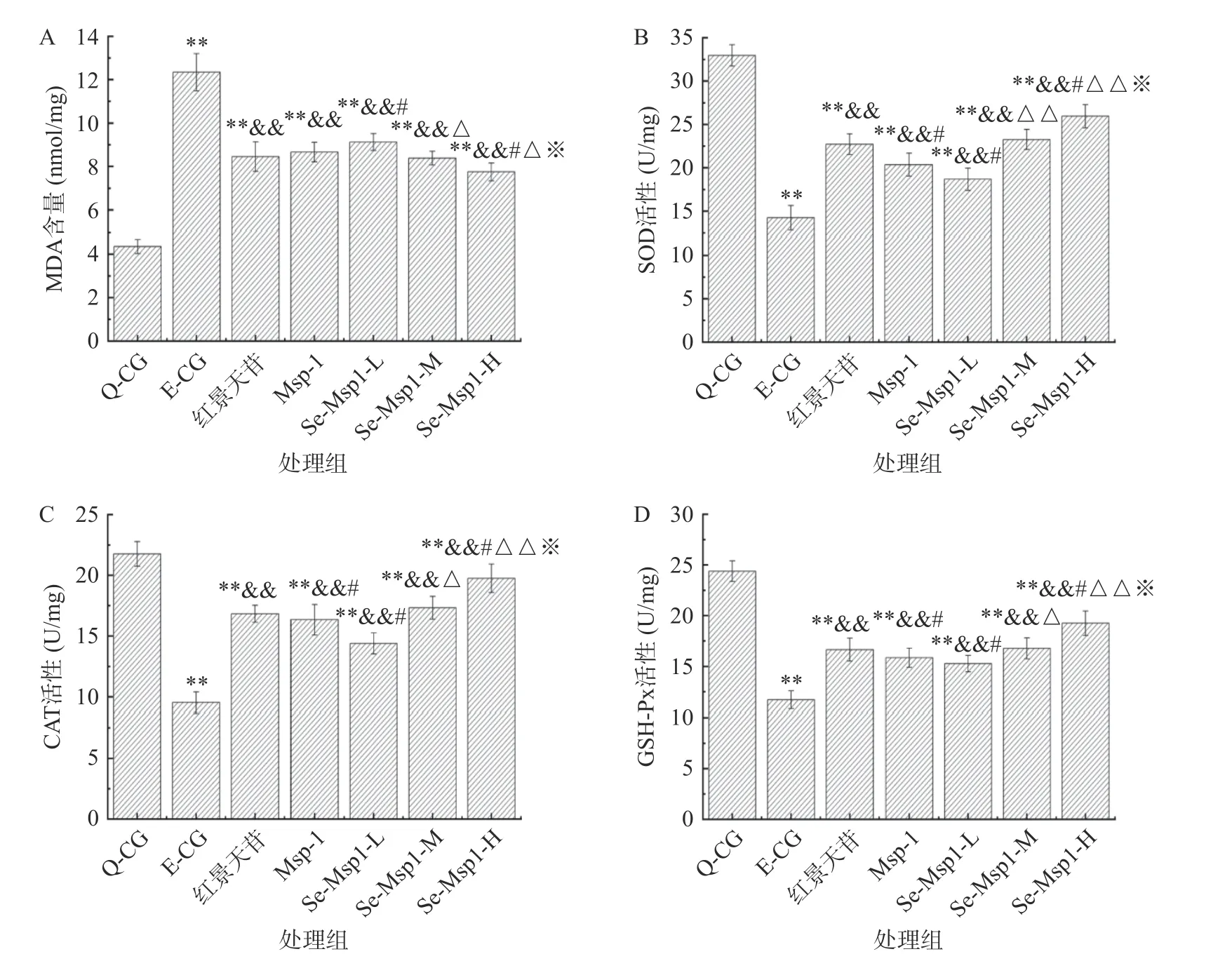
图9 Se-Msp1 对大鼠骨骼肌MDA 含量和抗氧化酶活性的影响Fig.9 Effects of Se-Msp1 on MDA content and antioxidant enzyme activity in skeletal muscle of rats
3 结论
本研究从羊肚菌子实体中提取得到羊肚菌普通多糖,经纤维素柱层析分离得到一个最大组分Msp1,其占比达到85.25%;将其通过硒酸化处理得到羊肚菌硒多糖(Se-Msp1),化学组分分析发现Se-Msp1 中硒含量达到9.56 mg/g,多糖含量为56.34%,红外光谱分析表明,其异头碳为α构型,重均分子量为3.482×105Da。单糖组成分析结果显示,Se-Msp1 由Man、GlcUA、Glc、GalUA、Gal 等单糖组成,具体的摩尔比为1:0.42:3.57:3.34:1.86,其中糖醛酸占比36.91%,推测Se-Msp1 的主链可能为中性多糖侧链为酸性多糖。在大鼠的抗疲劳能力测定试验中,发现Msp-1 和Se-Msp1 均极显著提高了大鼠力竭游泳时间(P<0.01),表现出较好的抗疲劳效果,在大鼠的运动疲劳模型中,实验结果显示,Se-Msp1 不仅极显著提高了HG、MG含量(P<0.01),还降低了BLA、BUN 含量(P<0.01),同时还降低了骨骼肌中线粒体内MDA 含量(P<0.01),提高了线粒体内抗氧化酶活性(P<0.01),进而表现出较好的抗疲劳作用。另外,经过硒酸化得到的Se-Msp1 的抗疲劳作用效果显著高于普通多糖Msp-1。本研究为羊肚菌多糖的深入开发利用提供了新思路,同时也为开发天然有机硒补充剂提供了理论参考,接下来将会继续研究解析羊肚菌硒多糖结构,并进一步分析硒多糖的抗疲劳作用机制。

