分布式甲醇重整制氢动力学及反应器强化研究
牛丛丛,栾学斌,徐 润,夏国富
(中石化石油化工科学研究院有限公司,北京 100083)
能源是国家经济和社会发展的基础。在“碳达峰、碳中和”背景下,我国能源消费结构正朝着以氢能、太阳能和新一代核能为代表的清洁能源优化发展。氢能使用过程没有CO2排放,生成的水可参加到地球大气的水循环系统中,因此氢能是未来应对气候变化、建设脱碳社会的理想能源[1-2]。甲醇是高含氢有机氢载体,其氢质量分数为12.5%,远高于美国能源部制定的氢载体储氢质量分数7.5%的要求[3]。除此以外,以甲醇为原料的制氢技术还具有以下优势:甲醇是大宗商品,运输方便、安全性高、经济性好;甲醇来源除煤制甲醇外,还可以通过捕集CO2加氢还原获得;甲醇制氢的氢气产量高、CO含量低、流程简单[4-5]。
甲醇重整制氢是成熟的工业制氢技术,并已在炼油、精细化工、制药、特种钢铁等行业得到了广泛应用[5-7]。然而,传统化工制氢装置因占地和空间等因素限制,并不适用于加氢站的站内制氢技术要求,必须对现有甲醇重整制氢技术进行二次开发。高活性催化剂是制氢设备小型化的前提条件,催化剂活性与反应器结构的匹配性是分布式甲醇制氢技术的关键。甲醇重整制氢为吸热过程,由于床层热阻的存在,床层内会存在明显的温度梯度和冷点。催化剂活性越高,单位体积床层吸热量越大,温差越显著;而温度分布不均和局部低温会导致催化剂表观活性大幅下降,造成反应器出口甲醇转化率降低,进而降低分布式甲醇制氢装置的整体效率。综上,催化剂表观利用效率与反应器的传质、传热性能密切相关。
在各种制氢反应器中,微通道反应器具有微米级反应通道、较大的比表面积,而且传质、传热性能优异,但由于其容量过小,主要应用于500 L/h以内的微型制氢系统,有限的产氢能力限制了其在分布式制氢场景的应用[8-13]。相比之下,中小型甲醇重整反应器更适合于分布式制氢场景,但其传质、传热性能亟需强化。然而,目前关于中小型甲醇重整反应器的强化研究报道较少[7]。
基于此,本课题利用RSR-501型高效甲醇重整制氢催化剂,开展甲醇重整制氢反应动力学和中小型甲醇重整反应器过程强化研究。首先,通过条件试验和模型拟合,获得可准确描述甲醇重整制氢本征反应性能的动力学模型,并基于对颗粒尺度的扩散-反应分析,优化催化剂颗粒尺寸;进而,利用固定床反应器模拟探究高空速条件下催化剂活性与反应器结构的匹配问题,并优化反应器结构尺寸以强化传热、提高综合能效,为中小型甲醇制氢撬装反应器的开发和过程强化研究提供借鉴。
1 反应动力学模型
1.1 条件试验
RSR-501型甲醇重整催化剂,为中石化石油化工科学研究院有限公司开发的工业催化剂,主要由氧化铜和氧化锌组成,其质量分数分别为71%和13%。
为获取甲醇重整反应动力学模型,首先利用实验室固定床反应器测定了不同反应条件下RSR-501催化剂上甲醇重整的本征反应性能。具体试验参数:催化剂装填量为10 mL,颗粒尺寸为20~40目,并以40 mL瓷球作稀释剂,稀释后床层总装填高度为220 mm。电加热炉为开启式5段加热、5段控温炉,可维持恒温区高度为500 mm,床层近似等温控温(温差不大于1 ℃)。不同工艺参数的考察范围:反应温度为230~260 ℃,反应压力为1.5~2.0 MPa,体积空速为2.0~4.0 h-1,进料水醇摩尔比[n(H2O)∶n(CH3OH)]为1.78。条件试验评价结果及对应条件下的热力学平衡数据如表1所示。
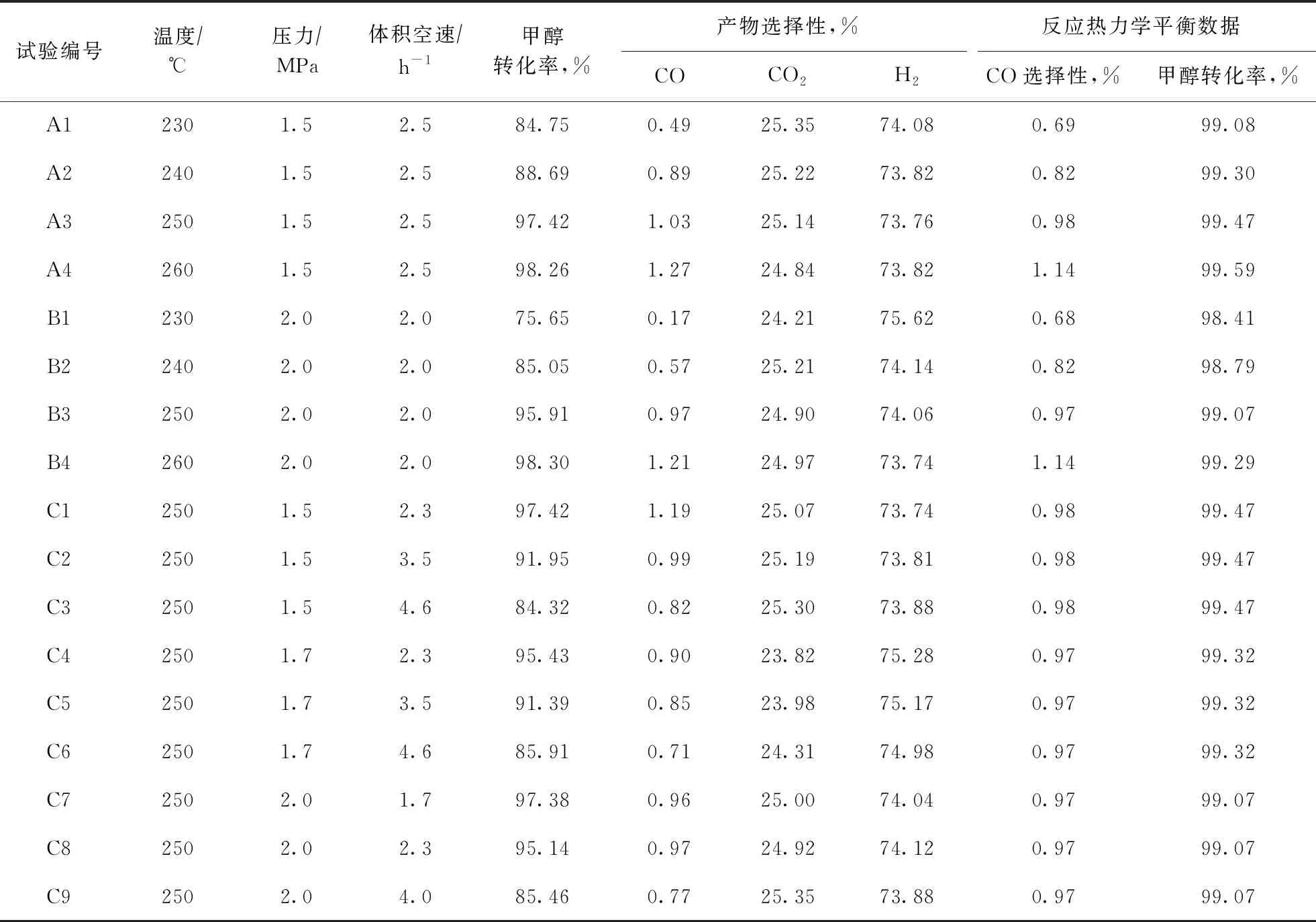
表1 RSR-501催化剂上不同反应条件下甲醇重整本征反应性能和热力学平衡数据
甲醇重整制氢反应体系为多组分反应体系,主要发生蒸汽重整(SR)、甲醇分解(DE)和水煤气变换(WGS)3种反应,分别如式(1)~式(3)所示[14]。

(1)

(2)

(3)
其中SR和DE反应程度决定了原料甲醇的转化率,而WGS反应程度影响CO和CO2的选择性。
首先分析原料空速对反应性能的影响,对比C1~C3,C4~C6,C7~C9试验结果,由表1可知,在250 ℃、反应压力恒定条件下,随着空速提高,甲醇转化率逐渐下降,反应逐渐远离热力学平衡。进而,从反应热力学角度分析温度和压力的影响,观察A1~A4及B1~B4试验结果,由表1可知,在维持反应压力和液相空速不变条件下,将反应温度由230 ℃提高至260 ℃,甲醇转化率明显增加,CO选择性提高而CO2选择性降低。这是由于SR和DE反应均为吸热反应,而WGS反应为放热反应,提高反应温度促进了SR和DE反应平衡向右移动,而抑制了WGS反应。相比之下,压力对产品选择性的影响较小,在反应温度为250 ℃、体积空速为2.3 h-1时,反应压力从1.5 MPa提高至2.0 MPa,甲醇转化率仅从97.42%降至95.14%。这是由于SR和DE反应均为体积增大的平衡反应,压力增加有利于逆向反应,故而甲醇转化率下降;同时,WGS反应平衡不受压力影响。
1.2 反应动力学模型
依据反应机理中涉及的反应数量,甲醇蒸汽重整动力学模型可分为单速率模型(SR)、双速率模型(SR-DE,DE-WGS,SR-rWGS)以及三速率模型(SR-DE-WGS),其中rWGS为逆水煤气变换反应。单速率模型仅能预测原料消耗速率,无法得到产物选择性信息,一般较少采用。SR-DE机理认为SR和DE反应同时发生,两者速率差异决定了CO和CO2选择性的差异;DE-WGS和SR-rWGS机理均为串联机理,前者认为CO为初级产物,再通过WGS反应生成二级产物CO2,而后者刚好相反,认为CO是二级产物[15]。SR-DE-WGS机理是最复杂的综合机理,最早由Peppley[16]提出,该机理认为SR和DE反应同时发生,并且CO和CO2可通过WGS反应相互转化。由于式(1)~式(3)反应的独立反应数为2,即其中任一反应均可由其余两种反应来表示,因此很难通过数据拟合的手段来区分双速率模型和三速率模型。
由表1可知:在远离反应热力学平衡的条件下,产品气中CO含量明显低于水煤气变换反应的热力学平衡值(见试验A1,B1,B2,C3,C6,C9),说明实际反应过程不可能先通过DE反应生成CO,CO再经WGS反应生成CO2,从而否定了DE-WGS反应机理[15,17-18];同理,若SR-rWGS机理成立,则CO选择性会随着停留时间增加而增大,但实际CO选择性随着空速的变化规律并不完全支持此机理(见试验C1~C9)。因此,该反应过程遵循SR-DE反应机理的可能性较大,但也无法排除SR-DE-WGS机理的可能性,仍需要通过其他手段予以佐证,如同位素标记试验等。
考虑到三速率模型的复杂性,从工程应用的角度出发,本研究采用双速率模型,即SR-DE机理对试验数据进行拟合。从表1可知:随着反应温度提高,甲醇转化率逐渐提高(试验A1~A4及B1~B4),最终达到热力学平衡;而CO选择性基本一直随着温度的升高而增大,说明DE反应比SR反应具有更高的反应活化能,高温更有利于DE反应的发生。
依据形式不同,动力学模型可分为幂函数模型和L-H型动力学模型[15]。其中,包含热力学平衡常数的幂函数模型虽然未考虑基元反应的机理步骤,但形式更加简单、更具实用性,因此许多学者对幂函数模型进行了广泛的研究[9,16-21]。
基于SR-DE机理的幂函数反应动力学模型如式(4)~式(7)所示。
(4)
(5)
(6)
(7)
式中:r为反应速率,mol/(g·h);k为指前因子;a1,a2,b1,c1,c2,e1,e2分别为待定指数项,无因次;E为反应活化能,J/mol;p为组分分压,MPa;β为反应可逆因子,无因次;K1、K2分别为反应平衡常数。
吴倩等[19]基于商业甲醇制氢催化剂,在温度为220~280 ℃、压力为1.3~2.7 MPa、体积空速为0.8~2.0 h-1、n(H2)∶n(CH3OH)为1.78~2.63的条件下,采用SR-DE幂函数动力学模型研究了甲醇重整制氢反应动力学,并优化了动力学模型参数。由于本研究动力学参数与文献[19]相近但催化剂不同,因而需要在其基础上利用条件试验数据对模型的反应活性参数进行修正。因此,将表1中未达平衡转化率的试验数据(共9组)和假设的动力学模型代入典型的理想平推流反应器模型[14]中,进行动力学模型的参数校正,得到SR和DE反应的动力学校正系数,结果如图1所示。由图1可知,与文献[19]报道动力学模型相比,本研究使用RSR-501催化剂时SR和DE反应的动力学校正系数分别为1.8~2.8和1.5~2.5。为简化计算,将由试验数据拟合得到的校正系数进行算数平均处理,得到使用RSR-501催化剂时SR和DE反应的动力学校正系数分别为2.1和1.9。因此,可以认为RSR-501的催化活性提高约1倍。
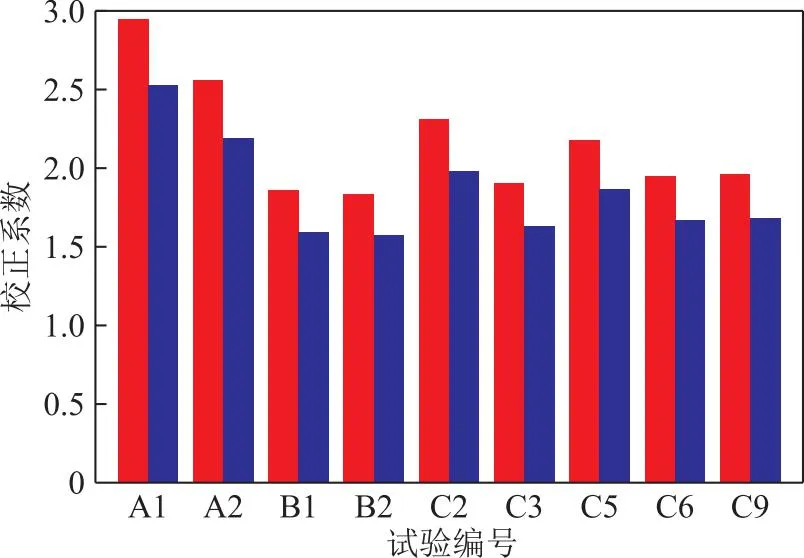
图1 不同试验点的活性校正系数
1.3 催化剂颗粒尺寸优化
甲醇重整制氢催化剂通常采用共沉淀法制备,催化剂细粉经压片成型后得到毫米级圆柱形颗粒,用于列管式固定床反应器。考虑到内扩散阻力与催化剂活性息息相关,因此需要考察大颗粒催化剂内传质阻力的大小,并优化催化剂颗粒尺寸。
梯尔(Thiele)模数(Φ)的平方与有效因子(η)的乘积(Φ2η)可用于判定内扩散阻力的影响,由式(8)计算得到。当Φ2η<0.16时,η≈1,内部传质对反应速率无明显影响;当Φ2η>3.0时,η<1/3,内部传质对反应速率有明显影响;当Φ2η介于0.16和3之间时,内部传质对反应速率有影响但不显著[22]。
(8)
式中:Lp为扩散特征尺寸,m;(-rA)obs为试验测定的甲醇表观消耗速率,mol/(g·h);CAs为反应工况下气相主体的甲醇摩尔浓度,mol/m3;De为有效扩散系数,m2/s,可通过Wilke-Bosanquet模型计算并采用空隙率(θ)和曲折因子(τ)校正得到,其计算式见式(9)~式(10)。
(9)
(10)
式中:Di,g为气相综合扩散系数,m2/s;Di,m和Di,k分别为气相分子扩散系数和努森扩散系数,可分别通过Fuller公式和分子动理论计算得到[23]。
利用式(8)计算圆柱形催化剂不同尺寸(直径×高度)时,内扩散阻力对反应表观反应速率的影响,结果如图2所示。由图2可知:在考察的温度范围内,裂解反应的Φ2η值远低于临界值0.16,说明内传质阻力对裂解反应速率无明显的影响,即裂解反应为动力学控制;对于蒸汽重整反应,当催化剂颗粒尺寸从5 mm×5 mm减小至4 mm×3 mm时,内扩散阻力对反应速率仍有影响,但Φ2η值已大幅减小(约50%)。上述结果说明,裂解反应的η近似等于1,而蒸汽裂解反应的η值需要通过颗粒建模计算获得。兰闪闪等[24]采用颗粒模拟耦合非均相反应器模型,详细计算了Cu50Zn30Ce10Al10催化的裂解反应和蒸汽重整反应的有效因子,结果发现沿床层轴向不同位置处的裂解反应的η趋近于1,而蒸汽重整反应的η介于0.5~0.9之间。

图2 不同尺寸圆柱形催化剂内扩散阻力影响
2 反应器模拟
甲醇重整制氢反应器内涉及化学反应、流体流动、传质和传热的耦合等多重因素,局部催化活性和反应器热负荷的平衡关系决定着反应器的性能及制氢过程的整体效率。建立固定床反应器数学模型,并与动力学模型耦合,可以探究催化剂活性与反应器结构的匹配关系,进行反应器结构尺寸的优化,实现过程强化。
2.1 反应器数学模型的建立
反应器数学模型的构建以甲醇水蒸气重整单根列管反应器为研究对象。由于甲醇重整反应吸热量较大,采用一维模型难以准确描述床层内的温度分布,故选用二维模型描述反应床层内的反应-传递耦合规律。为简化模型构建,采用以下假设条件:
(1)拟均相假设,催化剂床层均匀且各向同性,床层空隙率与位置无关。
(2)理想气体假设。
(3)恒定壁温,模型边界为反应床层至反应器内壁面。
(4)稳态假设。
(5)原料在反应器入口条件下已完全气化,所有物料均为气态。
(6)假设整个床层内DE和SR反应有效因子恒定,不随床层位置而变化,结合颗粒尺寸优化结果及文献[24]中有效因子计算结果,当使用催化剂的颗粒尺寸为4 mm×3 mm时,反应器模型中甲醇裂解反应的η取值0.99,甲醇蒸汽重整反应的η取值0.75。
对组分i(CH3OH,H2O,CO,CO2,H2)分别建立物料守恒方程和能量守恒方程,如式(11)~式(12)所示。

(11)

(12)
并采用Ergun公式进行动量守恒计算:
(13)
(14)
计算的边界条件为:
z=0时,Ci=Ci,0,T=T0。
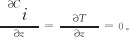
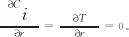
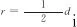
式中:r为床层中任意点到床层中心的径向距离,m;z为床层中任意点到床层入口的垂直距离,m;Ci为气相主体中各组分的浓度,mol/m3;ug为气流线速率,m/s;ρb为床层堆密度,kg/m3;ρg为气相混合物的密度,kg/m3;Cp,g为气相混合物定压摩尔热容,J/(mol·K);ΔHj为j反应的焓变,J/mol;αw为壁给热系数,W/(m2·K);λer为床层有效导热系数,W/(m·K);μg为气相混合物黏度,Pa·s;G为气相的质量流速,kg/(m2·s);Ri为组分i消耗或生成的反应速率,mol/(kg·s);dp为颗粒当量直径,m;di为管内径,m;ε为床层空隙率,无量纲,可采用式(15)估算得到。
(15)
式中:φ为颗粒球形度,无量纲;dpe为等体积当量直径,m。
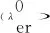
(16)
λe=εpλg+(1-εp)λs
(17)
(18)

αw采用de Wasch等提出的关联式估算[25],如式(19)~式(20)所示:
(19)
(20)
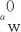
2.2 模型求解
采用COMSOL Multi-physics 6.1软件的稳态求解器对2.1部分建立的反应器内物料、热量和动量传递方程进行求解。其中物料衡算采用软件中的化学模块和多孔介质中浓物质传递模块描述,热量衡算采用多孔介质中热量传递模块描述,动量守恒采用Brinkman方程描述,混合气体的物性参数以及反应热等参数采用热力学模块进行估算。模型区域采用映射结构化网格,以床层内冷点温度为指标进行了模型的网格无关性检验,结果如图3所示。由图3可知,当网格数量超过1 400之后,模拟结果可达到足够的预测精度。
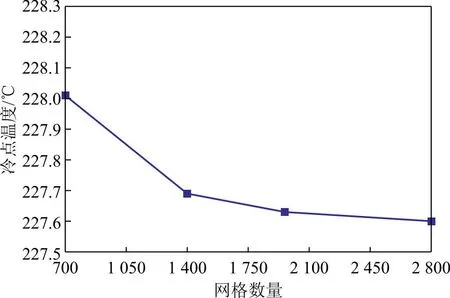
图3 网格无关性检验结果
2.3 模型验证
利用文献[25]中的甲醇蒸汽重整反应器运行数据对所建反应器模型进行验证,对比结果如表2所示。由表2可知,反应器床层出口温度(Tout)、甲醇转化率及出口气体组成的模拟结果与文献[25]数据吻合,验证了反应器模型的可靠性。
3 结果与讨论
3.1 催化剂活性与反应器结构匹配性
分布式甲醇制氢装置需具备小型化和高能效的技术特点,故要求在较高空速下甲醇重整反应器出口仍能达到热力学平衡转化率,这对甲醇重整催化剂活性提出了更高的要求。基于此,使用直径为32 mm的反应管(与传统工业甲醇制氢反应器内径一致)模拟了高空速反应条件下催化剂活性对反应器性能的影响。由于分布式甲醇制氢装置空间限制,在综合考虑反应器外形尺寸后,反应管床层有效高度(L)按1.6 m进行计算。考虑到分布式甲醇制氢工艺采用变压吸附法(PSA)进行氢气提纯,旋转阀PSA要求入口压力一般不低于1.5 MPa,综合考虑甲醇重整反应压力选择1.7 MPa。
因此,在体积空速 为1.2 h-1、n(H2O)∶n(CH3OH)为1.2、床层入口温度(Tin)为 250 ℃、反应器壁温(Twall)为 255 ℃、压力为 1.7 MPa、反应器直径为 32 mm的条件下,对比了分别选用文献[26]报道的动力学参数和基于RSR-501活性校正后的动力学参数时的甲醇转化率和床层温度,结果见图4和图5。由图4可知:在商业催化剂作用下,文献[26]报道的床层出口甲醇转化率未达到热力学平衡转化率,说明该商业催化剂不能满足分布式甲醇制氢装置的要求,但该催化剂作用下的反应器床层温度分布较均匀,这是由于该催化剂活性偏低,在较高反应空速下难以将足够的甲醇原料转化,单位体积床层内的热负荷相对较小,不会造成较大的床层温差;而采用RSR-501催化剂后,反应在距离床层入口1.2 m处即可达到热力学平衡,但反应管床层入口处出现了近50 ℃的温度梯度,且冷点温度低至205 ℃。上段床层的低温一方面会降低催化剂利用效率,另一方面会增加气相中水的冷凝析出风险。
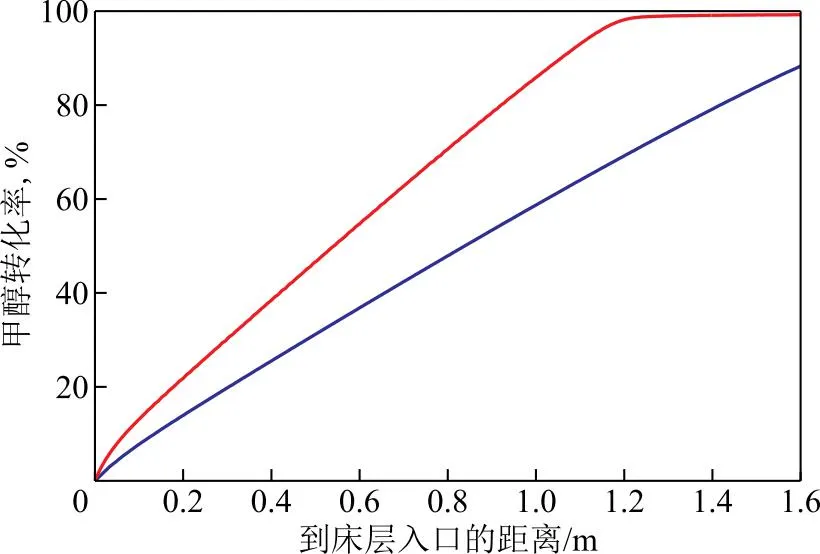
图4 不同催化剂作用下反应管中心处甲醇转化率分布模拟值
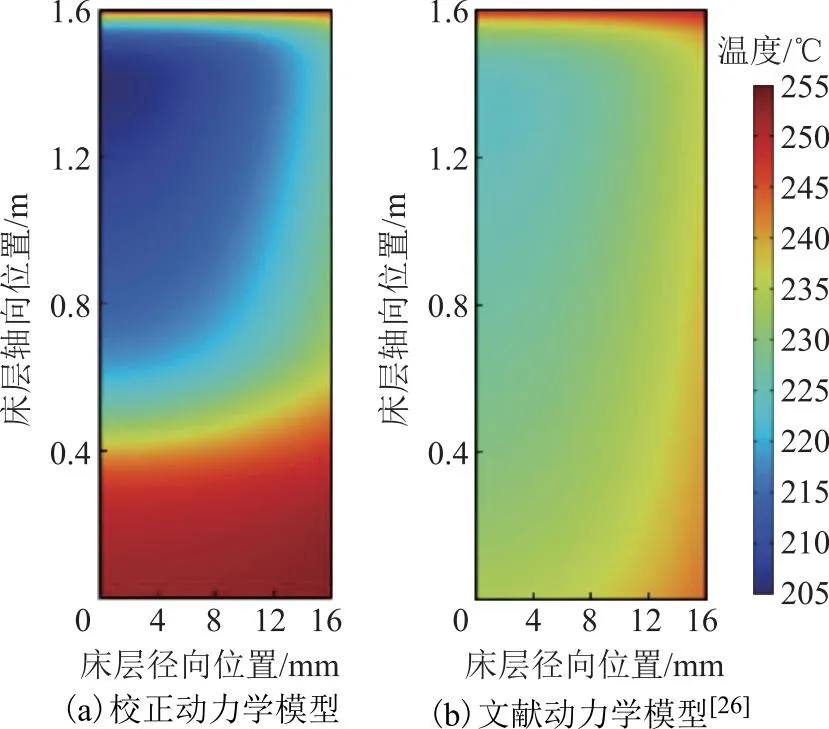
图5 不同催化剂作用下反应管内温度分布二维轴对称模拟结果
3.2 反应管结构尺寸优化
为提高催化剂利用效率,降低液态水析出的风险,需要在优化催化剂活性的基础上强化反应管传热过程。在保持反应空速不变的前提下,优化反应管内径,可减小床层径向热阻,从而提高反应管的热流密度[22]。因此,在体积空速为1.2 h-1、Tin为250 ℃、Twall为255 ℃、压力为1.7 MPa,n(H2O)∶n(CH3OH)为1.2的条件下,分别对反应管内径为32,25,20 mm时的床层温度分布和甲醇转化率分布进行模拟,结果见图6和图7。由图6可知,减小反应管内径可显著提高供热效率,减小床层温差,当反应管内径为20 mm时,床层冷点温度可提高至225 ℃以上。这主要归因于优化管径尺寸后αw关联式[25]中静态贡献项的提高,而在空速不变的情况下,动态贡献项基本不变。另外,床层温差减小也提高了上部床层催化剂的利用效率,使得原料甲醇更快地达到热力学平衡转化率。由图7可知,当采用内径为20 mm的反应管时,在床层高度约0.8 m处即可达到热力学平衡转化率。
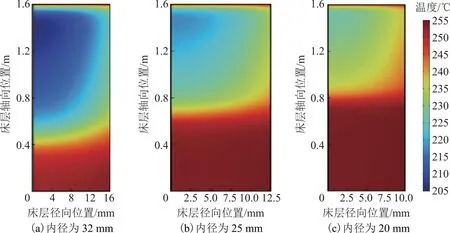
图6 反应管内径不同时床层温度分布二维轴对称模拟结果
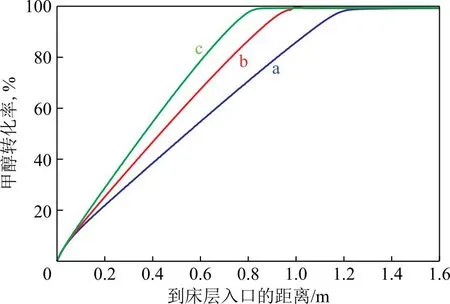
图7 不同内径反应管管中心处甲醇转化率分布模拟值
4 结 论
(1)基于甲醇制氢高效催化剂RSR-501,依据SR-DE反应机理,利用动力学试验数据校正得到了幂函数型双速率动力学模型。利用文献数据验证模型的可靠性,结果显示该模型模拟值与试验数据吻合性良好,说明该动力学模型具有较高的可靠性。
(2)内扩散影响判定结果显示:在考察的工艺条件下,甲醇裂解反应为动力学控制,而甲醇蒸汽重整反应为扩散控制。将催化剂颗粒尺寸(直径×高度)从5 mm×5 mm减小至4 mm×3 mm时,反应Φ2η值减小50%,有效强化了颗粒内传质速率,提高了催化剂表观活性。
(3)对长度为1.6 m的反应管进行模拟,结果表明:商业催化剂难以满足加氢站甲醇制氢活性要求,而RSR-501型甲醇制氢催化剂可满足高空速条件下的床层出口甲醇转化率要求。对比不同直径反应管的性能发现,使用内径为32 mm反应管时床层温度梯度较大,冷点低至205 ℃;而当反应管内径为20 mm时,床层冷点温度可提高至225 ℃以上。这说明,通过优化反应管尺寸,可强化反应管传热过程,提高供热效率,减小床层温差,提高催化剂利用效率和装置整体能效。

