某三甲专科医院住院患者皮损部位的多重耐药性分析及变化趋势
田彧旸, 邱慧, 刘娇
南方医科大学皮肤病医院,广东 广州 510091
多重耐药(multidrug resistant, MDR)指对至少3类常用的抗菌药物(每类中至少有1种抗菌药物)不敏感[1-2]。多重耐药菌(multidrug resistance bacteriaorganism,MDRO)不仅通过不断突变获得新耐药基因,还通过水平基因转移将耐药基因传递给其他细菌,使其他细菌获得耐药性[3]。当多重耐药菌合并特殊药物耐药时(如耐碳青霉烯类,对亚胺培南、美罗培南或厄他培南中任一种抗菌药物耐药),因缺乏敏感有效的抗菌药物,常发生重症感染(如败血症)甚至死亡。因此合并特殊耐药的多重耐药菌是临床中重点监控和管理的特殊耐药菌类型。
皮肤及软组织感染(skin and soft tissue infections, SSTIs)在临床中属于常见皮肤疾病。SSTIs可能独立发生,也可继发于天疱疮、湿疹等其他皮肤疾病[4-6]。与以革兰阴性菌为主的呼吸系统、消化系统等其他系统感染不同[7-8],SSTIs主要由革兰阳性球菌引发[9]。此外,皮肤疾病患者常需外用或口服糖皮质激素、免疫抑制剂等药物治疗,使得患机会性SSTIs的风险增加[10]。国内多项研究证实引起SSTIs的病原菌对多种抗生素耐药[11-12]。MRSA是发生在SSTIs中最多的多重耐药菌[6,11-12],据报道,10年内MRSA检出率逐年下降,2022年首次低于30%(28.7%)[7]。近5年,4例中小样本研究报道SSTIs中MRSA检出率在17.3%~50%之间[6,11,13-14]。既往研究样本量几乎都小于300例,且大多仅限于病原菌种类及MRSA的检出情况。面对当下皮肤病患者并发感染的高风险现状以及SSTIs的多重耐药情况,目前尚缺乏针对皮损部位的病原菌种类、特殊耐药菌的感染情况及其变化趋势的研究。因此,本文对某三甲专科医院住院患者皮损部位的多重耐药性及其变化趋势进行分析,以指导临床用药,并加强科室、医院对感染的控制与管理。
1 材料与方法
1.1 菌株来源
收集2019年10月—2022年9月南方医科大学皮肤病医院住院患者的所有临床标本培养分离的菌株,临床标本以患者皮肤及黏膜皮损取材、渗出液、引流液以及病理组织为主,剔除患者一次住院期间相同部位的重复菌株。6种主要特殊耐药菌包括耐碳青霉烯铜绿假单胞菌(CarbapenemresistantPseudomonasaeruginosa, CR-PA)、耐碳青霉烯肠球菌(CarbapenemresistantEnterococcusfaecium, CRE)、耐万古霉素金黄色葡萄球菌(Vancomycin-resistantStaphylococcusaureus,VRSA)、耐碳青霉烯鲍氏不动杆菌(CarbapenemresistantAcinetobacter, CRAB)、耐碳青霉烯肺炎克雷伯菌(CarbapenemresistantKlebsiellapneumoniae, CRKP)以及耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus,MRSA)。本研究获得医院伦理委员会批准(2023075)。
1.2 方法
通过蓝蜻蜓系统对医院的MDRO(包括主要特殊耐药菌)进行实时监控分析,通过蓝蜻蜓系统与住院电子病历系统对接获取患者的一般资料,通过与检验科信息系统对接获取标本送检部位及检出情况数据。依据文献[17]纳入MDRO。使用中国美华医疗微生物鉴定药敏分析系统MA120进行鉴定及药敏试验。
1.3 统计学处理
2 结果
2.1 皮损培养病原菌检出情况
2019年10月—2022年9月共收治住院患者9 977例,皮损标本培养共分离出3 331株病原菌,其中革兰阳性菌2 589例,占比77.72%;革兰阴性菌578例,占比17.35%;真菌164例,均为假丝酵母菌属,占比4.92%(表1)。革兰阳性菌中绝大多数为葡萄球菌属(2 458例,占比94.94%);革兰阴性菌中检出最多者为假单胞菌属(230例,占比39.72%)。
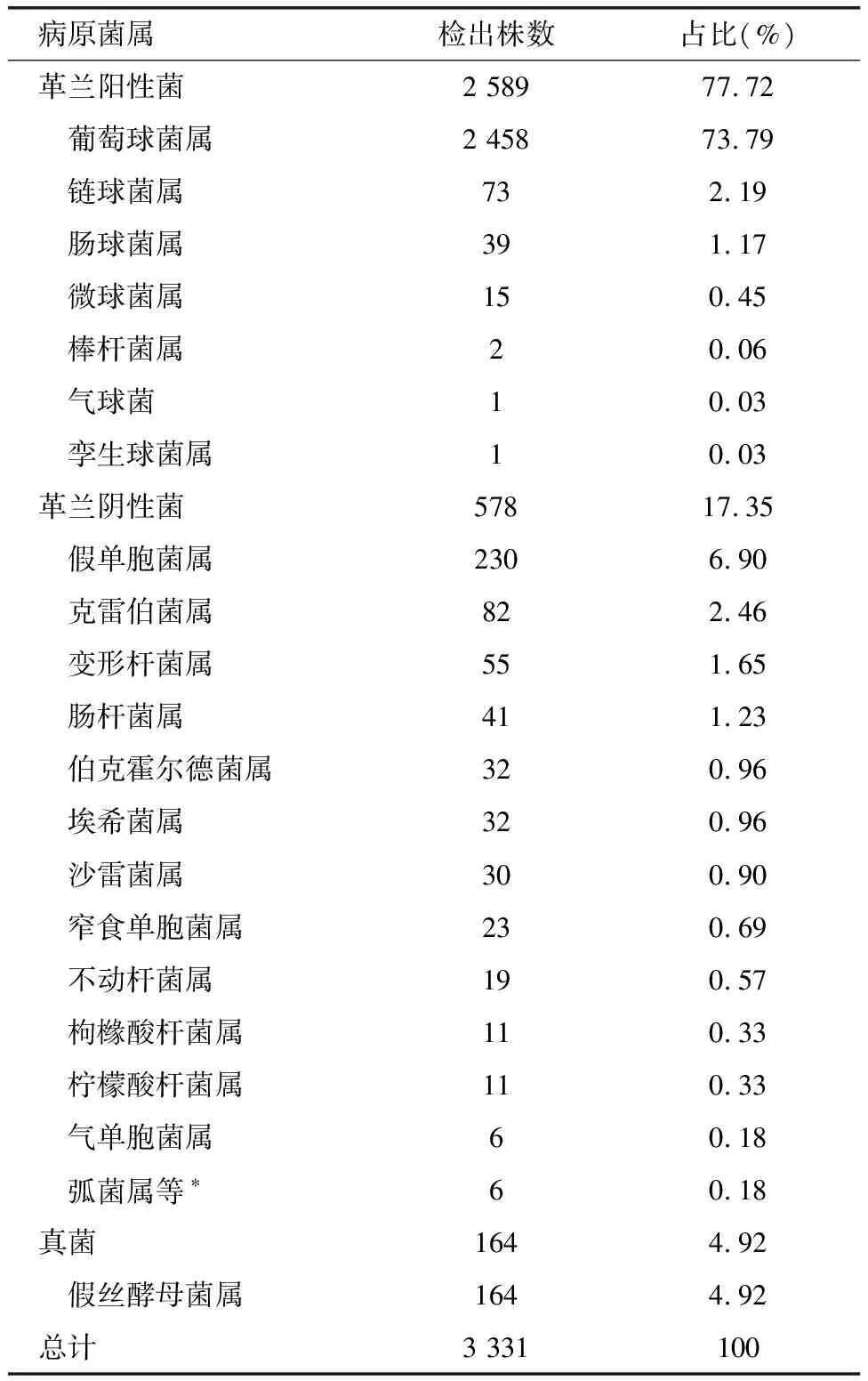
表1 2019年10月—2022年9月皮损培养检出菌属分布情况Table 1 Distribution of the pathogens in the positive skin lesion cultures from October 2019 to September 2022
2.2 皮损培养阳性患者疾病类型
检出3 331株病原菌中,患者主要诊断为湿疹性皮肤病的株数最多 (910株,27.32%),其他依次为水疱及大疱性皮肤病(834株,25.04%)、感染性皮肤病(480株,14.41%)、丘疹鳞屑性皮肤病(369株,11.08%)等(图1)。

图1 皮损培养阳性患者疾病主要类型
2.3 皮损培养检出菌株数前5的病原菌及其多重耐药情况
3年间皮损标本检出菌株数前5的病原菌依次为金黄色葡萄球菌(1 917株,57.55%)、表皮葡萄球菌(304株,9.13%)、铜绿假单胞菌(220株,6.60%)、白色念珠菌(89株,2.67%)、肺炎克雷伯菌(77株,2.31%)。其中,金黄色葡萄球菌、表皮葡萄球菌构成比呈逐年增长趋势(金黄色葡萄球菌:2=12.30,P<0.001;表皮葡萄球菌:2=5.58,P=0.018);白色念珠菌呈先上升后下降的趋势(2=9.31,P<0.05);铜绿假单胞菌、肺炎克雷伯菌构成比无明显变化(均P>0.05)。
分析皮损标本检出菌株数前5的病原菌的多重耐药检出率,金黄色葡萄球菌为41.21%,表皮葡萄球菌79.28%、铜绿假单胞菌16.82%、肺炎克雷伯菌75.32%,白色念珠菌为0。三年间表皮葡萄球菌的多重耐药检出率呈现波动上升趋势(2= 7.00,P=0.030),金黄色葡萄球菌则逐渐下降(2=13.95,P=0.001),铜绿假单胞菌、肺炎克雷伯菌的多重耐药检出率无明显变化(P>0.05,图2A、2B)。
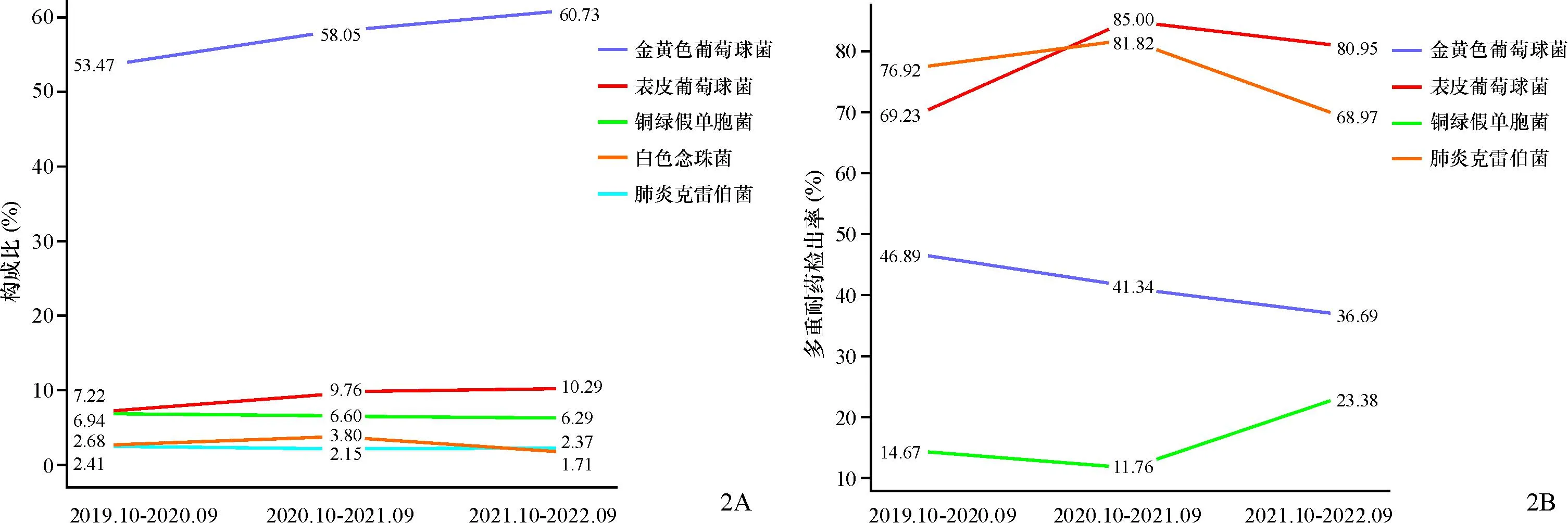
图2 皮损标本检出菌株数前5的病原菌(2A)及其耐药情况(2B)
2.4 主要特殊耐药菌检出情况
3年间共检出特殊耐药菌576株,占17.29%。主要特殊耐药菌占比分别为 MRSA 28.64%(549/1 917),CRE 31.71%(13/41),CR-AB 36.84%(7/19),CR-PA 3.18%(7/220)。3年来皮损标本的主要特殊耐药菌构成比呈下降趋势,不同年份的主要特殊耐药菌构成比之间差异无统计学意义(2=8.87,P=0.146)。3年间MRSA构成比(2=4.99,P=0.026)及检出率(2=15.89,P<0.01)逐年下降,差异具有统计学意义。各年份主要特殊耐药菌检出情况见图3。

图3 皮损培养主要特殊耐药菌检出情况
2.5 皮损标本培养医院感染情况及时间分布
2019年10月—2022年9月住院患者共9 977例,检出MDRO 1 512株(45.39%),3年间MDRO构成比呈波动下降趋势,不同年份MDRO的构成比间差异无统计学意义(2=5.86,P=0.053,表2)。皮损处发生MDRO医院感染67例,总发生率为0.67%;MDRO医院感染发生率逐年下降(2= 26.26,P<0.01)。皮损处发生MRSA医院感染30例,总发生率为0.30%;MRSA医院感染发生率逐年降低(2=11.06,P=0.001,表3)。
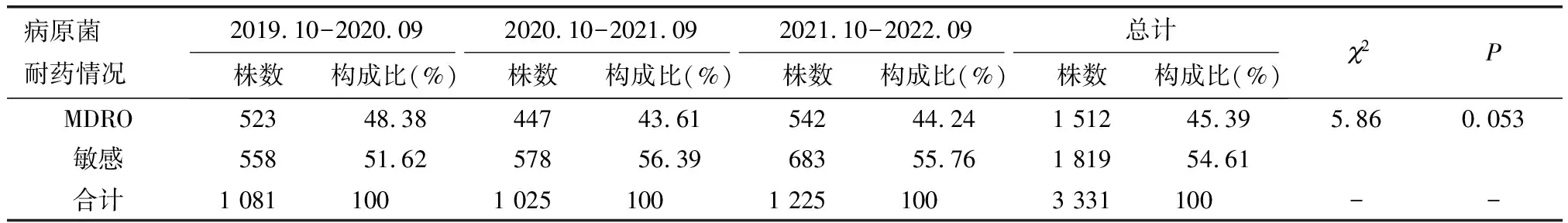
表2 2019年10月—2022年9月医院皮损培养MDRO检出情况Table 2 Distribution of MDRO in the positive skin lesion culture in inpatients from October 2019 to September 2022
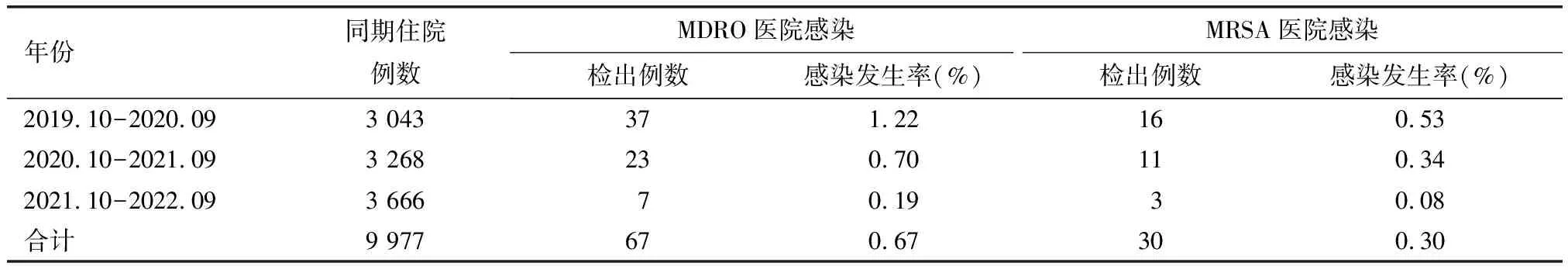
表3 2019年10月—2022年9月皮损标本医院感染特殊耐药情况Table 3 The prevalence of special drug-resistance bacteria nosocomial infection in the positive skin lesion cultures among inpatients from October 2019 to September 2022
3 讨论
本研究表明,革兰阳性菌仍是皮肤病住院患者皮肤及软组织感染的主要病原菌,其中金黄色葡萄球菌感染最多,其次是表皮葡萄球菌。革兰阳性菌及真菌的检出率高于杨晓静[11]、郭新华[12]、陈纯洲等[6]国内近年的报道,结果差异的原因一方面可能是本研究基于所有皮肤病住院患者的皮损部位病原菌情况,样本量大且病种丰富,而以往国内报道为小样本量研究,且以毛囊炎、脓疱疮、蜂窝组织炎等感染性疾病为主;另一方面是不同地区、不同标本来源使皮损部位菌种分布呈现一定差异。
本研究中,检出病原菌最多的疾病并非感染性皮肤病,而是湿疹性皮肤病、水疱及大疱性皮肤病。提示皮肤科医生应重视皮损处合并SSTIs,SSTIs未得到及时处理可能造成瘢痕、病情迁延、菌血症等后果外,在一些疾病中,病原菌也参与疾病的发生发展。以特应性皮炎(atopic dermatitis, AD)为例,有Meta分析指出,90%AD患者存在金黄色葡萄球菌感染[15]。金黄色葡萄球菌可通过释放毒素和脂蛋白等,直接损伤角质细胞、促进细胞因子释放等加重AD病情[16]。因此应关注长期使用免疫抑制剂患者的SSTIs情况,以及AD患者皮损部位合并金黄色葡萄球菌感染情况。此外,应对患者进行限制病原体接触的教育,加强患者手卫生意识;临床上经验性使用抗菌药物前应及时取皮损部位标本行病原学检查。
本研究中,6种主要检测特殊耐药菌总构成比、MRSA检出率与近年国内报道基本一致[6,11,13-14],但主要特殊耐药菌的构成不同。综合医院主要特殊耐药菌以耐甲氧西林的革兰阴性菌为主[7-8],本研究中皮肤病患者皮损处主要特殊耐药菌为MRSA,CR-AB、CR-PA、CR-KP的检出率分别为36.84%、3.18%以及0,均明显低于2021年中国细菌耐药监测公布的54.3%、17.7%以及11.3%[7]。表明革兰阴性菌的耐药情况在皮肤病患者皮损部位的控制相对尚可,革兰阳性菌仍是皮肤专科医院和医生的防控重点。
三年间表皮葡萄球菌的构成比逐年上升(P<0.05),多重耐药率波动上升(P<0.05)。表皮葡萄球菌作为皮肤常驻细菌,其皮损部位培养检出比例逐年上升的可能原因之一是留置医疗器械的广泛使用[17]。另外,随着生物制剂及新型免疫抑制剂的普及,免疫抑制后条件致病菌的感染问题也接踵而至[18],但具体关系尚缺乏实验室数据支持,需要更深入的研究。
三年间肺炎克雷伯菌MDR检出率为75.32%,较刘波等[8]研究中的肺炎克雷伯菌检出率(2018年:64.13%;2019年:60.62%)稍高。肠杆菌属的肺炎克雷伯菌可通过携带耐抗生素基因的质粒在肺炎克雷伯菌之间传播耐药性,如:携带耐碳青霉烯基因的质粒blaOXA-48及blaCTX-M-5,可在全院传播耐药,而造成CR-KP爆发[19-20]。肺炎克雷伯菌为检出数第五的病原菌,尽管三年间无CR-KP检出,但因其耐药性具有可传播性,应警惕多重耐药,对感染患者及无症状的定植患者严格管理,如辅助检查后对检查室行终末消毒、单间病房隔离等,避免引起医院感染爆发。
2021年中国细菌耐药监测指出MRSA检出率逐年下降[7]。本研究中的总多重耐药菌医院感染发生率为0.67%,且逐年下降(P<0.05),金黄色葡萄球菌多重耐药检出率、MRSA检出率及医院感染发生率均呈下降趋势(P<0.05),说明皮肤病医院对多重耐药菌、合并MRSA感染患者采取的措施具有一定效果,如单间隔离、病房每日清洁消毒、医护及患者加强手卫生、诊疗用物专人专用、医护人员行医疗诊治行为时穿隔离衣等。MRSA的医院感染发生率为0.30%,高于2021年赵建萍等[21]报道的2.16‰以及2022年何倩等[22]报道的0.78‰,差异产生的原因可能是后两者的研究在综合性医院开展,然而皮肤病患者皮损部位金黄色葡萄球菌的感染及定植与皮肤专科发生MRSA医院感染之间的相关性尚缺乏数据支持。
综上所述,皮肤疾病患者因皮肤完整性缺失、皮肤屏障受损、慢性炎症刺激及长期使用免疫抑制剂等作用下,皮损部位常合并细菌或真菌感染、定植。金黄色葡萄球菌等革兰阳性菌是皮损感染的最主要病原菌,仍是临床检测、防控的重点,临床医生应关注地区金黄色葡萄球菌的耐药迁移情况,掌握药敏情况,提高预防性使用抗生素的准确性。革兰阴性菌的感染虽少见于皮肤病患者皮损部位,但因其耐药性具有可传播性,临床亦不可忽视,同时临床医生应总结管控MDRO及MRSA的经验,关注表皮葡萄球菌等的管理。

