基于孕中期临床资料构建子痫前期疾病预测模型的研究
张翠焕 满冬梅
子痫前期(preeclampsia,PE)是一种严重的妊娠并发症[1]。早发型子痫前期(early onset preeclampsia,EOPE)是妊娠34 周以前出现的先兆子痫。PE 是孕期重要的并发症之一,对孕妇和胎儿都有一定的威胁[2]。因此,在临床上预测PE 的发生,对孕妇和胎儿的健康有着重要的意义。目前,许多国内外研究者使用机器学习算法对孕期临床资料进行分析,以建立PE 疾病预测模型[3-4]。因此在探讨如何构建子痫前期疾病预测模型方面取得了一定的进展。关于PE 的发生病因及相关机制尚未完全明确,多数认为与胎盘滋养细胞浸润能力受损、血管内皮细胞功能障碍、凝血系统功能紊乱、脂代谢及肝肾功能异常等密切相关。及早诊断和干预可改善母婴预后,是近年来产科医师研究的热点问题。如何尽早预测、准确识别发病风险对于优化PE 管理,有效降低疾病发病率与死亡率至关重要。国外研究结果表明,子宫内小螺旋动脉重构异常是 EOPE发生的重要原因[5]。但目前仍缺少一种高效的 PE 预测方法。本研究拟采用孕中期临床资料进行分析,构建预测模型,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月—2022年12月济宁市第三人民医院接诊的275 例妊娠期孕妇为研究对象。纳入标准:(1)妊娠超过20 周出现初发高血压(收缩压140 mmHg,舒张压90 mmHg),并于出生后12 周随访。(2)先兆妊娠者。排除标准:(1)多胎妊娠。(2)妊娠前已有心、脑和肝、肾和其他脏器疾病。依据《妇产科学》第8 版《妊娠高血压病》[6],选择105 例PE患者作为子痫前期组。选取170 例与PE组相同妊娠、未发生并发症的孕妇作为对照组。2组一般资料比较,差异无统计学意义(P> 0.05),具有可比性。本次研究获得济宁市第三人民医院医学伦理委员会批准。
1.2 方法
所有入选的孕妇都进行了孕前信息的登记,并在妊娠14 ~28 周在济宁市第三人民医院进行孕中期的孕妇血清学检测,收集年龄、孕次、产次、流产、存活子女、是否经产妇、不良孕产史、剖宫产史、身高、孕中期体质量、身体质量指数(body mass index,BMI)、收缩压、舒张压、中性粒细胞(neutrophils,NEU)、淋巴细胞计数(lymphocyte,LYM)、医院感染率(nosocomial infection rate, NIR)、血小板计数(platelet count,PLT)、血小板压积、血小板平均体积(mean platelet volume,MPV)、血红蛋白计数(hemoglobin,HB)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、国际标准化比值(International standard ratio,INR)、纤维蛋白原(fibrinogen,FIB)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总蛋白、白蛋白、尿素氮(blood urea nitrogen ,Bun)、 肌酐(creatinine,Cr)、尿蛋白等指标。
1.3 观察指标
根据2015 版《妊娠期高血压病诊疗指南》[7]中关于PE 的界定,即:孕20 周后出现收缩压>140 mmhg,或舒张压>90 mmHg,同时伴有以下任何一种症状:尿液中蛋白质含量>0.3 g/24 h,尿液中的蛋白质含量>1+,尿蛋白质含量<1+。
1.4 统计学处理
采用SPSS 22.0 统计学软件进行分析。计量资料以(±s)表示,组内比较采用配对样本均数t检验,组间比较采用独立样本均数t检验;计数资料用n(%)表示,行χ2检验。对差异有统计学意义的结果纳入logistic回归分析,并绘制Nomogram 图、受试者操作特征(receiver operating characteristics,ROC)曲线。P< 0.05 为差异有统计学意义。
2 结果
2.1 基本临床信息
经秩和检验发现,2组年龄、孕次、产次、流产、存活子女、经产妇、不良孕产史、剖宫产史、身高等差异无统计学意义(P> 0.05),见表1。

表1 子痫前期组与正常对照组孕妇的基本临床信息
2.2 中期临床资料
孕中期体质量、BMI、收缩压、舒张压、NEU、LYM、HGB、FIB、白蛋白、尿蛋白等指标差异有统计学意义(P<0.05),见表2。
表2 子痫前期组与正常对照组孕妇孕中期临床资料 (±s)
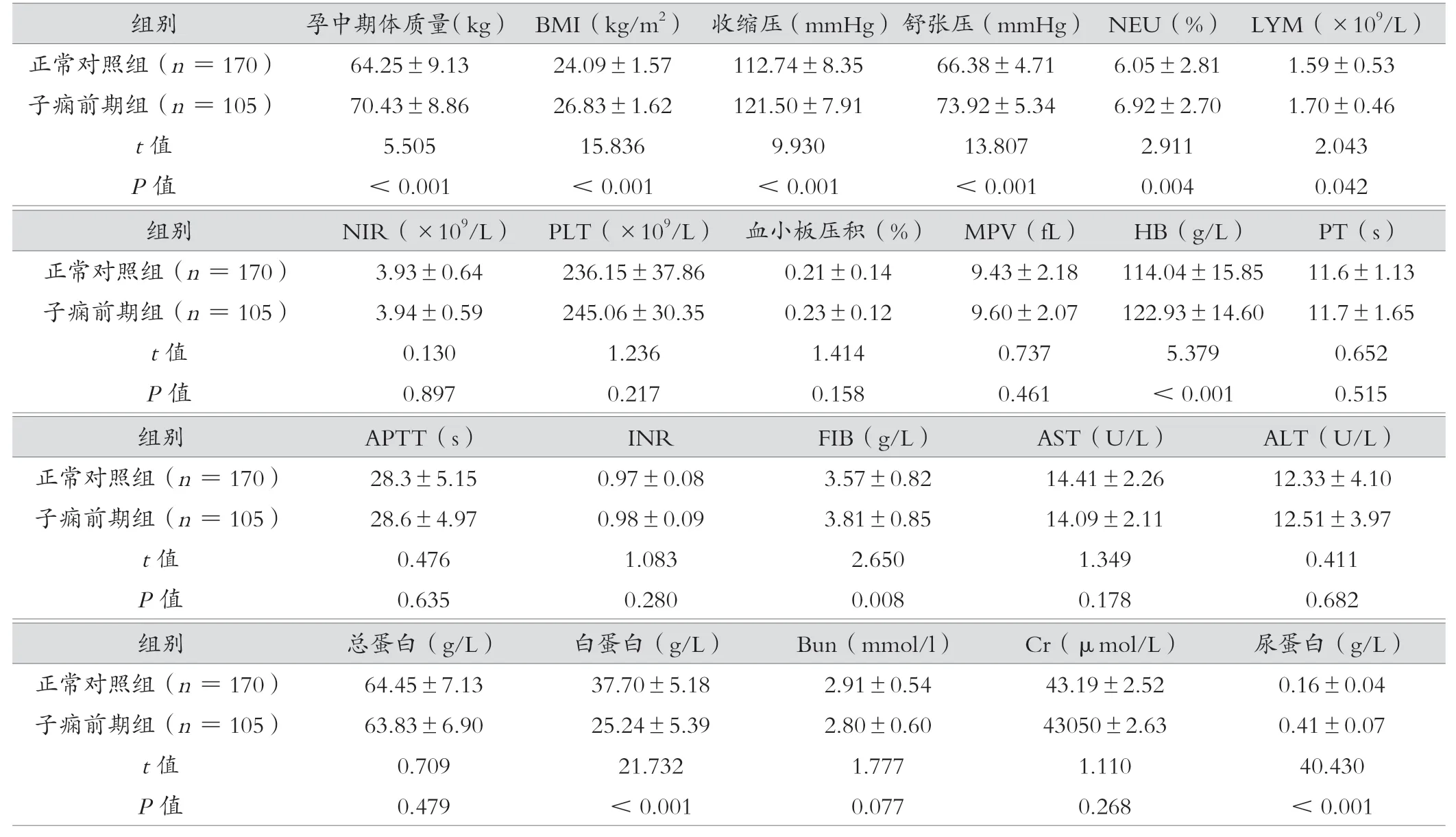
表2 子痫前期组与正常对照组孕妇孕中期临床资料 (±s)
组别总蛋白(g/L)白蛋白(g/L)Bun(mmol/l)Cr(μmol/L)尿蛋白(g/L)正常对照组(n =170)64.45±7.1337.70±5.182.91±0.5443.19±2.520.16±0.04子痫前期组(n =105)63.83±6.9025.24±5.392.80±0.6043050±2.630.41±0.07 t 值0.70921.7321.7771.11040.430 P 值0.479<0.0010.0770.268<0.001组别孕中期体质量(kg) BMI(kg/m2) 收缩压(mmHg)舒张压(mmHg) NEU(%) LYM(×109/L)正常对照组(n =170)64.25±9.1324.09±1.57112.74±8.3566.38±4.716.05±2.811.59±0.53子痫前期组(n =105)70.43±8.8626.83±1.62121.50±7.9173.92±5.346.92±2.701.70±0.46 t 值5.50515.8369.93013.8072.9112.043 P 值<0.001<0.001<0.001<0.0010.0040.042组别NIR(×109/L) PLT(×109/L) 血小板压积(%) MPV(fL)HB(g/L)PT(s)正常对照组(n =170)3.93±0.64236.15±37.860.21±0.149.43±2.18114.04±15.8511.6±1.13子痫前期组(n =105)3.94±0.59245.06±30.350.23±0.129.60±2.07122.93±14.6011.7±1.65 t 值0.1301.2361.4140.7375.3790.652 P 值0.8970.2170.1580.461<0.0010.515组别APTT(s)INRFIB(g/L)AST(U/L)ALT(U/L)正常对照组(n =170)28.3±5.150.97±0.083.57±0.8214.41±2.2612.33±4.10子痫前期组(n =105)28.6±4.970.98±0.093.81±0.8514.09±2.1112.51±3.97 t 值0.4761.0832.6501.3490.411 P 值0.6350.2800.0080.1780.682
2.3 母婴结局分析
子痫前期组在产后住院、分娩方式、ICU、宫内窘迫、NICU、新生儿体质量、Apgar 评分与正常对照组有统计学意义,且低于正常对照组(P< 0.05),见表3。
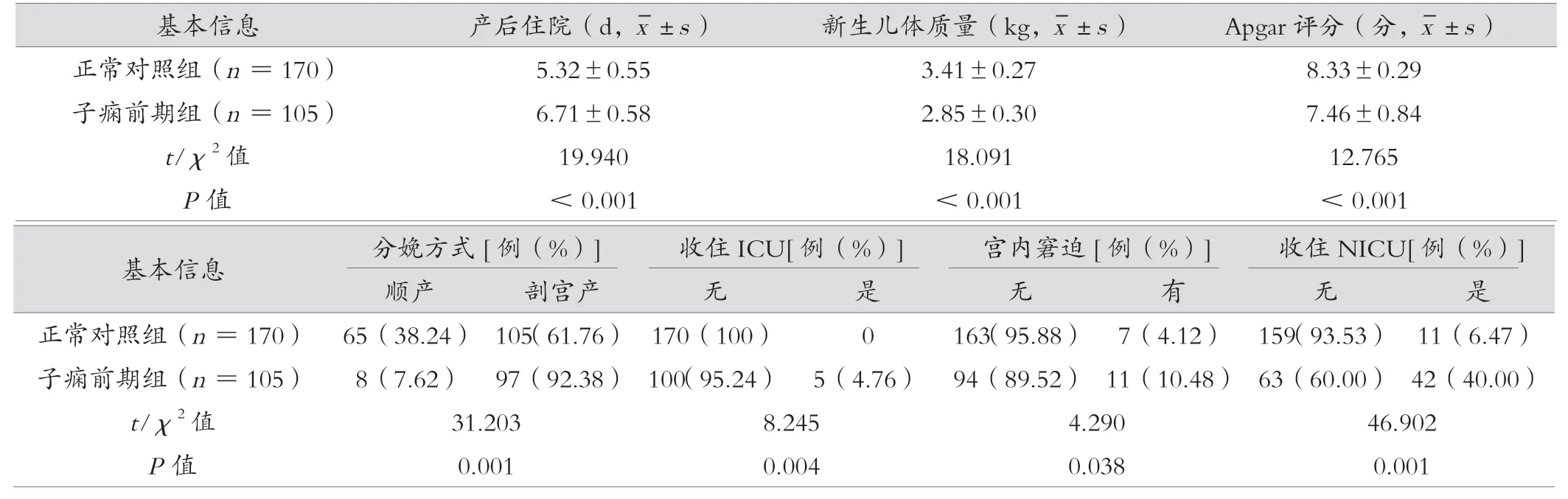
表3 子痫前期组与正常对照组母婴结局
2.4 logistic 回归分析
单因素分析显示,BMI、INR、FIB、舒张压是子痫前期高危风险因素,差异有统计学意义(P< 0.05),见表4。
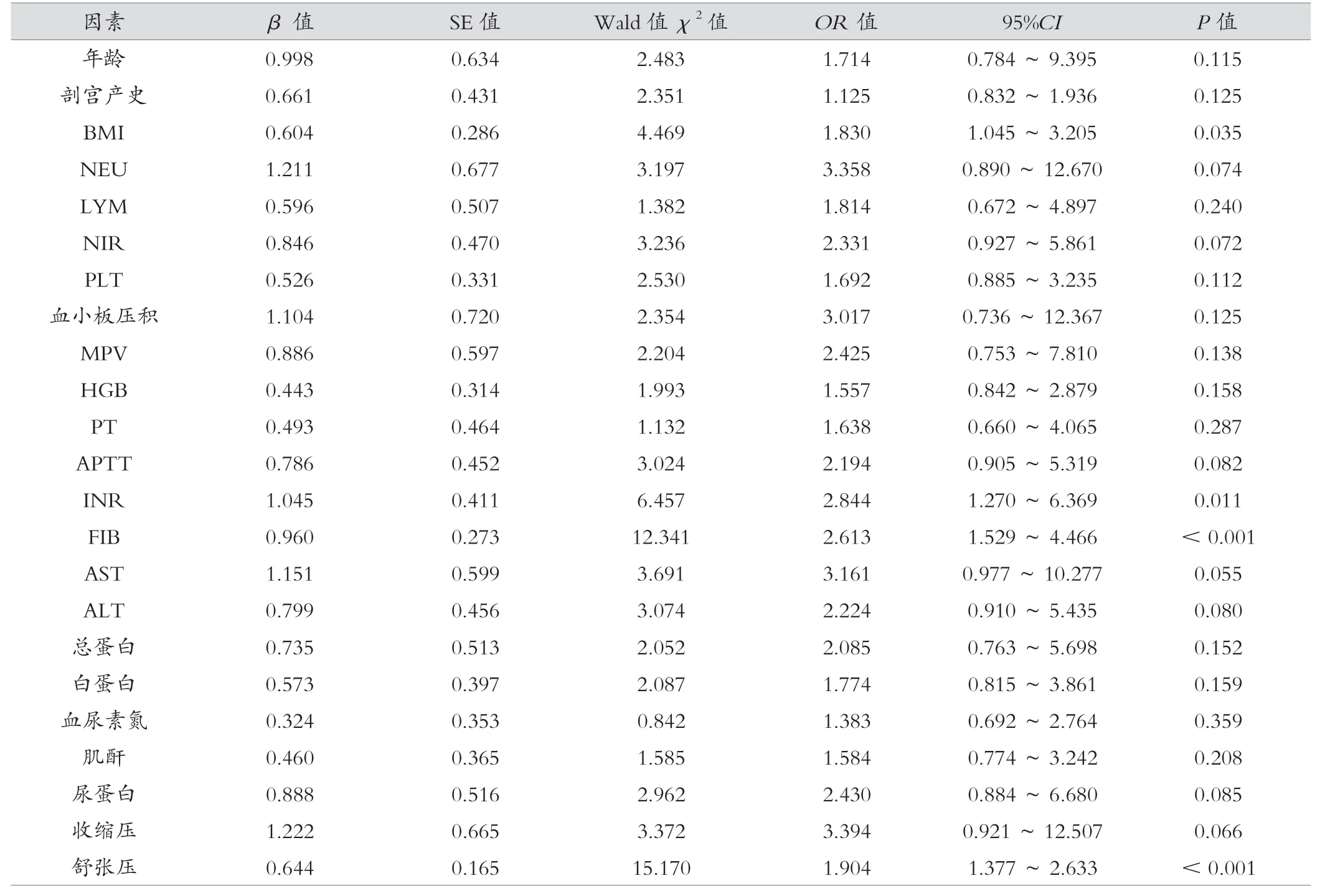
表4 子痫前期高危风险因素的单因素logistic 回归分析
2.5 ROC 曲线及Nomogram 图
在诊断模型中发现,BMI、FIB、白蛋白、舒张压能用于诊断子痫前期,差异有统计学意义(P< 0.05),见表5、图1、图2。
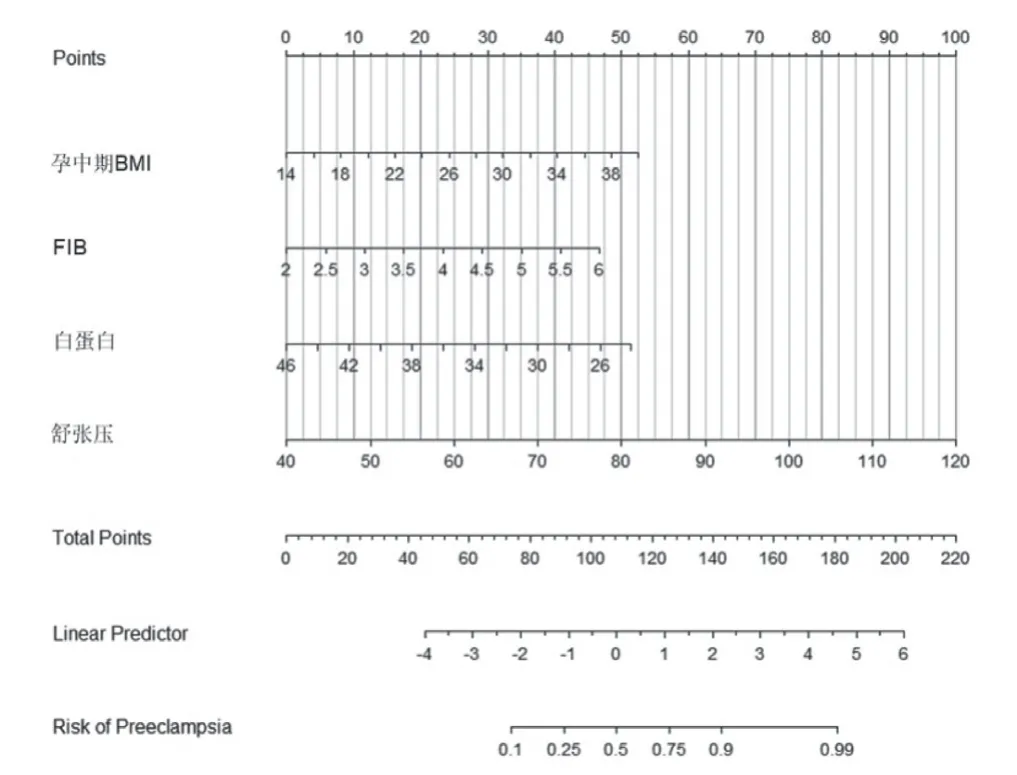
图1 孕中期子痫前期诊断预测模型(Nomogram 图)

图2 孕中期子痫前期诊断预测模型ROC 曲线
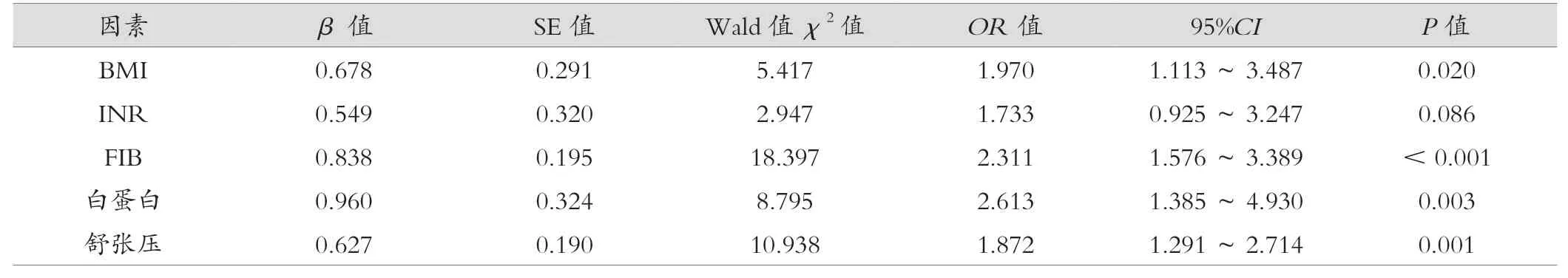
表5 子痫前期高危风险因素的多因素logistic 回归分析
3 讨论
妊娠期高血压疾病(hypertensive disorder complicating pregnancy,HDCP)是指妊娠期间发生的一类高血压病,目前对其定义没有过多的争议[8]。但关于以 HDCP 为基础的先兆子痫(pre-eclampsia,PE-E)的定义仍有争议。不论是从病名的演变,还是诊断标准的演变,都说明了人们对PE-E 的理解在不断深化[9]。随着流行病学、病理生理、分子生物学等多个方面对该病进行深入的研究。通与 PE 发病关系密切的多种检测方法层出不穷,但能有效预测 PE发病的却很少。主要方法有孕早期和中期的各种血清学指标的测定,以及子宫动脉的多普勒检查,本研究采用孕中期相关资料将其应用于 PE 的预测[10]。然而,目前预测PE 发生的研究相对较少。因此,建立一种基于孕中期临床资料的PE 预测模型具有重要的临床意义。该模型可以为医生提供一个预测工具,帮助医生及时发现PE 的风险并采取必要的医疗措施,从而降低孕妇和胎儿的风险[11]。医生可以根据孕妇的相关资料,使用该模型来预测是否有PE 的风险。如果模型预测结果表明孕妇有PE 的风险,医生可以采取必要的医疗措施,包括定期检查、药物治疗、严密监测等,这些措施可以有效地降低PE 的发生率,保障孕妇和胎儿的健康。
早在19 世纪,人们就已经认识到,孕妇BMI 偏高与妊娠期间的高血压有关。本研究中,BMI 是PE 发病的一个独立风险因素,而且在 PE 发病中具有一定的预测作用[12]。但由于没有对研究对象和种族、社会环境和生活方式的不同进行标准化,使得这些研究的结果产生了一定的偏差,使得其预测效果不够理想。而BMI 作为一种身体健康的指标,也被证明是PE 发病的一个独立危险因素。BMI 与PE 的发病率之间存在一定的相关性。一些大型的流行病学调查显示,BMI增加,PE 的风险也随之增加。此外,BMI 还与孕期高血压、胎盘早剥等并发症的发生有关,这些并发症与PE 的关系密切。除了BMI 之外,还有一些其他的因素也与PE 的发生有一定的关联。其中最主要的风险因素是孕妇本身的年龄和孕次。研究发现,年龄≥35岁的孕妇患PE 的风险要比年轻孕妇高出许多。而孕次方面,初孕妇比经产妇更容易患PE。但本次研究中孕次等指标并未对疾病预测有影响,可能与其研究例数少有关。对于已经患有PE 的孕妇,及时治疗和管理是非常重要的。一旦出现了相应的症状,比如高血压、蛋白尿等,就需要及时到医院接受治疗。同时,孕妇也需要在医生的指导下进行适当的饮食调节和生活方式的改善,以减轻病情的发展。
纤维蛋白原是一种凝血因子,当身体内的凝血机制被激活后,就会生成纤维蛋白单体,并能凝聚成纤维蛋白的多聚体,有助于血液凝结,是血液凝固的关键。FIB 中的纤维蛋白原浓度,在2 ~4 g/L 范围内是正常的。纤维蛋白原含量在怀孕晚期或长期服用避孕药时会增加。FIB 在胚胎植入过程中呈上升趋势,在妊娠8 周出现高峰,并维持10 d,随后又快速降低到高峰的10%,18 ~20 周又回落到正常值。有研究表明, PE 孕妇的血清 FIB 水平比正常妊娠的孕妇要高。PE 孕妇在早孕期间,由于子宫螺旋小动脉重构不足,导致胎盘血管受到损伤,胎盘缺氧,子宫与胎盘供血不足,代偿性地导致胎滋养层细胞增殖和过度分泌,导致血清 FIB 水平增高。因此胎盘滋养细胞所产生的 FIB 能够直接反映胎盘功能,而胎盘功能状况与PE、小于胎龄儿及胎盘早剥等产科并发症的形成有很大的关联。ROC 曲线分析显示FIB 是预测PE 的关键因素,提示妊娠中期母体血 FIB 水平对PE 具有一定的预测意义。
白蛋白是普遍存在于胎儿血液中的一种蛋白,能维持血浆胶体渗透压的恒定,其水平自妊娠早期便开始降低,至妊娠中期降至约35 g/L,后持续此水平直至分娩结束。从理论上讲,PE 是由于胎盘局部血管收缩而引起的,因此,PE 是由于胎盘局部血管收缩引起的。在妊娠中期,PE,胎盘功能发生了变化,但是胎盘的结构没有发生变化,胎盘的血运也无明显的减少,这是一种代偿状态。在孕妇代谢水平高的情况下,随着胎盘血流量的减少,孕妇血清白蛋白水平也会随之下降。但研究发现,妊娠11 ~13 周、19 ~24 周,发生严重PE 的孕妇,其白蛋白水平明显低于正常人群,这可能是因为妊娠11 ~13 周,19 ~24 周发生了螺旋动脉栓塞,蜕膜出血,坏死,造成胎- 母屏障的破坏,从而使孕妇的血清白蛋白水平降低[13]。
目前,妊娠期高血压疾病的发生发展已引起国内外学者的广泛关注,其中舒张压是一种重要预测因素之一。在孕中期,舒张压作为一种重要的血清学预测指标,可以帮助医生预测孕妇是否存在高血压症状。高血压在孕期中极易发生,特别是在孕中期,很多孕妇都会出现较大的血压波动。而舒张压的变化情况则可以很好地反映这种血压波动的情况,因此舒张压成为孕妇血压检查中不可或缺的一项指标。在医学领域,舒张压的正常范围一般为60 ~90 mmhg。如果孕妇的舒张压超出了正常范围,则说明她可能已经出现了高血压的症状。对于孕妇来说,高血压的风险是非常大的,会对孕妇和胎儿的健康造成很大影响,甚至会导致妊娠并发症的发生。孕妇需要注意保持舒张压的正常范围,及时发现和治疗高血压症状,保障胎儿的健康。本文采用了对PE 高危因素、孕中期母血清学预测指标,将BMI、FIB、白蛋白、舒张压作为预测因素发现差异有统计意义,这表明以上几个指标都可以预测到PE,具有一定的诊断价值。基于这个预测模型,还可以进一步探究PE 疾病的发病机制,为临床治疗提供更加精准和个性化的指导。
综上所述,孕中期临床资料包括BMI、FIB、白蛋白、舒张压等可对子痫前期疾病进行预测,但仍需要加大样本量,采用更多的前瞻性研究验证预测的合理性。

