金花茶花对2型糖尿病小鼠的降糖及抗氧化作用
刘芬芬,蒲首丞,赵雯靓,王怡婷,薛 琛,徐丽珊,2,*
(1.浙江师范大学生命科学学院,浙江 金华 321004;2.浙江省特色经济植物生物技术研究重点实验室,浙江 金华 321004)
近年来,随着人们生活方式、饮食习惯的变化,糖尿病的患病率迅速上升,已成为世界上最常见的疾病之一[1]。糖尿病患者表现出“三多一少”的典型症状,且常存在肝病、肾病等并发症,生活质量受到严重影响[2]。目前,我国糖尿病面临高患病率、低知晓率、低控制率、高花费的严峻现状[3],对糖尿病防治十分紧迫。流行病学研究结果表明,长期摄入富含植物活性成分的食物,如咖啡、茶和浆果等,有利于维持血糖平衡。我国天然产物资源丰富,许多植物因其安全无毒、来源广、生物活性高而成为研究热点。因此,评价药食两用植物的降血糖功效对糖尿病的预防和治疗具有重要意义。
金花茶(Camellia nitidiss ima)属于山茶科(Theaceae)山茶属(Camellia),是国家一级保护植物,于2010年被国家卫健委列为新资源食品,现已在多地引种成功。研究表明金花茶含有丰富的活性成分,以多酚、多糖、皂苷和黄酮类为主[4],且相较于叶,花中含有更多的黄酮、多酚、皂苷[5],这些植物活性成分具有显著的抗氧化[6]、降血脂[7]、降血糖[8]、抗肿瘤[9]、增强免疫力[10]、抗衰老[11]等药理功效。目前研究多集中于金花茶的叶,而对金花茶花的降血糖及抗氧化功效鲜有研究。
本研究以防城普通金花茶的花为研究对象,分析其各成分含量与生物活性,并利用高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用法进行组分鉴定;同时,建立2型糖尿病小鼠模型,考察金花茶花对2型糖尿病小鼠血糖、血脂、氧化应激等水平的影响。本研究旨为金花茶花的开发利用提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性ICR小鼠,体质量(20±2)g,购自浙江省医学科学院,使用许可证号:SYXK(浙)2019-0002。
防城普通金花茶花由浙江仁德堂金花茶有限公司金华金花茶基地提供。
链脲佐菌素(streptozotocin,STZ)美国Sigma公司;阿卡波糖 德国Bayer公司;胰岛素、血脂、糖代谢、氧化应激、原位末端标记染色(TdT-mediated dUTP nick-end labeling,TUNEL)细胞凋亡原位检测试剂盒南京建成生物工程研究所;其他化学试剂均购自于国药集团。
1.2 仪器与设备
Rotavapor R-300旋转蒸发仪 瑞士Buchi公司;组织匀浆机 美国Pro Scientific公司;Go全波长酶标仪美国Thermo Multiskan公司;NE910科研级正置生物显微镜 美国Nexcope公司;5427R高速冷冻离心机德国Eppendorf公司。
1.3 方法
1.3.1 金花茶花水提物(aqueous extract ofCamellia nitidissimaflower,CFA)的制备
将新鲜金花茶花于100 ℃杀青5 min后60 ℃干燥至恒质量,粉碎备用。金花茶花粉末以1∶20(g/mL)料液比加入去离子水,于70 ℃水浴加热浸提1.5 h,抽滤,滤液浓缩、60 ℃真空干燥至恒质量,得到CFA。
1.3.2 CFA中各成分含量及自由基清除活性的测定
多酚、多糖、氨基酸、蛋白质含量测定参照文献[12]。采用Xu Ping等[13]方法测定样品对α-葡萄糖苷酶的抑制活性和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除活性。
1.3.3 HPLC-MS分析
CFA溶于甲醇溶液中,配制成1 mg/mL的溶液,经微孔滤膜过滤于色谱瓶中,参考莫润宏等[14]的方法,稍作修改进行测定。色谱条件:色谱柱:Ultimate®XB-C18(4.6 mm×250 mm,5 μm);流动相A:纯乙腈;流动相B:体积分数为2%的甲酸溶液;流速:1.0 mL/min,柱温:35 ℃;紫外检测器检测波长为320 nm。梯度洗脱程序:0~10 min,0%~13% A、100%~87% B;13~25 min,13%~20% A、87%~80% B;25~30 min,20%~23% A、80%~77% B;30~40 min,23%~40% A、77%~60% B。正离子模式下运行电喷雾电离子源,质谱条件:离子源温度:150 ℃,脱溶剂气体:氮气,流速:8.00 mL/min,毛细管电压:2.5 kV,扫描范围m/z:100~3000。
1.3.4 动物造模与分组干预
动物实验符合浙江师范大学实验动物福利伦理审查要求,受理编号:ZSDW2022011。小鼠适应性饲养1 周后,根据体质量随机分为空白组(N组)(n=10)和造模组(n=100),N组以基础饲料饲养。造模组小鼠以高糖高脂饲料连续诱导21 d,禁食不禁水12 h,腹腔注射125 mg/kgmbSTZ的柠檬酸缓冲溶液诱导糖尿病。注射后第3天、第7天尾静脉取血,血糖仪测定空腹血糖值(fasting blood glucose,FBG),若两次FBG均≥11.1 mmol/L,则视为造模成功[15]。造模成功的小鼠根据FBG随机分为5 组:模型组(M组),阳性组(P组),CFA低、中、高剂量组(LCFA组、MCFA组、HCFA组),每组10 只,分别按25 mL/kgmb去离子水、20 mg/kgmb阿卡波糖、200 mg/kgmbCFA、400 mg/kgmbCFA和800 mg/kgmbCFA灌胃干预5 周;N组以25 mL/kgmb去离子水灌胃干预5 周。
1.3.5 一般指标观察
灌胃干预期间,每周称量并记录各组小鼠进食情况、饮水情况、排尿情况及空腹体质量。
1.3.6 血糖指标测定
灌胃期间第7、14、21、28、35天禁食12 h后剪尾静脉取血测量FBG,并于次日进食2 h后测量餐后血糖(postprandial blood glucose,PBG)。
1.3.7 血清胰岛素及血脂指标的测定
末次灌胃后对各实验组小鼠眼眶取血,制备血清,根据试剂盒操作流程测定血清空腹胰岛素(fasting insulin,FINS)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)含量。根据FINS和FBG计算稳态型胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)(HOMA-IR=FBG×FINS/22.5)。
1.3.8 胰脏、肝脏氧化应激途径相关指标的测定
取血后小鼠立即脊椎脱臼处死,置于冰袋上迅速取出胰脏、肝脏,低温磨碎后加入质量分数0.9%生理盐水制得匀浆,根据试剂盒操作流程,完成总超氧化物歧化酶(total superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)测定,结果以蛋白质量计。
1.3.9 胰脏、肝脏病理切片制作及观察
取部分胰脏、肝脏于体积分数4%的多聚甲醛中固定,制作石蜡切片,常规苏木精-伊红(hematoxylin-eosin staining,HE)染色观察组织结构,根据试剂盒操作流程完成TUNEL细胞凋亡原位检测,并计算细胞凋亡率。
1.4 数据处理
2 结果与分析
2.1 CFA主要成分含量及生物活性
与人参[16]、青钱柳[17]、金花茶叶[12]相比,金花茶花具有较高的多酚、多糖含量和清除DPPH自由基、抑制α-葡萄糖苷酶能力(表1)。表明金花茶花富含活性成分,且具有很好的体外抗氧化和降血糖作用。
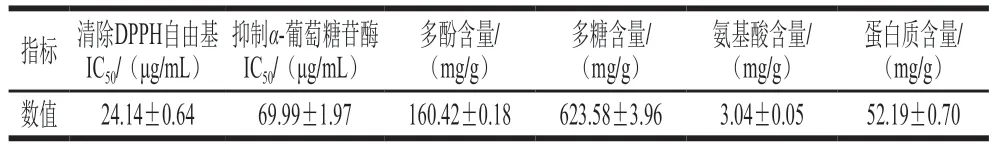
表1 CFA主要成分含量及生物活性Table 1 Major component contents and biological activity of CFA
2.2 HPLC-MS分析
利用HPLC-MS技术对CFA进行成分分析,根据HPLCMS和MS图谱,参考相关文献,对其主要成分进行结构鉴定,其HPLC图谱见图1,质谱数据见表2。共检测到7 种主要成分,成分1质谱数据为分子离子峰m/z值595.1659,与张维冰等[18]鉴定木犀草素-7-O-芸香糖苷HPLC-MS结果相同,推定为木犀草素-7-O-芸香糖苷;成分2分子离子峰m/z值291.0867,结合文献[19],推断该化合物为表儿茶素;成分3质谱数据为分子离子峰m/z值565.1558,可推断其相对分子质量为564,结合文献[20],成分3为芹菜素-6-C-戊糖-8-C-己糖苷;成分4分子离子峰m/z值611.1606,成分5分子离子峰m/z值465.1031,成分6m/z为465.1031,波谱数据与文献[21]的报道基本一致,故鉴定化合物4为槲皮素3-O-芸香糖苷;化合物5为槲皮素-3-O-葡萄糖苷;化合物6为槲皮素-7-O-葡萄糖苷;成分7分子离子峰m/z值435.1285,推断其相对分子质量为434,推断该化合物为柚皮素-7-O-葡萄糖苷[22]。
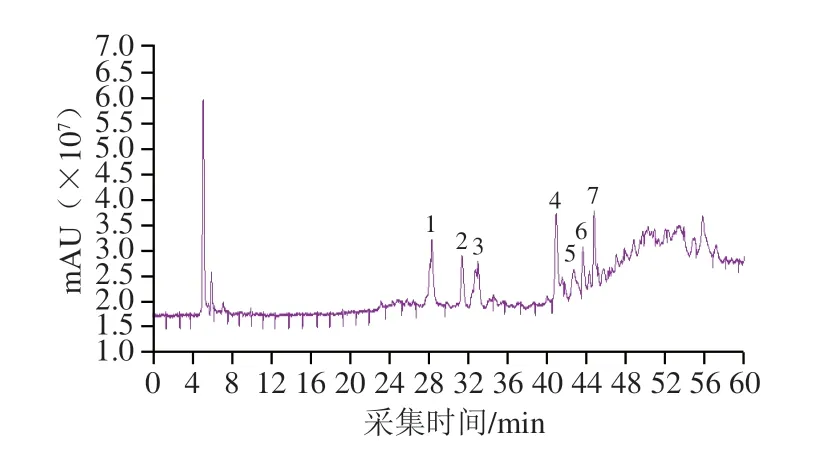
图1 金花茶花的HPLC图谱Fig.1 HPLC chromatogram of C.nitidissima flower
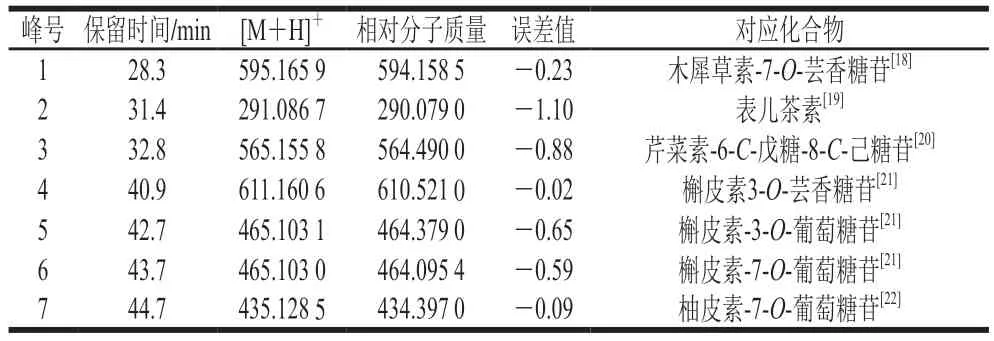
表2 金花茶花的质谱数据Table 2 Mass spectral data of C.nitidissima flower
2.3 CFA对糖尿病小鼠一般体征的影响
灌胃期间,各组小鼠进食量、饮水量、体质量变化情况见图2。M组小鼠进食量和饮水量均呈现上升的趋势,体质量逐周下降,说明M组小鼠出现“多食”“多饮”和“消瘦”的病症,符合2型糖尿病小鼠的特征。CFA干预组小鼠体质量先降后升,整体呈上升趋势;进食量和饮水量均呈现先上升后下降的趋势,各体征变化均呈剂量依赖性。灌胃5 周后,P组、MCFA组和HCFA组小鼠体质量均显著高于M组(P<0.05),其中HCFA组与P组小鼠消瘦症状的改善效果基本一致;MCFA组和HCFA组小鼠进食量与N组无显著性差异;LCFA组、MCFA组和HCFA组小鼠饮水量与P组无显著性差异。表明CFA可有效缓解小鼠糖尿病症状。
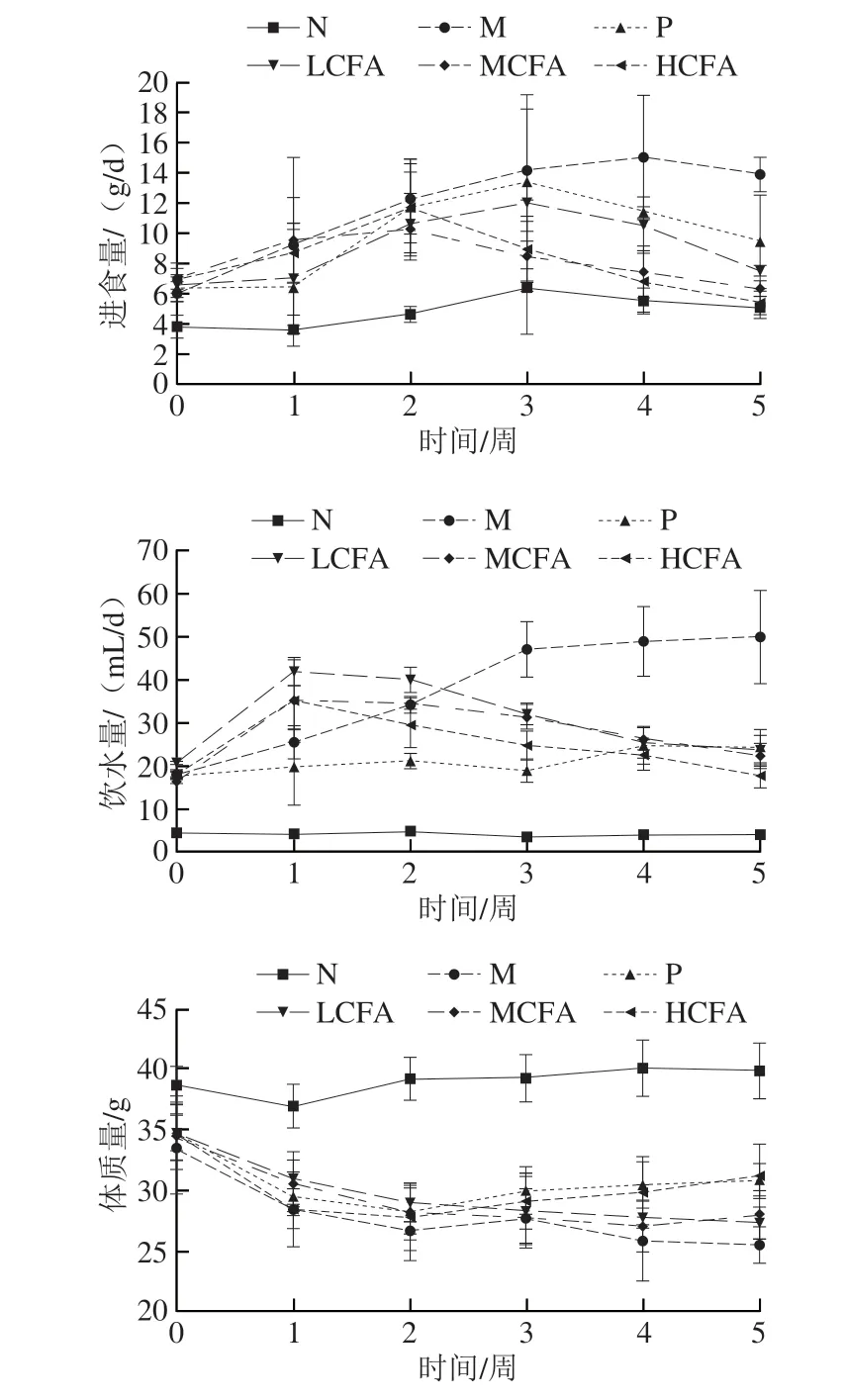
图2 小鼠进食量、饮水量及体质量的变化Fig.2 Changes in food intake,water intake and body mass of mice
2.4 CFA对糖尿病小鼠FBG和PBG的影响
CFA灌胃期间小鼠FBG变化如图3A所示。灌胃干预前,M组小鼠血糖值分布集中,均显著高于N组(P<0.05),说明2型糖尿病小鼠模型建立成功。干预5 周后,与M组相比,CFA干预组小鼠FBG均显著下降(P<0.05),且一定程度上呈剂量依赖性。表明CFA可有效降低糖尿病小鼠FBG。各组小鼠PBG的结果如图3B所示,灌胃干预前,与N组相比,M小鼠的PBG均显著升高(P<0.05),说明糖尿病小鼠PBG调节功能出现异常。干预5 周后,LCFA组、MCFA组和HCFA组小鼠的PBG均显著低于M组(P<0.05),可见CFA有效下调了糖尿病小鼠的PBG水平。综上,CFA对糖尿病小鼠血糖水平具有一定的调节作用。
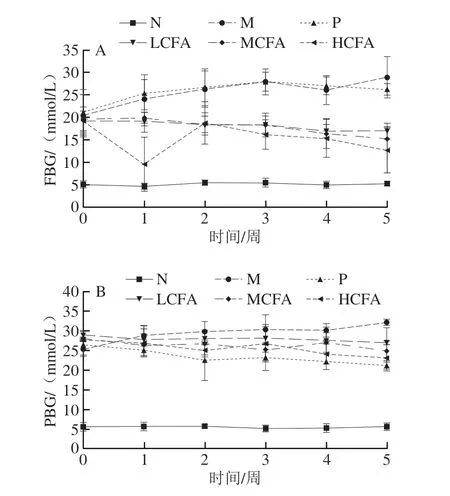
图3 糖尿病小鼠FBG(A)和PBG(B)的变化Fig.3 Changes in FBG (A) and PBG (B) of diabetic mice
2.5 CFA对糖尿病小鼠FINS水平与HOMA-IR的影响
胰岛素分泌不足和产生胰岛素抵抗是2型糖尿病主要病因,因此小鼠FINS含量和HOMA-IR是降血糖功效的重要评价指标。灌胃干预5 周后,各实验组小鼠FINS含量及HOMA-IR如图4所示。M组小鼠的FINS含量与N组相比显著下降(P<0.05),HOMA-IR较N组显著升高(P<0.05),说明M组小鼠的胰岛素分泌水平下降且伴随机体胰岛素抵抗现象。P组和HCFA组小鼠的FINS含量均显著高于M组(P<0.05),且HCFA组与N组无显著性差异,而LCFA组和MCFA组小鼠的胰岛素分泌改善效果不佳,提示高剂量的CFA有利于增加2型糖尿病小鼠胰岛素分泌;此外,CFA干预组小鼠的HOMA-IR均显著低于M组(P<0.05),且HOMA-IR呈CFA剂量依赖性降低,可见CFA可有效减轻糖尿病小鼠的胰岛素抵抗。

图4 糖尿病小鼠FINS和HOMA-IR的变化Fig.4 Changes in FINS and HOMA-IR of diabetic mice
2.6 CFA对糖尿病小鼠脂质代谢的影响
各组小鼠的血脂指标结果如图5所示。M组小鼠血清中TG、TC、LDL-C和HDL-C含量均较N组存在显著性差异(P<0.05),说明糖尿病小鼠脂代谢异常。MCFA、HCFA组小鼠的TG、TC和LDL-C含量均显著低于M组(P<0.05),HDL-C含量与N组无显著差异(P>0.05)。说明CFA可有效改善糖尿病小鼠脂代谢异常症状。

图5 糖尿病小鼠血脂指标的变化Fig.5 Changes in blood lipid indexes in diabetic mice
2.7 CFA对糖尿病小鼠胰脏、肝脏氧化应激状态的影响
小鼠胰脏、肝脏的氧化应激指标如图6所示。与N组相比,M组小鼠胰脏和肝脏的SOD、GSH-Px活性与N组相比显著下降(P<0.05),MDA含量显著升高(P<0.05),说明2型糖尿病小鼠抗氧化能力显著下降,脏器氧化损伤严重。与M组相比,除LCFA组小鼠肝脏MDA含量无显著性差异外,各实验组小鼠脏器的SOD、GSH-Px活性显著上升(P<0.05),MDA含量显著下降(P<0.05)。且MCFA组小鼠胰脏的GSH-Px活性及胰脏和肝脏的MDA含量均与P组无明显差异,HCFA组小鼠胰脏和肝脏的MDA含量显著低于P组,且接近N组。可见CFA可有效改善糖尿病小鼠脏器氧化应激水平。
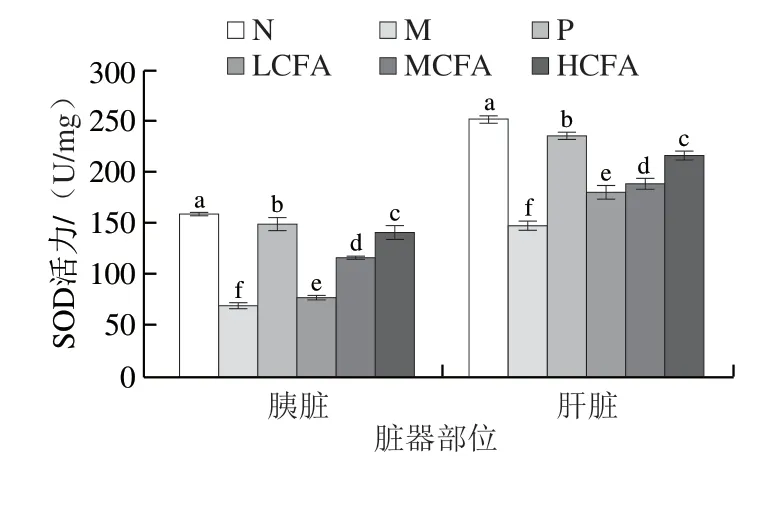
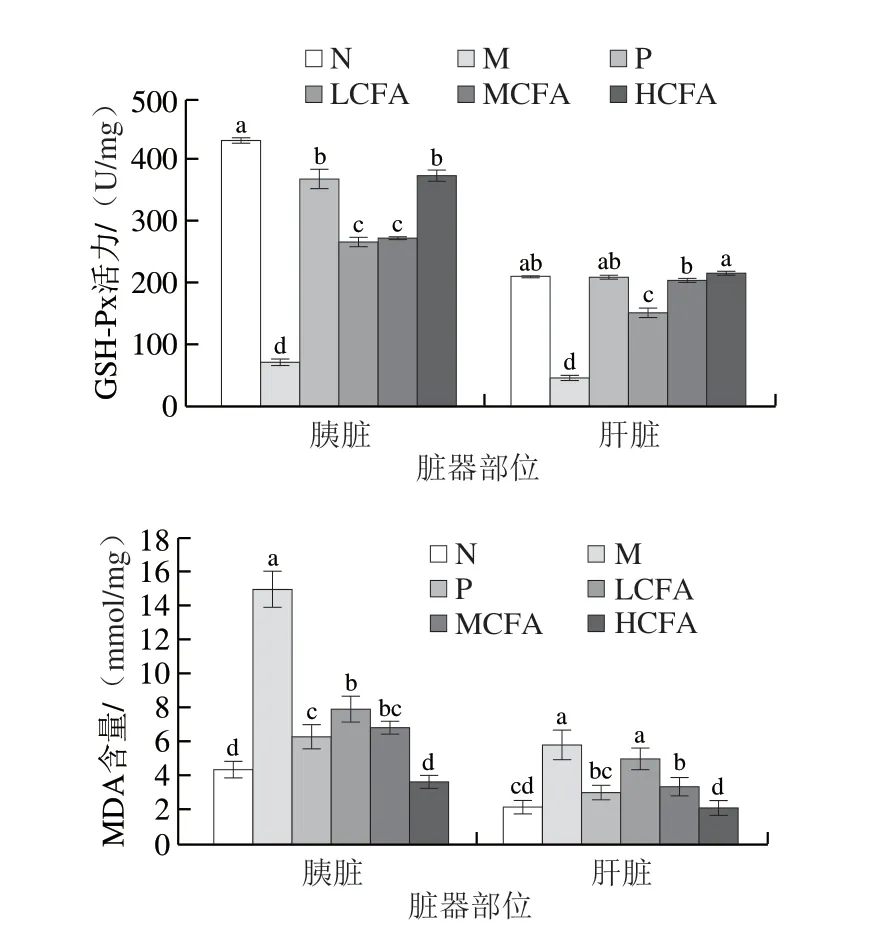
图6 糖尿病小鼠胰脏和肝脏SOD活力、GSH-Px活力和MDA含量的变化Fig.6 Changes in SOD activity,GSH-Px activity and MDA content in pancreas and liver tissues of diabetic mice
2.8 CFA对糖尿病小鼠胰脏、肝脏病理学的影响
小鼠胰脏组织形态如图7所示。与N组相比,M组小鼠胰岛数目降低,细胞排列松散,结构破坏明显,部分胞质中可见空泡。CFA干预组小鼠胰岛大小、细胞紧密程度均高于M组,呈剂量依赖性,其中MCFA组的胰岛形态与P组相当。表明CFA对糖尿病小鼠胰岛有很好的保护作用。
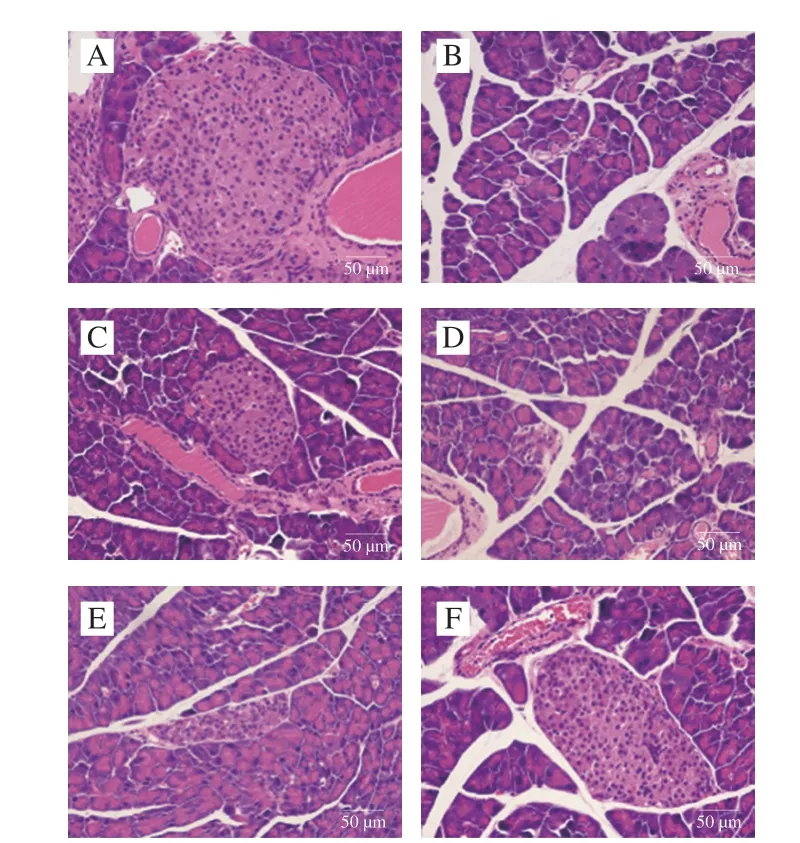
图7 CFA对小鼠胰脏病理形态的影响(×400)Fig.7 Effect of CFA on histopathological status of pancreas in mice (× 400)
采用TUNEL法检测胰腺β细胞凋亡情况见图8。N组小鼠胰腺β细胞凋亡率仅1.08%。M组小鼠胰岛萎缩严重,凋亡细胞主要聚集在胰岛中及胰脏边缘部分,凋亡率高达75.88%。与M组相比,CFA干预组小鼠胰岛中棕黄色颗粒显著减少,凋亡率显著下降,CFA低、中、高剂量组小鼠胰腺β细胞凋亡率分别为65.03%、31.80%和1.61%。说明CFA对糖尿病小鼠胰腺细胞凋亡的抑制效果具有明显的剂量依赖性,这与小鼠胰腺组织病理形态观察结果相符。

图8 CFA对小鼠胰脏细胞凋亡的影响(×400)Fig.8 Effect of CFA on pancreatic apoptosis in mice (× 400)
N组小鼠肝脏的细胞形态饱满、健康,肝小叶排列整齐且边界明显,中央静脉无扩张。M组小鼠肝脏有明显的病变现象,表现为严重中央静脉扩张,肝细胞排列松散,部分细胞出现包浆化或坏死,细胞间隙、纤维化明显。各CFA干预组小鼠的肝脏病变情况较M组均有不同程度的改善,且有剂量依赖性;其中LCFA组小鼠肝细胞排列松散,细胞间隙、纤维化明显;MCFA组和HCFA组相较于LCFA组,小鼠的肝脏纤维化得到较大程度改善,肝小叶排列紧密有序,呈明显放射状。结果见图9。
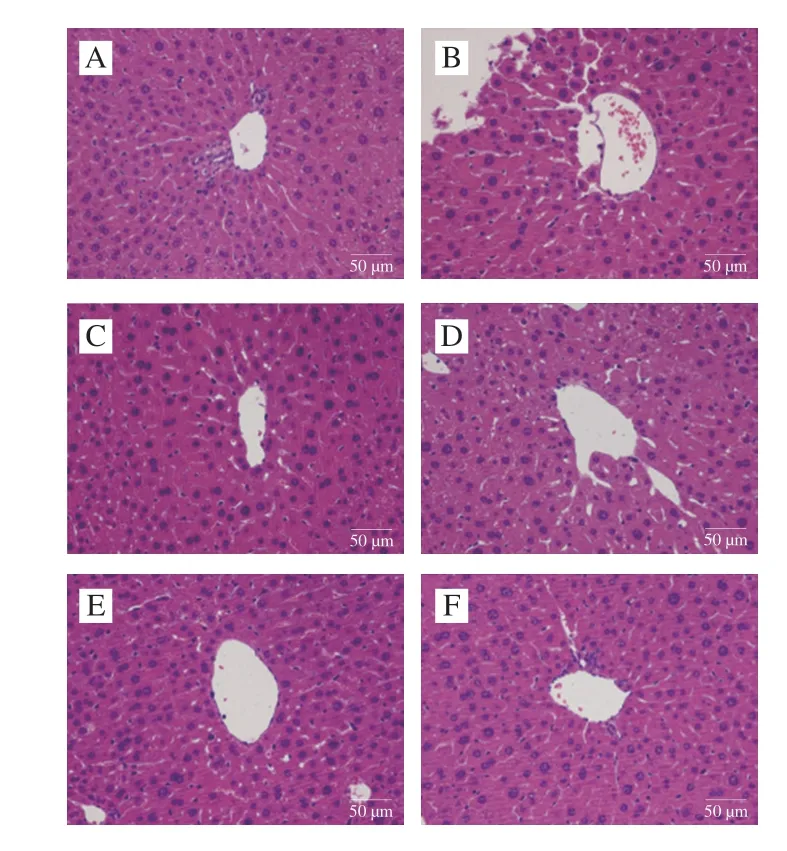
图9 CFA对小鼠肝脏病理形态的影响(×400)Fig.9 Effect of CFA on histopathological status of liver tissues in mice (× 400)
TUNEL 法检测各组小鼠肝脏细胞凋亡情况(图10)。M组小鼠肝脏细胞凋亡严重,细胞分布杂乱无序,核仁着色,棕黄色颗粒占比大,凋亡率为36.57%。CFA干预组小鼠肝脏损伤有显著的改善情况,细胞排列规则,核仁大而清晰,棕黄色颗粒大大减少,低、中、高剂量组的细胞凋亡率分别为32.81%、18.65%和0.8%,均显著低于M组(P<0.05)。表明CFA能有效改善糖尿病引起的小鼠肝脏细胞凋亡现象,减轻肝脏器官损伤。
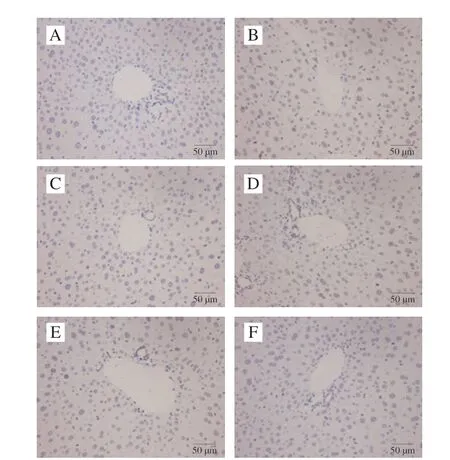
图10 CFA对小鼠肝脏细胞凋亡的影响(×400)Fig.10 Effect of CFA on hepatic apoptosis in mice (× 400)
3 结论
金花茶是国家一级保护植物,可药食两用。本实验利用HPLC-MS对CFA进行鉴定,得到7 种主要化合物,分别为木犀草素-7-O-芸香糖苷、表儿茶素、芹菜素-6-C-戊糖-8-C-己糖苷、槲皮素-3-O-芸香糖苷、槲皮素-3-O-葡萄糖苷、槲皮素-7-O-葡萄糖苷和柚皮素-7-O-葡萄糖苷,其中,化合物2~6与Zhang Hailong[20]鉴定的金花茶花成分一致。本实验结果显示CFA具有较高的多酚、多糖含量和清除DPPH自由基、抑制α-葡萄糖苷酶能力,推测CFA可作为抗氧化剂及α-葡萄糖苷酶抑制剂在体内发挥改善糖尿病的功效。
糖尿病最典型的临床症状是“三多一少”(“多饮”“多食”“多尿”和“消瘦”)与持续性的高血糖症。血糖水平持高不下可使FINS水平代偿性升高,机体对胰岛素的敏感性降低;随病情发展,胰岛β细胞进入超负荷耗竭状态使FINS分泌水平下降,最终产生胰岛素抵抗。机体因胰岛功能不足,引起脂质代谢酶活性降低,造成脂代谢紊乱形成高血脂症。同时,机体内血脂含量异常,产生脂毒性,进而加剧胰岛素抵抗,形成糖尿病恶性循环。本实验结果提示CFA可明显缓解糖尿病小鼠的“多饮、多食、体质量减轻”等症状,且能剂量依赖性地降低糖尿病小鼠FBG、PBG、TG、TC及LDL-C浓度,升高FINS和HDL-C,降低机体的HOMA-IR,其中高剂量CFA对糖尿病小鼠血糖、血脂水平的调节接近阳性对照。尤丽等[23]关于蓝莓花青素调节糖尿病小鼠糖脂代谢水平的研究也显示出类似的结果。综上可以得出,CFA能有效增加糖尿病小鼠胰岛素的分泌、缓解机体的胰岛素抵抗,进而降低血糖、血脂浓度,改善糖尿病的典型病症。
氧化应激已成为糖尿病发病的重要因素之一,它在糖尿病及其并发症的发生发展中起重要作用[24]。氧化应激是由自由基生成和清除系统之间的不平衡引起的,在糖尿病发生过程中常出现抗氧化酶类(SOD、GSH-Px)活性降低、自由基反应增强以及脂质过氧化产物MDA含量增多,这些改变会使机体组织受到氧化损伤,从而导致糖尿病并发症的产生[25]。本实验证明,CFA能显著提高糖尿病小鼠胰脏、肝脏的SOD、GSH-Px活性,从而增强机体的抗氧化能力,同时显著降低胰脏和肝脏的MDA含量,减弱组织的氧化应激损伤,起到较好的保护作用。HE染色切片和TUNEL染色切片的观察进一步证实了上述结果。结合CFA优良的体外清除DPPH自由基能力,可见CFA可作为抗氧化剂,在减弱所摄入的食物氧化作用的同时,通过提升糖尿病小鼠胰脏和肝脏的抗氧化水平,减少脂质过氧化带来的氧化应激损伤,保护脏器正常生理形态结构,使其正常行使生化功能,以此发挥改善糖尿病症状的功效。Iftikhar等[26]对刺果苏木多酚改善糖尿病的研究中也得出了相似的降糖作用机制。
综上,金花茶花对糖尿病小鼠具有很好的降血糖及抗氧化功效,可通过体外抑制α-葡萄糖苷酶活性、改善体内糖脂代谢紊乱达到调节机体血糖稳态的目的;以及通过优良的体外清除DPPH自由基能力、改善机体氧化应激水平发挥抗氧化作用。这为金花茶花改善糖尿病的研究及金花茶资源的进一步开发利用提供了科学依据。本实验仅对金花茶花降血糖及抗氧化作用进行探究,后续可对其具体分子机制和改善糖尿病的其他机制开展进一步深入研究。

