铜藻多酚的体外抗炎和降血糖活性
何袅袅,李孟昱,蔡树芸,施丽君,陈伟珠,陈 晖,洪 专,张 怡,张怡评,*
(1.自然资源部第三海洋研究所,海洋生物资源开发利用工程技术创新中心,福建 厦门 361005;2.福建农林大学食品科学学院,福建 福州 350001;3.福建省海岛资源生态监测与保护利用重点实验室,福建 厦门 361005)
铜藻别名柱囊马尾藻、海柳麦、玉海藻,属于暖温带性海藻,每年4—5月大量繁殖会造成金潮等环境问题[1]。研究发现,铜藻中含有褐藻多酚、褐藻胶、褐藻多糖、岩藻黄质等活性成分[2-5],具有较高的营养和药用价值,可以作为化工、食品、医药等行业的优质原料。目前关于铜藻中的褐藻多糖、褐藻胶等活性成分的研究较多,而对铜藻多酚的报道较少。褐藻多酚是铜藻中一类重要的活性成分,不仅含量高,而且具有抗氧化[6-8]、抗肿瘤[9]、降血糖[10-11]、降血脂[12]等生物活性,在食品、保健品及化妆品等领域有较高的应用前景。
根据炎症发生的过程和机制,可分为急性和慢性炎症[13],长期的炎症会对机体造成损伤,甚至会导致死亡[14],如溃疡性结肠炎、糖尿病并发症等。研究发现,植物多酚能够通过调节炎症介质和炎症因子的分泌量,减轻炎症作用[15]。本研究的主要内容是通过细胞毒性实验确定铜藻多酚的毒性,然后用铜藻多酚处理经脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞,检测炎症介质NO和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和白细胞介素1β(interleukin-1β,IL-1β)的分泌量和蛋白含量变化,从而确定铜藻多酚的抗炎活性。
糖尿病是一种常见的代谢紊乱疾病,会引发高血糖以及糖尿病相关的心脏疾病和神经病变[16]。糖尿病主要是由胰岛素分泌量减少或者胰岛素抵抗引起的[17],但是糖尿病会有多种并发症,常见的有糖尿病肾病[18]、视网膜病变[19]以及糖尿病引起的血管老化[20]。现在用于治疗糖尿病的药物主要有二甲双胍、阿卡波糖等,长期服用对身体副作用较大。研究发现植物多酚等天然产物对协助降血糖存在一定效果,并且对身体没有副作用,所以通过体外降血糖活性实验,可以确定铜藻多酚是否具有协助降血糖功效。α-葡萄糖苷酶是调节血糖的关键性酶,可以将多糖非还原端的α-葡萄糖苷键和低聚糖的α-1,4-糖苷键转化成α-D-葡萄糖和α-1,6-糖苷键,从而生成异麦芽糖等[21],所以α-葡萄糖苷酶可以有效调节餐后血糖,对预防和治疗糖尿病有重要意义。本实验以α-葡萄糖苷酶活性为指标,研究铜藻多酚对α-葡萄糖苷酶活性的抑制作用,再通过动力学分析铜藻多酚对α-葡萄糖苷酶活性的抑制类型,以期为铜藻多酚的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜铜藻采自福建泉州海域,经自然资源部第三海洋研究所王初生研究员鉴定为铜藻(依据《中华海洋本草》和《中华海洋本草图鉴》)。
95%食用酒精 安徽安特食品股份有限公司;DMEM细胞培养基、RPMI细胞培养基 美国Hyclone公司;胎牛血清(fetal bovine serum,FBS)美国Gibco公司;胰蛋白酶(trypsin/EDTA)兰杰柯科技有限公司;青霉素-链霉素溶液 兰博利德生物技术有限公司;蛋白Marker 美国Thermo公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、BCA蛋白浓度检测试剂盒 生工生物工程(上海)股份有限公司;NO(一氧化氮)检测试剂盒 碧云天生物技术有限公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、LPS、地塞米松美国Sigma公司;小鼠巨噬细胞RAW264.7 美国ATCC公司;α-葡萄糖苷酶、对硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,PNPG)上海麦克林生化科技有限公司。
1.2 仪器与设备
KQ-500E超声清洗机 昆山市超声仪器有限公司;UH5300紫外-可见分光光度计 日本岛津公司;ABI5500-Q-TRAP质谱仪 美国AB公司;Hei-VAP Value G3旋转蒸发仪 德国Heidolph公司;HH-ZK水浴锅巩义市予华仪器有限责任公司;H1650离心机 湖南湘仪试验室仪器开发有限公司;CLM-170B-8-NF细胞培养箱 新加坡Esco生物公司;SW-CJ-2FD超净工作台江苏苏净集团;M1650-W常温离心机 湘仪试验室仪器有限公司;PTY-B1200电子天平 华志科学仪器有限公司;Model 3555酶标仪 美国Thermo公司;AXIO OBSERVER A1倒置荧光显微镜 德国ZEISS公司;AriaMx实时荧光定量聚合酶链式反应仪 美国安捷伦公司;PowerPacTW Basic电泳仪 美国Bio-Rad公司;infinite F50酶标仪 瑞士TECAN公司。
1.3 方法
1.3.1 铜藻多酚粗提液制备
铜藻洗净除盐,沥干水分后切碎备用。称取适量铜藻(鲜质量),在乙醇体积分数40%、超声时间53 min、液料比60∶1的条件下制备铜藻多酚粗提液,收集粗提液浓缩冷藏备用。利用大孔吸附树脂LX-158对铜藻多酚进行纯化,条件:上样流速3 mL/min,上样体积10 mL,洗脱剂40%乙醇溶液,洗脱剂流速3 mL/min,洗脱剂体积120 mL,在此条件下纯化铜藻多酚,其纯度从7.52%提高到40.31%,最后收集洗脱剂,浓缩后冷冻干燥备用。通过液相色谱-串联质谱测定,初步推测多酚中含有Triphlorethol A(三聚体),结构如图1所示。

图1 Triphloretol A的结构式Fig.1 Structural formula of triphloretol A
1.3.2 铜藻多酚抗炎活性检测
1.3.2.1 细胞存活率(MTT检测)
将状态良好的细胞接种至96 孔板中,4000~5500 个/孔,培养箱中培养过夜。待细胞贴壁后加入铜藻多酚溶液(0(阴性对照)、1.25、2.5、5、10、25、50、75、100、150 µg/mL),每孔100 µL,作用时间为24 h,每个实验点设置3 个复孔。药物作用24 h后,加入母液(质量浓度为5 mg/mL MTT),每孔10 µL MTT,作用4 h,吸出上清液,同时尽量不吸出孔板底部的甲瓒(生成物),最后每孔加入150 µL DMSO溶解甲瓒,利用酶标仪在492 nm波长处测量光密度(OD)值。利用OD值计算细胞存活率:
1.3.2.2 细胞NO分泌量
将巨噬细胞接种于24 孔板中,1.5万 个/孔,在培养箱中培养过夜。待细胞贴壁后预先加入质量浓度为20、30、40 µg/mL的铜藻多酚处理2 h,再每孔加入0.5 µL的LPS,最终LPS质量浓度为1 µg/mL,LPS诱导24 h。收集细胞上清液,将细胞上清液的培养基作为检测样本。使用NO检测试剂盒检测细胞分泌的NO含量。具体操作规范按照试剂盒使用说明书。
1.3.2.3 细胞炎症因子mRNA表达量
将状态良好的巨噬细胞接种在6 孔板中,接种密度为4.5×105个/孔,细胞培养过夜,待细胞贴壁后加入铜藻多酚(质量浓度分别为10、20、30 µg/mL)预处理1 h。之后再加入LPS使其终质量浓度为1 µg/mL,LPS诱导24 h。去除细胞培养基,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗一遍,提取RNA。
用Hieff UNICON Qpcr SYBR Green Master Mix(Low Rox)试剂盒进行实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)实验扩增。每个样品设置3 个复孔,以GAPDH管家基因作为内参,通过real-time PCR对实验结果进行定量。实验所用的引物序列如下:
TNF-α的正向引物为5’-GAACTGGCAGAAGAGGCACT-3’,反向引物为5’-AGGGTCTGGGCCATAGAACT-3’;
IL-1β的正向引物为5’-AGAGCATCCAGCTTCAAAT-3’,反向引物为5’-CATCTCGGAGCCTGTAGTG-3’;
IL-6的正向引物为5’-AGTTGCCTTCTTGGGACTGA-3’,反向引物为5’-TCCACGATTTCCCAGAGAAC-3’;
GAPDH的正向引物为5’-CCTTCCGTGTTCCTACCC-3’,反向引物为5’-CAACCTGGTCCTCAGTGTAG-3’。
1.3.2.4 炎症因子蛋白表达水平(蛋白免疫印迹实验)
蛋白样品在预先配制的丙烯酰胺凝胶上上样,电泳仪电压设置为80 V的恒压状态,当蛋白条带跑至分离胶中,加大电压至120 V,蛋白跑至分离胶底部,电泳结束。将电泳结束后的凝胶在电转液的缓冲条件下,利用“三明治”法,将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上固定,此过程的电泳仪设置为260 mA的恒流状态,电转时间为60 min。电转结束后,用5%脱脂奶粉封闭2 h,排除一些非特异性蛋白的干扰;封闭后的膜根据目的蛋白选择一抗,一抗在4 ℃摇床上孵育过夜;一抗孵育完成后,需要用1×Tris含吐温-20缓冲盐溶液(tris buffered saline with Tween-20,TBST)在室温摇床上洗膜3 次,每次10 min;洗膜之后孵育二抗,二抗根据一抗的种属选择,在室温摇床上孵育2 h即可,二抗孵育结束后洗膜3 次。再利用Biorad化学发光成像仪进行曝光检测。
1.3.3 体外降血糖活性检测
1.3.3.1 反应溶液配制
底物PNPG溶液:精密称取0.375 g PNPG,加入适量PBS(pH 6.8)溶解,容量瓶定容至50 mL,配制成25 mmol/L的母液(冷藏)。然后将母液稀释成0.5、1、2、3、4、5 mmol/L 6 个不同质量浓度梯度的标准品溶液。
α-葡萄糖苷酶溶液:精密称取冻干酶粉末,加入适量PBS(pH 6.8)溶解,配制成1 U/mL的母液(冷藏)。
1.3.3.2 最适底物浓度确定
以对硝基苯酚(p-nitrophenol,PNP)含量为指标(颜色越深,说明PNP含量越高),探究PNPG的最佳实验浓度(0.5、1、2、3、4、5 mmol/L)。实验步骤如1.3.3.5节。
1.3.3.3 最适酶浓度确定
以PNP含量为指标,探究α-葡萄糖苷酶的最佳活力(0.05、0.1、0.2、0.3、0.4、0.5 U/mL)。实验步骤如1.3.3.5节。
1.3.3.4 最适反应时间确定
以PNP含量为指标,探究实验的最佳反应时间(每隔10 min测定一次)。实验步骤如1.3.3.5节。
1.3.3.5 铜藻多酚对α-葡萄糖苷酶活性的抑制作用
PNPG在α-葡萄糖苷酶的作用下能水解产生葡萄糖和PNP,PNP在405 nm波长处有最大吸收,测定其吸光度。如表1所示,依次加入PBS、铜藻多酚溶液和PNPG底物(5 mmol/L、pH 6.8),混合均匀。将96 孔板于37 ℃反应5 min,反应结束后,加入0.1 U/mL的α-葡萄糖苷酶溶液,充分混匀,于37 ℃反应30 min,利用酶标仪测定405 nm波长处的吸光度[22],计算铜藻多酚对α-葡萄糖苷酶活性抑制率,每组平行实验3 次。计算公式如下:

表1 铜藻多酚对α-葡萄糖苷酶活性抑制实验Table 1 Experimental design for measuring the inhibitory effects of polyphenols from S.horneri on α-glucosidase activityµL
1.3.4α-葡萄糖苷酶抑制动力学研究
每个试管中加入铜藻多酚溶液(0、5、10、15 µg/mL)和α-葡萄糖苷酶溶液(0.02、0.04、0.06、0.08、0.1 U/mL),反应50 min后测定吸光度。计算酶反应速率,绘制酶反应速率(单位时间内底物的分解速率,以A0/t表示(A0为吸光度))与α-葡萄糖苷酶活力的关系图[23]。
配制PNPG溶液(1、2、3、4、4.5、5 mmol/L),计算不同底物浓度和不同铜藻多酚质量浓度下的酶促反应速率。绘制Lineweaver-Burk双倒数曲线图和Dixon图,研究铜藻多酚对α-葡萄糖苷酶的抑制类型[24]。
1.4 数据分析
2 结果与分析
2.1 铜藻多酚的体外抗炎活性
2.1.1 铜藻多酚对细胞存活率的影响(MTT实验)
通过判断铜藻多酚对RAW 264.7细胞的细胞毒性,确保后续实验在无毒条件下进行,以保证实验结果的准确性,细胞毒实验结果如图2所示,高质量浓度铜藻多酚对细胞活力影响较小,RAW 264.7细胞生长状况良好。由图2可知,与阴性对照对比,发现铜藻多酚质量浓度低于150 µg/mL对巨噬细胞的形态和活力没有明显的影响。

图2 不同质量浓度铜藻多酚对细胞存活率的影响Fig.2 Effects of different concentrations of S.horneri polyphenols on cell survival rate
2.1.2 铜藻多酚对NO分泌量的影响
采用Griess法检测培养液中NO水平。由图3可知,与空白组(Con)相比,模型组(LPS)中NO含量显著提升(P<0.0001),说明经过LPS诱导,RAW 264.7巨噬细胞产生炎症释放大量NO,炎症细胞模型建立成功。与模型组相比,地塞米松阳性对照组(Dex(5 µmol/L))和给药组中NO含量都有明显的下降,铜藻多酚质量浓度为20 µg/mL时,NO含量变化不显著,铜藻多酚质量浓度为30、40 µg/mL两组中NO含量均表现为显著下降,从100%分别下降到76.23%(P<0.05)、62.45%(P<0.01),铜藻多酚可以有效抑制NO分泌量,说明其具有很好的抗炎活性。
2.1.3 铜藻多酚对炎症因子mRNA表达水平的影响
LPS本身为细菌细胞壁的成分,作为一种炎症介质,可以使单核巨噬细胞活化,在LPS的作用下,巨噬细胞会产生炎性因子TNF-α、IL-6和IL-1β。利用real-time PCR检测铜藻多酚能否可以改变致炎因子TNF-α、IL-6和IL-1β的表达水平。由图4可知,30 µg/mL铜藻多酚溶液显著降低LPS诱导的TNF-α、IL-6和IL-1β 3 种细胞因子的mRNA下调。此外,可以发现铜藻多酚对炎性因子的抑制作用与铜藻多酚的质量浓度呈正相关。

图4 铜藻多酚对LPS诱导RAW 264.7细胞产生的IL-1β(A)、TNF-α(B)和IL-6(C)的抑制作用Fig.4 Inhibitory effect of S.horneri polyphenols on mRNA expression of IL-1β (A),TNF-α (B) and IL-6 (C) in LPS-induced RAW 264.7 cells
2.1.4 铜藻多酚对促炎细胞因子蛋白表达水平的影响
经过LPS诱导,RAW 264.7巨噬细胞产生炎症释放IL-1β、TNF-α,细胞裂解液用免疫印迹法检测TNF-α、IL-1β和α-Tubulin。通过免疫印迹实验和灰度分析,与LPS处理组相比,发现高质量浓度铜藻多酚可以显著降低促炎细胞因子TNF-α蛋白表达,但是对IL-1β蛋白表达的抑制作用不显著(P>0.05)。由图5可知,随着铜藻多酚质量浓度增大,对促炎细胞因子TNF-α和IL-1β蛋白表达的抑制作用逐渐增强。
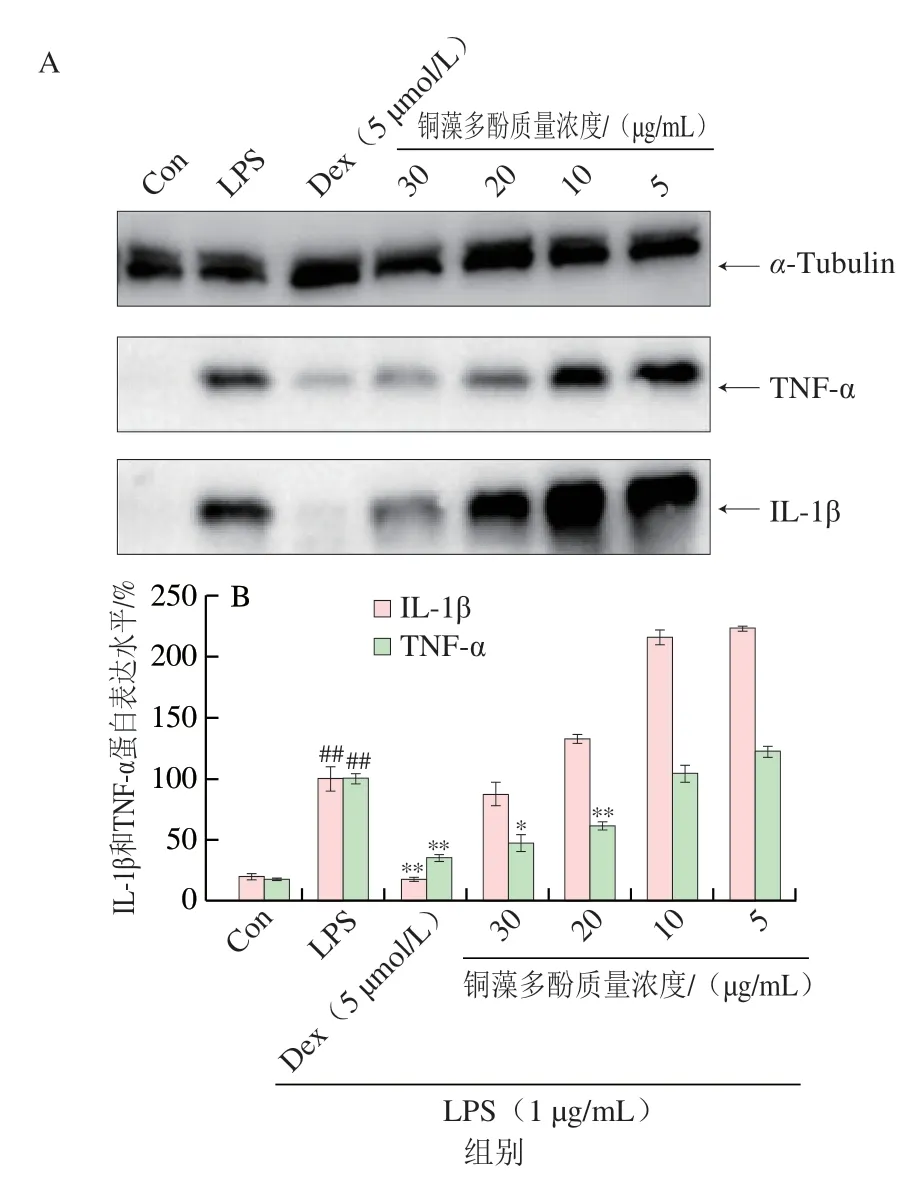
图5 铜藻多酚对促炎细胞因子TNF-α、IL-1β蛋白表达的抑制(A)及灰度分析(B)Fig.5 Western blotting patterns (A) and grayscale analysis (B) of the inhibitory effect of polyphenols from S.horneri on protein expression of pro-inflammatory cytokines TNF-α and IL-1β
2.2 铜藻多酚对α-葡萄糖苷酶活性的影响
2.2.1 底物浓度的选择
为了确定α-葡萄糖苷酶活性抑制实验中的最佳的PNPG浓度。本实验利用不同浓度的PNPG(0.5、1、2、3、4、5 mmol/L)和α-葡萄糖苷酶进行反应,由图6可知,随着PNPG浓度增大,α-葡萄糖苷酶对PNPG的反应能力逐渐增强。当PNPG浓度为5 mmol/L时,吸光度达到最大,此时底物和酶反应完全。所以PNPG的最适浓度为5 mmol/L。
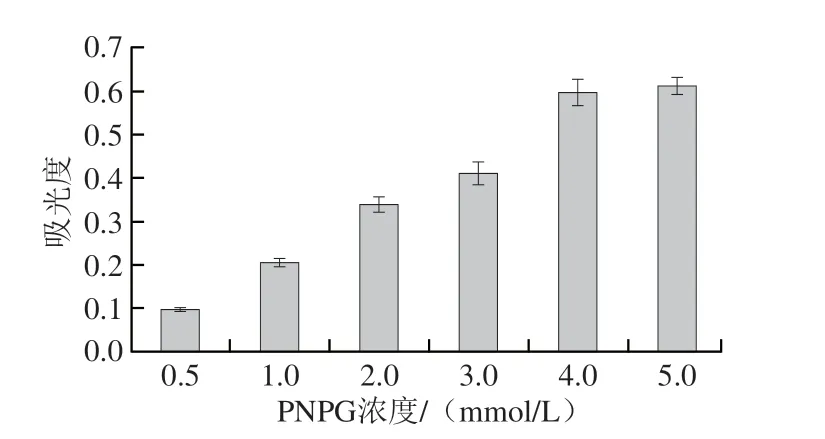
图6 不同浓度的底物(PNPG)对α-葡萄糖苷酶活性的影响Fig.6 Effects of different concentrations of substrate (PNPG) on the activity of α-glucosidase
2.2.2α-葡萄糖苷酶浓度的选择
当底物PNPG浓度和反应时间为定值时,在α-葡萄糖苷酶作用下,PNPG被分解成葡萄糖和PNP,随着α-葡萄糖苷酶浓度增大,分解速率不断变大。由图7可知,当α-葡萄糖苷酶活力为0.1 U/mL时,α-葡萄糖苷酶能够开始水解底物,并且酶的浓度越低,越容易与抑制剂发生反应。α-葡萄糖苷酶为0.1 U/mL时,已经能够判断铜藻多酚对α-葡萄糖苷酶活性的抑制能力。利用低浓度的α-葡萄糖苷酶能够减少酶的用量,节约成本。所以最终确定α-葡萄糖苷酶的最佳浓度为0.1 U/mL。

图7 不同α-葡萄糖苷酶浓度对底物分解速率的影响Fig.7 Effects of different α-glucosidase concentrations on substrate decomposition rate
2.2.3 反应时间的选择
随着反应时间延长,底物和α-葡萄糖苷酶的反应越完全。由图8可知,40 min时,底物和α-葡萄糖苷酶的反应还在进行,50 min时,底物和酶的反应几乎趋于稳定,随着时间延长并未进一步反应。所以确定最佳反应时间为50 min。

图8 反应时间对α-葡萄糖苷酶活性的影响Fig.8 Effect of reaction time on α-glucosidase activity
2.2.4 铜藻多酚对α-葡萄糖苷酶活性抑制结果
由图9可知,铜藻多酚对α-葡萄糖苷酶活性的抑制效果为:随着铜藻多酚质量浓度增大,抑制效果逐渐增强。铜藻多酚质量浓度为25 µg/mL时抑制率达到90%以上,说明铜藻多酚对α-葡萄糖苷酶活性有较强的抑制效果。铜藻多酚对α-葡萄糖苷酶的半数抑制浓度(half maximal inhibitory concentration,IC50)为5.96 µg/mL。

图9 不同质量浓度铜藻多酚对α-葡萄糖苷酶活性的抑制作用Fig.9 Inhibitory effect of S.horneri polyphenols at different concentrations on α-glucosidase activity
2.2.5α-葡萄糖苷酶抑制动力学结果
抑制剂对α-葡萄糖苷酶的抑制作用包括不可逆抑制和可逆抑制两种类型。由图10可知,随着铜藻多酚质量浓度增大,直线斜率逐渐减小,同时所有直线都基本过原点,说明铜藻多酚对α-葡萄糖苷酶的抑制作用是可逆的[25]。
为了确定铜藻多酚对α-葡萄糖苷酶的可逆抑制类型,按照Lineweaver-Burk双倒数曲线作图法,研究铜藻多酚质量浓度、底物浓度和酶解速率之间的关系,确定抑制类型和抑制常数。由Lineweaver-Burk双倒数曲线图11可知,随着铜藻多酚质量浓度降低,α-葡萄糖苷酶的酶解速率明显升高。随着底物浓度增加,酶解速率也不断增大。说明铜藻多酚优先与酶结合,从而使葡萄糖苷酶活性下降[24-25]。

图11 不同质量浓度铜藻多酚与α-葡萄糖苷酶反应的Lineweaver-Burk双倒数曲线Fig.11 Lineweaver-Burk double reciprocal curves for the reaction of S.horneri polyphenols with α-glucosidase at different concentrations
通过Lineweaver-Burk双倒数曲线可以看出米氏常数Km和最大酶解速率Vmax值的变化,Km和Vmax的比值为斜率,Y轴截距为1/Vmax,Km和Vmax的比值随着铜藻多酚质量浓度增大而增大。通过Dixon图(图12)可以看出,不同质量浓度铜藻多酚直线相交于第2象限,交点接近Y轴,说明铜藻多酚对α-葡萄糖苷酶的抑制作用是混合抑制。Lineweaver-Burk双倒数曲线中交点的横坐标的绝对值表示竞争性抑制常数Kic值,而Dixon图中交点横坐标的绝对值表示非竞争性抑制常数Kiu值。计算得到铜藻多酚对α-葡萄糖苷酶的Kic值为0.06 µg/mL,Kiu值为6.68 µg/mL。非竞争性常数大于竞争性常数,说明铜藻多酚对α-葡萄糖苷酶的抑制类型是非竞争性大于竞争性的混合可逆性抑制类型[26-29],具体数值如表2所示。

表2 不同质量浓度铜藻多酚与α-葡萄糖苷酶的抑制常数Table 2 Inhibition constants of S.horneri polyphenols at different concentrations on α-glucosidase

图12 不同质量浓度铜藻多酚与α-葡萄糖苷酶反应的Dixon曲线Fig.12 Dixon curves for the reaction of S.horneri polyphenols with α-glucosidase at different concentrations
3 讨论
糖尿病并发症发生的主要因素是炎症,研究发现植物多酚不仅对糖尿病并发症有一定的抑制作用,而且能够直接降血糖。本实验研究了铜藻多酚的体外抗炎活性,利用LPS诱导RAW 264.7巨噬细胞建立体外炎症模型。结果表明,通过细胞毒实验(MTT法)检测铜藻多酚质量浓度在1.25~150 µg/mL之间时,细胞存活率高,说明铜藻多酚没有明显的细胞毒性。40 µg/mL铜藻多酚显著降低炎症介质中NO含量,30 µg/mL的铜藻多酚可以使IL-1β、TNF-α 和IL-63 种细胞因子的mRNA水平显著下调,对炎症因子TNF-α的蛋白表达水平有显著抑制作用,但是对炎症因子IL-1β蛋白表达水平抑制作用不显著,具有较强的抗炎活性,与纯化后咖啡果壳多酚的抗炎活性[30]相比,铜藻多酚的对炎症因子的蛋白和mRNA水平的抑制作用更明显。铜藻多酚对α-葡萄糖苷酶的活性有明显抑制效果,并且随着铜藻多酚质量浓度增大抑制效果逐渐增强,铜藻多酚对α-葡萄糖苷酶的IC50为5.96 µg/mL,说明铜藻多酚对α-葡萄糖苷酶活性有较强的抑制效果,明显高于红景天多酚对α-葡萄糖苷酶的IC50(2.83 mg/mL)[31]。根据双倒数曲线可知,铜藻多酚对α-葡萄糖苷酶的Kic值为0.06 µg/mL,Kiu值为6.68 µg/mL,非竞争性常数Kiu值大于竞争性常数Kic值,说明铜藻多酚对α-葡萄糖苷酶的抑制类型是非竞争性大于竞争性的混合可逆性抑制类型。综上,铜藻多酚具有抗炎活性和降血糖活性,可以作为化工、食品、医药等行业的优质原料。

