知母治疗阿尔茨海默病网络药理学研究及实验验证
李德雨,胡颖超,刘 欣,于顾然
南京中医药大学附属医院,江苏 南京210029
AD是一种与年龄相关的神经退行性疾病,由于全球人口老龄化加剧,AD 的患病率逐年升高,已成为全球性公共卫生问题[1-2]。AD 的主要病理学特征为由Aβ组成的老年斑、过度磷酸化τ蛋白形成的神经原纤维缠结以及突触功能障碍[1]。
淀粉样蛋白级联假说一直被认为是AD 的主要发病机制之一,即AD 是由分泌酶对APP 切割导致Aβ 产生和清除之间不平衡所致[2]。淀粉样斑块沉积在细胞外,主要由APP 的两种副产物Aβ40和Aβ42组成,其中Aβ42具有比Aβ40更高的成纤维率以及难溶性,Aβ42/Aβ40升高被认为是AD的典型特征[2-3]。此外,氧化应激也与AD 的发病有着密切联系,受缺氧和线粒体功能障碍的影响,细胞内活性氧生成增加[3-4]。活性氧在细胞中的水平可以调节细胞稳态,低水平的活性氧可以作为信号分子,而高水平的活性氧则可引起细胞氧化损伤、细胞功能障碍及退行性变,而这可进一步促进AD的疾病进程[4-5]。氧化应激可表现为蛋白质氧化以及脂质过氧化,研究表明Aβ 可诱导体内外神经元及星形胶质细胞蛋白质氧化,Aβ1-42还可以诱导脂质过氧化,也就是说Aβ 沉积也可以促进氧化应激反应[1]。
知母(Anemarrhenae Rhizoma)为百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎,传统医学将其药物作用归纳为清热泻火、滋阴润燥[6],现代药理学认为知母及其活性成分具有抗痴呆、抗凋亡、抗氧化、抗炎、抗病毒、免疫调节等药理作用[5,7-8],是治疗AD 的中草药之一。本研究通过网络药理学及实验验证探讨知母改善AD的作用机制。
1 材料与方法
1.1 数据库和软件
本研究参考的数据库有TCMSP 数据库(http://tcmspw.com/tcmsp.php)、Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)、OMIM数据库(https://omim.org/)、GeneCards 数据库(https://www.genecards.org/)、DrugBank 数据库(https://go.drugbank.com/)、STRING 数据库(https://string-db.org/)等;使用的软件有Venny 2.1 在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/)、Cytoscape 3.8.2软件、R4.0.5软件等。
1.2 材料、试剂和仪器
B95-8 细胞及人神经上皮瘤SKNMC 细胞购于上海富衡生物科技有限公司。N2株系、CL4176株系秀丽隐杆线虫(C. elegans)及线虫食物尿嘧啶突变型大肠杆菌(E. coli)OP50均购自美国线虫遗传中心(Caenorhabditis Genetics Center)。知母购于江苏省中医院,已经过药剂师鉴定。将知母在纯净水中浸泡30 min,文火煎煮两次,收集中药液,离心、过滤取上清液进行成分分析(表1),并按照冻干机操作流程制备冻干粉,制备好的冻干粉置于-20 ℃保存。淋巴细胞分离液为天津灏洋华科生物科技有限公司产品;植物凝集素-M为上海懋康生物科技有限公司产品;20%胎牛血清为美国Gibco公司产品;环孢素A为上海弘顺生物科技有限公司产品;Aβ1-42为美国CST公司产品;BACE1为湖南艾方生物科技有限公司产品;APP、PI3K、磷酸化PI3K、Akt、磷酸化Akt、GSK-3β、磷酸化GSK-3β、GAPDH、羊/兔二抗为武汉爱博泰克生物科技有限公司产品;NQO1、HO-1、β-肌动蛋白为武汉三鹰生物技术有限公司产品;百草枯、硫黄素S、β-巯基乙醇为上海凛恩科技发展有限公司产品;蛋白胨为英国OXOID 公司产品;氨苄青霉素、左旋咪唑为北京索莱宝科技有限公司产品;5-氟尿嘧啶为上海源叶生物科技有限公司产品。

表1 知母冻干粉中主要成分检测结果Table 1 Main components of lyophilized powder of Anemarrhenae Rhizoma
冻干机(LYO QUEST-55)为西班牙Telstar 公司产品;酶标仪(ELX-800)、荧光酶标仪(Synergy HT)为美国Bio-Tek 公司产品;正置荧光显微镜(DS-Qi2)、倒置荧光显微镜(DS-Ri2)为日本Nikon公司产品;倒置相差显微镜(CKX41)、体视显微镜(SZ2-ILST)为日本Olympus 公司产品;伯乐凝胶成像仪(CHEMIDOC XRS+)为美国Bio-Rad 公司产品;线虫培养箱(SPX-250B-Z)为上海博迅医疗生物仪器股份有限公司产品;恒温振荡仪(SKR1807-E)为美国Scilogex 公司产品;全自动样品快速研磨仪(Tissuelyzer-FeII)为南京乔贝琳生物科技有限公司产品。
1.3 网络药理学方法筛选和分析靶点
1.3.1 知母药物活性成分及相关靶点筛选 在TCMSP 数据库中检索“知母”的成分作为潜在活性成分,设定口服利用度≥30%、类药性≥0.18,并获取上述成分的结构,导入Swiss Target Prediction数据库,取预测得分大于0的靶点作为药物靶点。
1.3.2 AD 相关靶点及药物-疾病共同靶点筛选 在OMIM、GeneCards、DrugBank 数据库中以“Alzheimer’s disease”为关键词进行检索,获得疾病作用靶点。在Venny2.1 在线软件作图工具平台上输入所筛选的药物及疾病靶点,绘制韦恩图,两者取交集后获得药物-疾病共同靶点。
1.3.3 中药-成分-靶点-疾病网络构建及分析 用Cytoscape 3.8.2 软件构建“药物-成分-靶点-疾病”网络图,使用Network Analyzer功能对知母的主要活性成分进行分析。使用Network Analyzer 对网络图进行拓扑分析,度值表示该成分与作用靶点的关联个数,度值越大说明该成分越重要。
1.3.4 PPI 网络构建及核心靶点分析 将上述药物-疾病共同靶点输入STRING 数据库中进行检索,设置蛋白种类为“Homo sapiens”,最低相互作用阈值为0.4,获取靶点相互作用的网络关系数据,将其导入Cytoscape 软件,绘制蛋白相互作用网络图,以节点的大小、颜色及其深浅变化代表度值的大小。将PPI 网络导入Cystoscap 3.8.2中,通过Network Analyzer 工具进行拓扑分析,选取度值大于平均分的基因作为核心靶点,将前三十个靶点使用R 4.0.5绘制条形图。
1.3.5 GO 和KEGG 通路富集分析 基于R 软件使用Bioconductor 生物信息软件包以P<0.05,Q<0.05 为标准进行关键靶基因GO 和KEGG 功能富集分析,并将结果以条形图和气泡图形式输出。
1.4 细胞实验
1.4.1 外周血淋巴细胞提取及LCL 构建 外周血淋巴细胞提取自江苏省中医院于顾然教授门诊中简易智力状态检查量表评分18分以下的AD患者及社区医院体检中的健康体检者(伦理审查号2020NL-102-03、2020NL-102-05)。结合文献[9]中的方法,选择转化率较高的环孢素A 法构建体外LCL。经患者知情同意后采集3 mL 抗凝全血与等量无血清RPMI-1640 培养基混匀,缓慢滴加于淋巴细胞分离液平面,800×g离心20 min,此时可以看见离心管里自上而下分为血浆层、淋巴细胞层、淋巴细胞分离液层和红细胞层,小心吸出淋巴细胞层细胞加入10 mL 无血清RPMI-1640 培养基中混匀,200×g离心10 min,弃上清液,重复一次。将所得细胞沉淀加入2 mL 转化培养基(终浓度为2 µg/mL 植物凝集素加入含20%胎牛血清、青-链霉素、RPMI-1640 的完全培养基)与1.2 mL EB 病毒溶液(B95-8 细胞反复冻融的细胞悬液)中并混匀,再转入24 孔板中的两个孔置于细胞培养箱中培养1 h,每孔加入终浓度为2 µg/mL 的环孢素A 溶液。在5%二氧化碳、37 ℃细胞培养箱中培养,每日观察细胞状态,根据细胞状态每3~6天半数换液,3~4 d可见细胞聚团、体积稍增大。成功构建的LCL如图1 所示。
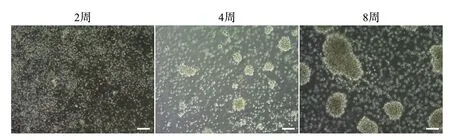
图1 不同培养时期淋巴母细胞样细胞系的形态Figure 3Morphology of lymphoblastoid cell line in different periods of in vitro culture
1.4.2 细胞培养 B95-8 细胞、LCL 细胞使用含20%胎牛血清、青-链霉素、两性霉素B 的RPMI-1640培养基培养,根据细胞状态,每3~6天半数换液;SKMNC 细胞使用含10%胎牛血清和青-链霉素的MEM 培养基培养,每1~2 天换液。所有细胞置于5%二氧化碳、37 ℃细胞培养箱中进行培养。
1.4.3 MTT 法和CCK-8 法检测SKNMC 细胞和LCL 细胞活性 采用MTT 法检测SKNMC 细胞活性。SKNMC 细胞按1×104个/孔种植于96 孔板中,培养24 h 后加入浓度为25、50、75、100 mg/L 的知母冻干粉溶液,继续培养24 h,每孔加入20 µL MTT 溶液,避光培养4 h,离心后弃上清液,加入150 µL/孔DMSO 溶液并充分振荡,酶标仪490 nm波长处测定吸光度值。
由于LCL 为悬浮细胞,为避免离心重悬引起的误差,故选用CCK-8 法检测。LCL 细胞按(7~8)×103个/孔种植于96 孔板中,正常对照为健康体检者的LCL 细胞,模型对照为AD 患者的LCL细胞,其他组分别加入终浓度为25、50、75 mg/L知母溶液,24 h 后每孔加入10 µL CCK-8 溶液,继续孵育2 h,用酶标仪在波长450 nm 处测定吸光度值。细胞活性(%)=(实验组吸光度值-空白组吸光度值)/(正常对照组吸光度值-空白组吸光度值)×100%
1.4.4 LCL-SKNMC 细胞共培养模型的构建和细胞分组 将SKNMC 细胞种植于Transwell 小室下层,24 h 后观察细胞形态,待其密度达70%以上时用于构建共培养模型,LCL 细胞种植于Transwell 小室上层进行共培养,其中正常对照组为健康体检者的LCL 细胞,模型对照组为AD 患者的LCL 细胞,其他各组于模型对照组中加入不同浓度的知母溶液(25、50、75 mg/L),给药24 h后用于后续实验。
1.4.5 DCFH-DA探针检测共培养模型中生成的活性氧 共培养模型加入不同浓度(25、50、75 mg/L)知母冻干粉溶液或1 mmol/LN-乙酰半胱氨酸,24 h 后移走上层LCL 细胞,PBS 清洗SKNMC 细胞,加入终浓度为10 µmol/L 的DCFHDA 溶液,继续避光孵育20~30 min,弃上清液,PBS 洗三遍后,倒置荧光显微镜下拍照,采用Image J处理图像。
1.4.6 免疫荧光染色检测共培养模型中生成的Aβ1-42共培养模型加入不同浓度(25、50、75 mg/L)知母冻干粉溶液或1 mmol/LN-乙酰半胱氨酸,24 h 后移走上层LCL 细胞,PBS 清洗SKNMC 细胞,之后分别用4%多聚甲醛固定、0.3% Triton-X100通透各20 min,继续用免疫荧光封闭液室温封闭1 h,加入Aβ1-42抗体(1∶200),4 ℃避光孵育过夜。室温复温1 h,PBST洗三遍,加入荧光二抗孵育1 h,避光操作,之后加入DAPI 染色10 min,PBST 清洗后扣片,正置荧光显微镜下观察并拍照,用Image J处理图像。
1.4.7 蛋白质印迹法检测共培养模型中蛋白表达 共培养模型常规处理后,PBS清洗细胞三次,细胞裂解液冰上裂解30 min,裂解后的细胞液超声三次,每次15 s,4 ℃、13 225×g离心20 min,收集上清液,按照BCA 试剂盒测定蛋白浓度,细胞上清液加入SDS 上样缓冲液,100 ℃煮10 min 并于-80 ℃保存。制备好的蛋白样品加入10%~15% SDS 聚丙烯酰胺凝胶电泳凝胶中恒压电泳,聚偏二氟乙烯恒流转膜60 min,5%脱脂牛奶封闭1 h,与一抗(Aβ1-42、APP、BACE1、PI3K、磷酸化PI3K、Akt、磷酸化Akt、GSK-3β、磷酸化GSK-3β、NQO1、HO-1、GAPDH、β-肌动蛋白)结合,4 ℃孵育过夜。TBST 洗三次后与羊/兔二抗室温孵育1 h,TBST 洗三次,ECL 化学发光法检测,伯乐凝胶成像仪观察条带,Image Lab分析条带灰度。
1.5 线虫实验
1.5.1 线虫的培养 将线虫置于涂有E.coliOP50的NGM 培养基上进行培养,其中N2 株系线虫于20 ℃培养、CL4176 株系线虫于16 ℃培养。待线虫生长至产卵期时,使用限时产卵法或者次氯酸钠裂解法同期化线虫,同期化的线虫用于实验。
1.5.2 百草枯氧化胁迫实验研究氧化应激状态下线虫的寿命 收集同期化的N2 线虫,调整线虫密度为20~25 条/10 µL 于96 孔板中培养,每孔含有E.coliOP50、氨苄青霉素、5-氟尿嘧啶,加入90 µL 知母冻干粉溶液使其终浓度为1~100 mg/mL,空白对照组加入等量培养基,恒温振荡仪培养24 h 后每孔加入终浓度为75 mmol/L 的百枯草[10],充分混匀。12 h 观察并记录线虫的存活数,直至线虫全部死亡。每组设三个平行组。
1.5.3 寿命实验研究正常状态下线虫的寿命 同期化N2 线虫转移至含有知母冻干粉溶液的NGM 培养基中培养,从转移当天开始记录,每两天记录线虫的存活数及死亡数,直至线虫全部死亡。每组设三个平行组。
1.5.4 热应激实验研究热应激状态下N2 线虫的寿命 同期化的N2 线虫于含有知母冻干粉溶液的NGM 培养基上培养48 h 后转移至37 ℃继续培养,每小时观察并记录线虫数,直至线虫全部死亡。每组设三个平行组。
1.5.5 瘫痪实验研究CL4176 线虫瘫痪时间 CL4176 转基因线虫体壁肌肉中转入了人源性Aβ1-42基因,当生存温度由16 ℃调整为23 ℃时,其体壁肌肉中可表达人源性Aβ1-42蛋白,表现出AD 样的瘫痪表型[11]。同期化CL4176 线虫,之后转移至含有知母冻干粉溶液的NGM 培养基中再次同期化,16 ℃培养36 h 后于23 ℃培养28 h,观察线虫瘫痪情况,每两小时记录。每组设三个平行组。
1.5.6 DCFH-DA 探针检测N2 线虫生成的活性氧 按照1.5.1处理线虫,M9缓冲液收集线虫,加入终浓度为10 µmol/L 的DCFH-DA 溶液,避光孵育20 min,荧光酶标仪(激发波长为485 nm、发射波长为538 nm)测定荧光强度值,每十分钟测量一次,连续测量2 h。
1.5.7 硫黄素S 染色检测CL4176 线虫咽部沉积的Aβ 按照1.5.1 培养CL4176 线虫。收集线虫,4%多聚甲醛4 ℃固定24 h,37 ℃下通透液(5% β-巯基乙醇、1% TritonX-100、12 mmol/L Tris,pH7.4)通透24 h,0.125%硫黄素S/50%乙醇溶液室温避光染色2 min,50%乙醇脱色三次,每次2 min,M9 缓冲液清洗线虫三次,之后用M9 缓冲液重悬线虫。滴加线虫于载玻片上,并加入左旋咪唑溶液麻痹线虫。正置荧光显微镜观察线虫咽部Aβ 沉积数,Image J测量线虫咽部面积,统计单位面积内的Aβ沉积数[12]。
1.6 统计学方法
使用SPSS 22.0和Graph Pad Prism 8.0统计分析。正态分布的计量资料采用均数±标准差(±s)描述,多组间数据比较采用单因素方差分析,方差齐时使用Turkey 检验,方差不齐时使用Dunnett’s T3检验;计数资料采用例数(%)[n(%)]描述。使用Kaplan-Meier检验及Log-Rank(Mantel-Cox)对线虫进行生存分析。
2 结 果
2.1 中药-成分-靶点-疾病网络构建
对知母的有效成分进行筛选共得到15 个潜在活性成分(表2),将所筛选出的知母活性成分使用Swiss Target Prediction 数据库筛选出518 个药物靶点。以“Alzheimer’s disease”为关键词分别在OMIM、GeneCards、DrugBank 数据库进行检索,去重后共获得1014 个疾病靶点。将筛选出的518 个药物靶点与1014 个疾病靶点输入Venny 2.1 在线软件,绘制韦恩图,两者取交集后获得药物-疾病共同靶点103 个(附图1)。将知母中15个潜在活性成分和103 个药物-疾病共同靶点输入Cytoscape 软件中,绘制出“药物-成分-靶点-疾病”相互作用的网络图(图2)。
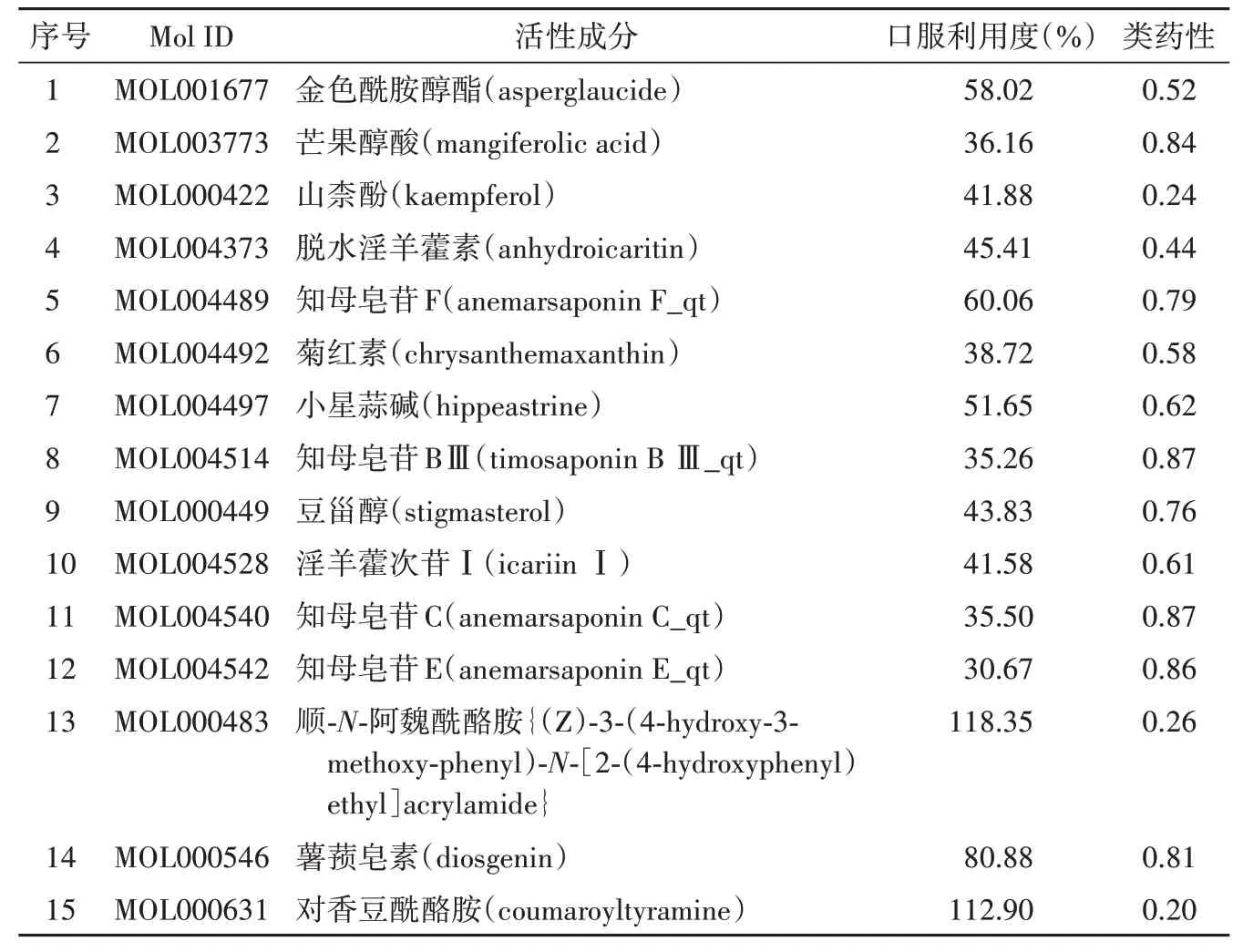
表2 知母潜在活性成分Table 2 Potential active components of Anemarrhenae Rhizoma

图2 药物-成分-靶点-疾病相互作用的网络图Figure 2 Network diagram of drug-components-target-disease interactions
2.2 PPI网络构建及分析
PPI 网络图如图3 所示,将PPI 网络进行拓扑分析,筛选出的核心靶点如图4所示,知母可能通过ALB、Akt1、TNF、EGFR、VEGFA、mTOR、APP等相关靶点发挥抗AD作用。
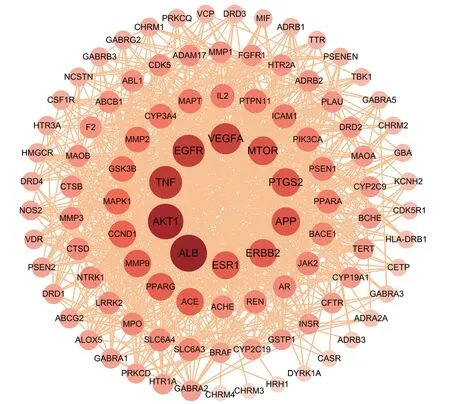
图3 知母作用于阿尔茨海默病相关靶点的蛋白质-蛋白质相互作用网络Figure 3 Protein-protein interaction network of Anemarrhenae Rhizoma acting on Alzheimer’s disease related targets

图4 知母作用于阿尔茨海默病的核心靶点分析结果Figure 4 Analysis of the core target of Anemarrhenae Rhizoma on Alzheimer’s disease
将103个共同靶点进行GO分析,结果显示交集基因集合共富集至1857 条生物学过程通路、122 条细胞组分表达过程和150 个与分子功能相关的过程,每个部分均选取前二十个条目,结果见附图2。所涉及的生物学过程主要包括细胞对单胺、儿茶酚胺刺激反应、对单胺、儿茶酚胺、多巴胺的反应、跨突触信号传导的调控、认知、蛋白质丝氨酸-苏氨酸激酶活性的正调控、肽酪氨酸磷酸化、学习或记忆、神经元死亡等过程;在细胞组分上主要作用于突触前膜、突触膜的组成部分、突触膜、突触前膜固有成分、γ-氨基丁酸受体复合物、氯离子通道复合体等;分子功能主要有神经递质、突触后神经递质受体活性、药物结合、G 蛋白偶练5-羟色胺、5-羟色胺受体活性、配体门控阴离子通道活性、γ-氨基丁酸受体活性、胰岛素受体底物结合、蛋白磷酸酶结合等。
将103 个共同靶点经R 语言运行后共得到140 条KEGG 通路,根据P<0.05 选取前二十条通路形成KEGG 功能富集分析图。如附图3 所示,主要涉及阿尔茨海默病、内分泌抵抗、胰岛素抵抗及多种癌症等生物过程,以及神经活性配体-受体相互作用、PI3K/Akt 信号通路、钙信号通路、神经营养因子信号通路、红细胞原癌基因B 信号通路等。
2.3 知母对SKMNC细胞及LCL活性的影响
与不加知母溶液的对照组比较,25、50、75 mg/L 知母组中SKNMC 细胞的活性分别为(98.7±8.6)%、(97.8±7.6)%、(96.3±7.3)%,较对照组无明显下降(均P>0.05),而加入100 mg/L 知母后细胞活性下降至(85.3±1.9)%,与对照组比较差异有统计学意义(P<0.05),因此选择25、50、75 mg/L 浓度用于后续细胞实验。进一步评估知母对LCL 的影响发现,在正常对照细胞中,与不加知母溶液的LCL 比较,加25、50、75 mg/L知母后LCL 的活性分别为(102.3±1.7)%、(103.9±6.5)%和(100.2±3.9)%,差异无统计学意义(均P>0.05);在模型对照细胞中,与不加知母溶液的LCL 比较,加25、50、75 mg/L知母后LCL的活性分别为(101.6±1.3)%、(101.4±0.7)%和(101.4±4.1)%,差异无统计学意义(均P>0.05)。由此可见,25、50、75 mg/L 知母对SKMNC 和LCL 细胞活性均不会产生明显影响。
2.4 知母对LCL-SKNMC共培养模型中活性氧、Aβ1-42生成以及Aβ 生成相关蛋白表达的影响
DCFH-DA 探针检测结果显示,与正常对照组比较,模型对照组可见明显的活性氧积累(P<0.01),而不同浓度知母组活性氧积累较模型对照组明显减少(均P<0.01),并表现出浓度相关性,N-乙酰半胱氨酸组的活性氧生成也较模型对照组明显减少(P<0.01),见图5、表3。免疫荧光染色结果显示,与正常对照组比较,模型对照组可见较多的Aβ1-42生成(P<0.01),而知母组和N-乙酰半胱氨酸组Aβ1-42生成较模型对照组减少,其中50、75 mg/L知母组及N-乙酰半胱氨酸组的Aβ1-42生成量与模型对照组相比差异有统计学意义(均P<0.01),见图6、表3。蛋白质印迹法检测结果显示,与正常对照组比较,模型对照组BACE1、APP、Aβ1-42表达上调(均P<0.05),而各知母组上述蛋白的表达低于模型对照组,且呈现出浓度相关性,见图7、表4。上述结果提示,知母可减少共培养模型中活性氧生成,减少Aβ1-42的产生,抑制Aβ 生成相关蛋白BACE1、APP、Aβ1-42的表达。

图5 各组DCFH-DA探针检测活性氧生成情况Figure 5 Reactive oxygen species production in each group( DCFH-DA probe assay)
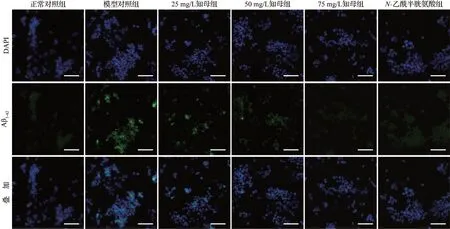
图6 各组免疫荧光染色观察Aβ1-42生成情况Figure 6 Aβ1-42 production in each group( immunofluorescence staining)

图7 各组Aβ相关蛋白表达电泳图Figure 7 Electrophoretogram of Aβ-related proteins expression in each group
表3 各组共培养模型活性氧、Aβ1-42生成比较Table 3 Production of reative oxygen species and Aβ1-42 in co-culture models(±s,%)

表3 各组共培养模型活性氧、Aβ1-42生成比较Table 3 Production of reative oxygen species and Aβ1-42 in co-culture models(±s,%)
与正常对照组比较,**P<0.01;与模型对照组比较,##P<0.01.Aβ:β淀粉样蛋白.
组 别正常对照组模型对照组25 mg/L知母组50 mg/L知母组75 mg/L知母组N-乙酰半胱氨酸组n333333活性氧100±13 227±24**121±7##98±4##86±9##85±10##Aβ1-42 100±4 499±48**435±33 309±66##105±21##112±19##
表4 各组共培养模型Aβ相关蛋白表达比较Table 4 Expression of Aβ related proteins in co-culture models(±s,%)

表4 各组共培养模型Aβ相关蛋白表达比较Table 4 Expression of Aβ related proteins in co-culture models(±s,%)
与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01. BACE:β-分泌酶;APP:淀粉样前体蛋白;Aβ:β-淀粉样蛋白;GAPDH:甘油醛-3-磷酸脱氢酶.
组 别正常对照组模型对照组25 mg/L知母组50 mg/L知母组75 mg/L知母组n33333 Aβ1-42/GAPDH 100±27 220±25*167±28 120±43#109±52#APP/GAPDH 100±9 152±6**105±15##91±13##80±19##BACE1/β-肌动蛋白100±15 153±5*103±15#96±24##97±13#
2.5 知母对LCL-SKNMC 共培养模型中PI3K/Akt/GSK-3β 通路相关蛋白表达的影响
结合网络药理学结果,进一步分析知母对PI3K/Akt/GSK-3β 通路相关蛋白表达的影响。与正常对照组比较,模型对照组PI3K、Akt、GSK-3β 磷酸化水平受到明显抑制(均P<0.05),而加入知母各组上述蛋白的磷酸化水平得到逆转,并呈现一定的浓度相关性,见图8、表5。对抗氧化反应元件相关蛋白HO-1 和NQO1 进行检测发现,与正常对照组比较,模型对照组HO-1、NQO1 表达无明显变化,但各知母组HO-1、NQO1 表达增加,见图8、表5。结果提示,知母可通过调控PI3K/Akt/GSK-3β 通路促进抗氧化反应元件相关蛋白表达,发挥抗氧化作用。

图8 各组Akt/GSK-3β通路相关蛋白表达电泳图Figure 8 Electrophoretogram of Akt/GSK-3β pathway related protein expression
表5 各组Akt/GSK-3β通路相关蛋白表达比较Table 5 Comparison of effect of Anemarrhenae Rhizoma on the expression of Akt/GSK-3β pathway proteins in co-culture model(±s,%)

表5 各组Akt/GSK-3β通路相关蛋白表达比较Table 5 Comparison of effect of Anemarrhenae Rhizoma on the expression of Akt/GSK-3β pathway proteins in co-culture model(±s,%)
与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01. PI3K:磷脂酰肌醇3-激酶;Akt:蛋白激酶B;GSK:糖原合成激酶;HO:血红素氧合酶;NQO:NAD(P)H醌氧化还原酶;GAPDH:甘油醛-3-磷酸脱氢酶.
组 别正常对照组模型对照组25 mg/L知母组50 mg/L知母组75 mg/L知母组n33333磷酸化PI3K/PI3K 100±14 31±7*60±18 101±29#171±29##磷酸化Akt/Akt 100±6 46±7**80±26 103±6#117±12##磷酸化GSK-3β/GSK-3β 100±28 19±3**70±23#76±15#117±12##NQO1/GAPDH 100±11 86±15 96±20 132±14#162±17#HO-1/GAPDH 100±25 100±26 117±26 133±17 192±49#
2.6 线虫体内实验验证知母对各种状态下线虫寿命的影响
知母浓度筛选实验结果显示,100 mg/mL 知母处理后N2 线虫在氧化应激状态下的最大生存时间明显缩短(图9),而10、20、40 mg/mL 知母可以延长N2 线虫在正常、氧化应激和热应激等状态下的平均生存时间及最大生存时间(附图4A~C 和表6),因此选择10、20、40 mg/mL 浓度的知母用于后续线虫实验。

图9 知母处理线虫在氧化应激下的生存曲线Figure 9 Survival curve of N2 nematodes under oxidative stress after treatment with Anemarrhenae Rhizoma

表6 各组线虫平均寿命及瘫痪时间比较Table 6 Comparison of lifespan and paralysis time of nematodes in each group
2.7 线虫体内实验验证知母对AD 活性氧产生的影响
DCFH-DA探针检测结果显示,随着检测时间的延长,每组线虫体内活性氧生成均呈现增加,其中模型对照组活性氧增加最快,而不同浓度知母和N-乙酰半胱氨酸均可减少线虫体内活性氧的生成,并存在浓度依赖性,见图10。结果提示,知母可抑制百枯草诱导的N2线虫体内活性氧的增加,具有抗氧化作用。

图10 各组线虫加入DCFH-DA后荧光强度值变化Figure 10 Effect of different concentrations of Anemarrhenae Rhizoma on reactive oxygen species production in N2 nematodes
2.8 知母可延缓CL4176线虫瘫痪及抑制Aβ 蛋白沉积
瘫痪实验结果显示,知母处理的CL4176线虫瘫痪时间延后(附图4D),其中20、40 mg/mL 知母处理组瘫痪时间与对照组差异有统计学意义(均P<0.05,表6),表明知母在一定程度上具有抗AD 作用。Aβ蛋白检测结果显示,未经药物处理的CL4176 线虫可见咽部沉积大量Aβ 蛋白(100.0±5.9)%,而10、20和40 mg/mL 知母处理后CL4176 线虫咽部Aβ 蛋白沉积分别减少至(77.7±5.2)%、(55.2±2.0)%和(51.3±9.0)%(均P<0.01),见图11,表明知母可抑制CL4176 线虫咽部Aβ 蛋白沉积,发挥抗AD作用。

图11 各组线虫硫黄素染色结果Figure 11 Effect of different concentrations of Anemarrhenae Rhizoma on Aβ protein deposition in CL4176 nematodes
3 讨 论
AD 是一种大脑细胞退化的疾病,是造成痴呆的主要原因[13],随着全球人口老龄化进程加快,AD 患者数量呈逐年增加趋势,严重影响社会和经济发展[14-15]。故而,寻找有效的药物来延缓该疾病发生,对全社会意义重大。目前随着中医药的广泛运用,知母对该病的疗效越来越得到肯定[16],但其机制尚不明确。因此,本研究通过网络药理学方法及实验验证探索知母治疗AD 的作用机制。
根据PPI 网络结果,本研究筛选出ALB、Akt1、TNF、EGFR、VEGFA、mTOR、APP 等关键靶点,其中ALB、Akt1 的度值最高,提示这两个靶点可能是知母治疗AD 最关键靶点。其中ALB 多用于肿瘤研究[17],而Akt1 常用于AD 研究。Akt1基因编码的是丝氨酸/苏氨酸激酶,细胞外的信号激活可通过PI3K 实现。KEGG 结果显示,知母治疗AD 通路中占比排序分别是神经活性配体-受体相互作用、PI3K/Akt 信号通路、钙信号通路、内分泌抵抗、胰岛素抵抗、神经营养因子信号通路、糖尿病并发症中的AGE/RAGE 信号通路等通路,这些信号通路与AD 的发病机制均相关。神经系统中最基本的单位是神经元,而神经元是信息交流与学习的重要功能单位,神经活性配体-受体相互作用是在记忆和学习方面起主要作用[18]。而PI3K/Akt 信号通路在AD 的发病机制中至关重要。有研究显示,PI3K/Akt 信号通路的增强可加强自噬,从而增加Aβ 的清除[19]。另外,PI3K/Akt通路是与细胞防御相关的多功能典型信号通路,该通路的激活参与了氧化还原反应的调节,并在保护细胞免受氧化应激方面起着关键作用[20]。PI3K/Akt 信号通路还可以通过调控GSK-3β 磷酸化来影响APP 和Aβ 的生成,研究表明,GSK-3β是PI3K/Akt 通路下游的关键元件,与AD 中Aβ 沉积相关,Akt 介导的磷酸化可抑制其表达,抑制GSK-3β 活性可改善认知缺陷并降低氧化应激反应[20-21]。抗氧化反应元件位于细胞核中,当受到应激刺激时可被激活,导致抗氧化反应元件下游基因的转录和表达,包括抗氧化剂、抗氧化蛋白酶体、Ⅱ期解毒酶等[22]。抗氧化反应元件被激活后会引起抗氧化级联反应,几种内源性抗氧化酶,如HO-1、NQO1 在氧化应激级联反应中可被进一步调节[23-24],而这两个蛋白是PI3K/Akt 信号通路中与氧化应激相关的重要蛋白[25-26]。在氧化应激条件下,细胞内活性氧数增加,导致细胞膜结构和功能破坏[27]。中枢神经系统极易受到氧化应激的影响,AD 患者大脑中存在过多的活性氧和生物活性物质,可以促进Aβ斑块的沉积,Aβ蛋白在大脑中发挥破坏作用,包括降低突触可塑性、抑制海马的长期增强和产生活性氧等[23,28]。在AD 中,β-分泌酶和γ-分泌酶产生具有淀粉样蛋白特征的APP成分,其中BACE1是参与APP代谢的β-分泌酶,可通过裂解APP生成Aβ[3,29]。随着年龄的增长,β-分泌酶在AD 患者大脑中的表达水平也逐渐升高,在细胞模型中,氧化应激以及缺血缺氧、能量剥夺等情况均可促进BACE1的高表达[3]。
本研究通过细胞共培养实验进行体外研究发现,模型对照组活性氧生成明显增加,氧化应激增多,而知母可减少共培养模型SKNMC细胞中活性氧的生成,具有抗氧化作用;根据免疫荧光染色结果,与正常对照组比较,模型对照组可见较多的Aβ1-42生成,而各知母组减少了细胞中Aβ1-42生成,具有抗AD 作用;蛋白质印迹法检测结果显示,与正常对照组比较,模型对照组BACE1、APP、Aβ1-42表达上调,而各知母组上述蛋白的表达低于模型对照组,同时,知母可上调共培养模型SKNMC细胞中PI3K、Akt、GSK-3β 的磷酸化水平和HO-1及NQO1 蛋白的表达,即可通过PI3K/Akt/GSK-3β减轻AD LCL 诱导的毒性作用,增加抗氧化应激能力,从而发挥抗AD 作用。知母的上述作用机制在体内研究中也得到了证实。在秀丽隐杆线虫中,知母可延长正常状态及应激状态下线虫的寿命,减少活性氧的积累,减少温度诱导下CL4176 转基因线虫AD 样瘫痪表型及咽部的Aβ沉积,具有抗AD作用。
综上所述,本研究从网络药理学方面探讨了知母治疗AD的可能作用机制,并从细胞及线虫层面验证了知母可减少AD 中Aβ 的生成,减轻活性氧的积累,抑制氧化应激作用,起到一定的抗AD作用,有望为后续研究知母治疗AD的相关作用机制及为相关药物的研发提供一定的理论依据。
本文附图见电子版。

志谢研究得到国家重点研发计划(2022YFC3501403)、江苏省研究生科研与实践创新计划(KYCX23-2168)支持
AcknowledgementsThis work was supported by the National Key R&D Program of China (2022YFC3501403),and Jiangsu Graduate Student Research and Practice Innovation Program (KYCX23-2168)
利益冲突所有作者均声明不存在利益冲突
Conflict of InterestsThe authors declare that there is no conflict of interests
©The author(s) 2024. This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

