依洛尤单抗在经皮冠状动脉介入治疗患者中的疗效与安全性分析
孙溆棋,李 远,周海辉
0 引言
急性冠状动脉综合征(Acute coronary syndrome,ACS)患者在经皮冠状动脉介入治疗(Percutaneous coronary intervention,PCI)后,短期心血管不良事件的发生率仍然很高。降低低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)可降低心血管不良预后的发生率[1]。目前,他汀类药物是降脂治疗的基石,但由于各种原因,许多患者需要额外降脂治疗,治疗药物通常包括前蛋白转化酶枯草杆菌蛋白酶/Kexin9型(Proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂等[2-5]。
目前,中国国内上市的PCSK9抑制剂有依洛尤单抗和阿利西尤单抗注射液。研究显示,两者可将LDL-C降低50%~60%[6]。2021年12月,PCSK9抑制剂进入中国国家医保目录,经过集中采购后,药品价格降幅达到70%以上,预计受益人群数量将大幅增加。近期研究显示,超高危ASCVD患者早期使用PCSK9抑制剂,可更显著降低动脉粥样硬化性心血管疾病(Atherosclerotic cardiovascular disease,ASCVD)的风险,且长时间使用具有良好的安全性[7]。虽然临床试验中有大量的研究验证了PCSK9抑制剂的有效性和安全性,但目前国内基于PCSK9抑制剂的研究大多限于稳定的冠状动脉粥样硬化患者,对于PCI术后ASCVD超高危人群临床应用PCSK9抑制剂的真实世界的数据还较少。因此,本研究旨在评估PCI术后患者应用依洛尤单抗的有效性和安全性,为临床合理用药提供参考依据。
1 资料与方法
1.1 研究对象 根据纳入和排除标准,回顾性抽取2022年1月1日-6月1日在南京鼓楼医院心血管内科行PCI术后超高危ASCVD患者,共178例。纳入标准:①18~80岁;②已明确诊断为急性冠状动脉综合征[8]并接受PCI治疗;③患者PCI治疗前未接受相关治疗;④患者服用中等强度他汀类药物(阿托伐他汀20 mg/d或瑞舒伐他汀10 mg/d);⑤患者ASCVD危险分层为超高危,其定义依据《中国血脂管理(2023年)》[9]的标准;⑥患者于我院心血管内科连续治疗,并且医院信息系统(Hospital Information System,HIS)保有治疗记录时长6个月以上。排除标准:①妊娠、哺乳期女性;②系统内缺乏纳入患者相关信息(例如年龄、性别、处方信息),患者治疗期间未在我院检测血液指标,如AST、ALT、尿酸、eGFR和空腹血糖等;③活动性肝病患者;④肾功能不全患者;⑤患者合并恶性肿瘤,预期寿命少于6个月;⑥研究期间患者的治疗方案发生调整;⑦服用阿托伐他汀、瑞舒伐他汀及依洛尤单抗之外的降脂药的患者。依据患者降脂方案的不同,将其分为对照组(中等强度他汀类药物组)和观察组(依洛尤单抗联用中等强度他汀类药物组)。
1.2 方法
1.2.1 治疗方法 对照组应用中等强度他汀类药物,观察组以中等强度他汀类药物为基础,同时联合依洛尤单抗。中等强度他汀类药物的方案:阿托伐他汀(乐普制药科普有限公司生产,国药准字:202209212B)20 mg/d或瑞舒伐他汀(南京正大天晴制药有限公司,国药准字:A220901)10 mg/d,依洛尤单抗(美国Amgen生产,生产批号:1145107)每次140 mg皮下注射,每2周1次。医务人员对所有PCI术后患者进行相同的健康生活方式教育。
1.2.2 观察指标和随访 患者入院后即刻监测血常规、肝肾功能、总胆固醇、甘油三酯、LDL-C、HDL-C、高敏肌钙蛋白、B型钠尿肽、肌酸激酶同工酶(CK-MB)等指标。在患者出院后第1、3、6个月对其进行门诊随访,收集血脂水平、肝肾功能指标和不良反应等。选取心绞痛复发、心源性死亡、再发心肌梗死和靶血管重建为主要观察终点事件。

2 结果
2.1 两组患者基线资料比较 经过6个月治疗两组均无失访患者,随访率为100%,最终对照组纳入82例,观察组纳入96例。两组患者的性别、年龄、BMI、合并疾病数量、学历、用药情况、高敏肌钙蛋白、B型钠尿肽、介入血管比例、病变血管数等差异无统计学意义(P>0.05),观察组中城市居民占比高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者基线资料比较
2.2 两组患者主要观察指标比较
2.2.1 两组患者降脂有效性比较 两组患者基线的血脂指标差异无统计学意义,用药6个月后,TC、TG、LDL-C均明显下降(P<0.05);与对照组比较,观察组的TC、LDL-C更低(P<0.05)。见表2。

表2 两组患者降脂治疗的效果比较
2.2.2 两组患者治疗后不同时间点的血脂达标率 根据《超高危动脉粥样硬化性心血管疾病患者血脂管理中国专家共识》[8],对符合中国超高危ASCVD定义的患者降脂靶标设定为:LDL-C降低至1.4 mmol/L以下且较基线降幅超过50%。两组患者治疗1个月、3个月和6个月后的血脂达标率见表3。

表3 两组患者治疗后不同时间点LDL-C达标情况[例(%)]
2.2.3 两组患者终点的肝酶指标、尿酸、空腹血糖、eGFR和不良反应比较 6个月治疗期间,两组共发生不良反应56例,对照组和观察组各28例,两组不良反应发生率差异无统计学意义(对照组:34.1%,观察组:29.2%,P=0.29),表明依洛尤单抗并没有增加不良反应。两组相关实验室检查结果差异无统计学意义。见表4。
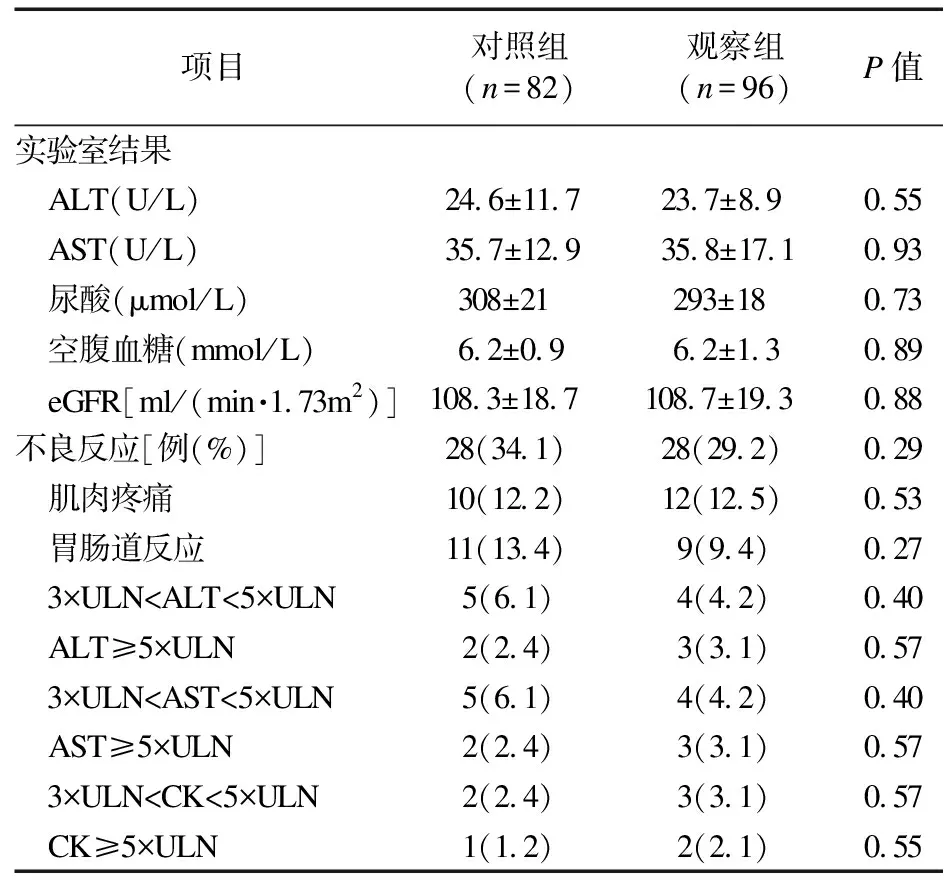
表4 两组患者终点实验室检查结果和不良反应比较
2.2.4 两组患者终点事件比较 在6个月的观察期内,对照组心绞痛复发12例,靶血管重建2例,心源性死亡0例,终点事件总发生率为17.1%;观察组患者心绞痛复发5例,靶血管重建1例,心源性死亡0例,终点事件总发生率为6.3%。两组终点事件总发生率比较差异有统计学意义(P<0.05)。
3 讨论
本研究共纳入178例患者,其中观察组96例,对照组82例,两组患者血脂的基线水平差异无统计学意义。治疗6个月后,观察组的平均LDL-C为(0.8±0.2) mmol/L,明显低于对照组的(1.5±0.2) mmol/L,观察组血脂达标率为100%,高于对照组的86.6%。依洛尤单抗联合他汀类药物的降脂方案体现了较好的降脂效果,与以往的研究结果类似[10-11]。有研究表明,他汀类药物对LDL受体表达的有益作用部分被PCSK9表达的增加所抵消[12]。因此,PCSK9抑制剂可能与他汀类药物有协同降脂作用。另一方面,在血运重建后的早期,ACS患者复发缺血事件的风险增加[13]。有研究表明,在血运重建的早期应用他汀类药物,可以减少心血管事件的发生[14],其临床获益与LDL-C水平降低呈正比[15-16]。MENDEL-2试验比较了依洛尤单抗与依折替布和安慰剂的疗效,治疗12周后,依洛尤单抗与安慰剂组比较,LDL-C降低57%,与依折麦布组对比降低40%,表明PCSK9抑制剂具有较好的降脂效果[17]。除了PCSK9调控LDL-C的作用外,目前,越来越多的研究显示,PCSK9可能在动脉粥样硬化斑块的炎症发展和血栓形成过程中发挥作用[18-20]。全球多中心临床试验HUYGEN研究显示,对于血运重建后的患者,1周内启动依洛尤单抗治疗约1年,他汀类药物+依洛尤单抗组的LDL-C较他汀类药物+安慰剂组显著降低最小纤维帽厚度[21]。对于富脂斑块,对比安慰剂,使用依洛尤单抗后,最小纤维帽厚度、脂质弧度和脂质长度均有改善。在减少斑块体积方面,与他汀类药物+安慰剂组相比,他汀类药物+依洛尤单抗组的斑块体积百分比和斑块总体积降幅更大。日本Yano等[22]的研究显示,与单用他汀类药物相比,他汀类药物联合PCSK9抑制剂治疗,在12周时可以显著改善患者脂质斑块纤维帽厚度,减小脂质弧度,减少巨噬细胞。因此,PCSK9抑制剂对延缓斑块进展甚至逆转斑块具有一定效果,可能给ASCVD高危患者带来更多获益。
使用PCSK9抑制剂时,最常见的不良反应为肌肉疼痛(27.2%)、背痛(12%)、鼻咽炎(9.3%)、头痛(9.2%)、上呼吸道感染(9%)、流感样症状(7.5%)、关节疼痛(7%)或ALT、AST水平高于正常上限(6%)的3倍[23-24]。本研究中,比较两组患者药物不良反应的发生情况,提示PCSK9抑制剂联合他汀类药物降脂未增加常见不良反应。另一方面,部分研究揭示依洛尤单抗会导致神经认知功能障碍等不良反应[10,25-27],可能由于本研究观察时间不长,这类不良反应未在本研究中出现,但值得临床医生关注。
本研究的局限性为安全性观察时间及样本量有限。因此,还需要通过样本量更大的随机对照试验对临床2种治疗方案的有效性、安全性等进行深入研究。
综上所述,在ASCVD超高危患者的PCI术后应用依洛尤单抗联合中等强度的他汀类药物可以改善预后,且与单用中等强度他汀类药物相比,未增加不良反应。

