下调PPAPDC1A的表达对结直肠癌细胞的增殖、侵袭和转移的影响
郜培琼,千新来,贺国洋,原志庆
结直肠癌是全球常见的癌症之一[1],其发病率位居女性恶性肿瘤的第2位,位居男性恶性肿瘤的第3位[2]。转移是多数结直肠癌患者预后不良的主要原因,在初次诊断时约25%患者已发生远隔脏器的转移[3]。磷脂酸磷酸酶2域1A(PPAPDC1A)是一种由271个氨基酸组成的整体膜磷酸酶,属于新型的磷脂酸磷酸酶(PAP)。PAP促进磷脂酸向二酰甘油的转化,二酰甘油是细胞信号传导中重要的有机磷酸盐,在脂质代谢和癌症发展中发挥重要作用[4]。PAP酶包括PAP1(Mg2+依赖型)和PAP2(Mg2+非依赖型)。PPAPDC1A是PAP2亚型的成员之一。研究发现,PPAPDC1A在肺癌组织中过表达,并促进肿瘤细胞的增殖和肿瘤的发生[5]。最新研究表明,PPAPDC1A基因在乳腺癌组织中表达上调,乳腺癌细胞分泌的外泌体通过miR-892b/PPAPDC1A途径将SNHG16转移到受体细胞,从而促进乳腺癌的侵袭、迁移及上皮-间充质转化[6-8]。然而,目前PPAPDC1A与结直肠癌发生、发展的关系尚不清楚。本课题组先前研究发现PPAPDC1A在6种结直肠癌细胞株中差异表达,本研究筛选SW480、SW620、RKO和LOVO细胞为研究对象,进一步探讨PPAPDC1A在结直肠癌发生、发展中的作用,旨在探寻结直肠癌新的肿瘤标志物和治疗靶点。
1 材料与方法
1.1 材料
1.1.1样本和细胞培养 收集2015~2017年新乡医学院第三附属医院病理科存档的60例结直肠癌手术切除标本。所有患者均不伴有其他肿瘤,且均未接受任何抗癌治疗。本实验经新乡医学院第三附属医院伦理委员会批准,并征得患者知情同意。病理诊断、分类和分期依据WHO(2019)结直肠癌分类中的诊断指南进行。
人结直肠癌细胞株SW480、SW620、RKO和LOVO均购自美国ATCC公司,并保存于分子病理实验室;293T细胞株由新乡医学院法医系熊熙文博士惠赠。这些细胞株均使用DMEM(购自美国Gibco公司)培养基,置于5%CO237 ℃恒温箱中常规培养,培养基包括10%胎牛血清、100 U/mL青霉素和10 mg/mL链霉素。
1.1.2主要试剂 PPAPDC1A多克隆抗体购自美国Abcam公司;DAB显色剂购自北京中杉金桥公司;TRIzol试剂盒购自日本Takara公司;Lipofectamine 2000购自美国Invitrogen公司。
1.2 方法
1.2.1免疫组化 先将切片在10 mmol/L柠檬酸盐缓冲液(pH 6.0)中热屏蔽,随后滴加适量的封闭液,在室温下处理切片10 min;然后用含5%正常山羊血清的PBS缓冲液阻断20 min;再滴加适量一抗(稀释比为1 ∶50),并完全覆盖组织,玻片在4 ℃下孵育过夜。将切片与二抗在37 ℃下孵育15 min后,采用免疫组化SP法染色滴加DAB显色剂观察抗原-抗体结合情况,并酌情终止,用标准苏木精染色切片。由病理医师对HE切片进行半定量评估染色强度。
1.2.2PPAPDC1A过表达和干扰细胞系的建立 为建立PPAPDC1A过表达细胞株,按照制造商提供的操作方法,将PPAPDC1A的整体长度克隆到逆转录病毒pLVX-puro中,使用Lipofectamine 2000将pLVX-PPAPDC1A与包装质粒共同转染到293T细胞株中。转染48 h后,用0.45 μm滤膜孔径的滤器过滤细胞培养上清液。将结直肠癌待转染细胞系与含有polybrene(5 μg/mL)的病毒上清液孵育48 h。用1 μg/mL嘌呤霉素筛选阳性细胞。稳定干扰病毒Lentiviral Vector-PPAPDC1A-RNAi和阴性对照病毒Hu6-MCS-Ubiquitin-EGFP-IRES-puromycin由上海吉凯公司制备。待感染细胞感染48 h后,嘌呤霉素筛选阳性细胞,扩大培养后使用qRT-PCR和Western blot法进行鉴定。
1.2.3qRT-PCR检测 收集适量处于对数生长期细胞,采用TRIzol法提取总RNA,用核酸蛋白测定仪检测RNA浓度,逆转录试剂盒合成cDNA。qRT-PCR反应体系为20 μL,包括SYBR Premix染料10 μL,ROX Reference染料0.4 μL,双蒸水0.8 μL,上游引物2 μL,下游引物6 μL,cDNA模板0.8 μL。反应条件:95 ℃ 30 s、95 ℃ 5s、60 ℃ 30 s,合计40个循环。以2-△△Ct表示实验组与对照组中目的基因和内参基因的表达,实验重复3次。PPAPDC1引物序列:上游5′-TAATAGTGGGAAGACCTCGC-3′;下游5′-GGTCACCTGTGCAATGCATT-3′;GAPDH引物序列:上游5′-AGAAGGCTGGGGCTCATTTG-3′;下游5′-AGGGGCCATCCACAGTCTTC-3′。
1.2.4CCK-8实验 将每孔1×103个细胞接种于96孔板中进行预培养,分别在培养的1~7天内,用每孔10 μL的CCK-8试剂孵育1 h。用酶标仪测定450 nm波长处的吸光值。
1.2.5平板克隆形成实验 在含2 mL 37 ℃预培养液的6孔板中每孔接种50个细胞。培养箱中培养3周后,弃去培养基,经10%中性福尔马林固定15 min,去除固定液,结晶紫染色30 min,流水冲洗后空气干燥,显微镜下计算菌落数量。
1.2.6细胞划痕实验 在6孔板中培养细胞,待细胞长至70%左右时,用1 μL灭菌后枪头水平、垂直“十字”划线。清洗表面悬浮细胞,更换无血清DMEM培养液,放入37 ℃ 5%CO2培养箱中培养。在划痕后0、24、48 h观察同一位置细胞向划痕区域的迁移情况。
1.2.7Transwell实验 在包被有基质胶的上、下小室内分别加入300 μL无血清培养基,37 ℃孵箱中孵育2 h。随后在下室加入500 μL完全培养基,将200 μL密度为每毫升1×104个细胞的细胞悬液加入上室中。常规培养12~48 h后,刮去上室未迁移的细胞,迁移的细胞在小室的底部,经10%中性福尔马林固定,结晶紫染色20 min。显微镜下计数侵袭的细胞数量。
1.2.8裸鼠皮下成瘤和裸鼠尾静脉注射实验 将4~6周大的BALB/c无胸腺裸鼠皮下注射5×106个细胞(每组8只),在注射后的7、14、28天测量肿瘤大小,肿瘤体积(V)的测定方法如下:V=[长+(宽)2]/2。4周后颈椎脱臼法处死裸鼠,取出肿瘤组织。将4×106个细胞通过尾静脉注射的方法注入4~6周龄的裸鼠体内(每组10只),SPF级环境下饲养2个月后将裸鼠处死,取出整个肺部组织进行固定,并在显微镜下计数HE染色后病理切片中肿瘤转移灶的数量。

2 结果
2.1 结直肠癌组织中PPAPDC1A的表达免疫组化结果显示,PPAPDC1A表达主要定位于细胞膜和部分细胞质。60例中PPAPDC1A高表达44例(73.3%,表1),低表达16例(26.7%)。与癌旁正常组织相比,PPAPDC1A蛋白在结直肠癌组织中的表达强度明显升高。相关性分析结果显示,PPAPDC1A表达与患者年龄、性别、肿瘤大小、淋巴结转移均无关;与肿瘤分化程度相关,肿瘤分化程度越低,PPAPDC1A蛋白表达强度则越强(P=0.011,表1)。

表1 PPAPDC1A表达与结直肠癌临床病理特征的关系
2.2 结直肠癌细胞中PPAPDC1A的转染效率qRT-PCR和Western blot结果显示,在SW480和RKO细胞中转染PPAPDC1A过表达质粒后,结直肠癌细胞中PPAPDC1A蛋白(SW480、RKO组:0.42、0.21;SW480-Vector、RKO-Vector组:0.39、0.18;SW480-PPAPDC1A、RKO-PPAPDC1A组:1.29、0.46)和mRNA(SW480、RKO组:0.08、1.00;SW480-Vector、RKO-Vector组:0.01、0.91;SW480-PPAPDC1A、RKO-PPAPDC1A组:645.20、173.60)的表达水平明显升高(P<0.05)。转染干扰片段后,结直肠癌细胞中PPAPDC1A蛋白(SW620、LOVO组:0.65、0.58;SW620-NC、LOVO-NC组:0.85、0.57;SW620-shPPAPDC1A、LOVO-shPPAPDC1A组:0.35、0.35)和mRNA(SW620、LOVO组:1.84、2.24;SW620-NC、LOVO-NC组:2.57、2.42;SW620-shPPAPDC1A、LOVO-shPPAPDC1A组:0.22、0.18)的水平均降低(P<0.05)。以上结果表明,已成功构建稳定过表达和稳定干扰细胞株(图1)。
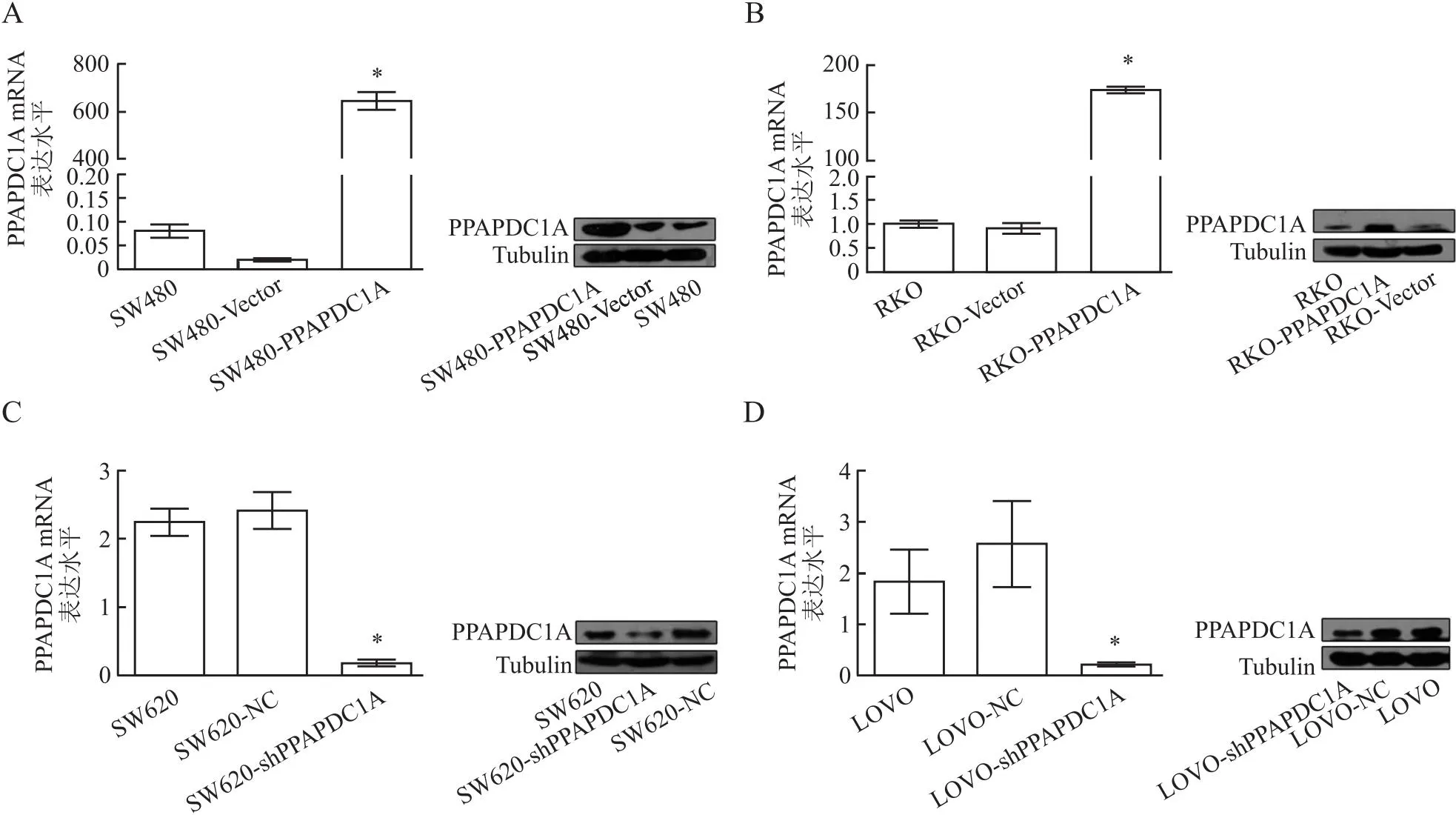
图1 qRT-PCR和Western blot法检测PPAPDC1A在SW480(A)和RKO(B)细胞中的稳定过表达效率,以及在SW620(C)和LOVO(D)细胞中的干扰效率;与Vector/NC组相比,*P<0.05
2.3 PPAPDC1A对结直肠癌细胞体外增殖能力的影响CCK-8实验结果表明,与SW480(0.27±0.04)/RKO(0.16±0.01)组和SW480-Vector(0.26±0)/RKO-Vector(0.09±0)组相比,SW480-PPAPDC1A(0.38±0.03)/RKO-PPAPDC1A(0.25±0.01)组细胞株培养96 h后,OD值明显上升(P<0.05,图2A)。与SW620(0.25±0)/LOVO(0.27±0.05)组和SW620-NC(0.23±0)/LOVO-NC(0.23±0.02)组相比,SW620-shPPAPDC1A(0.14±0.02)/LOVO-shPPAPDC1A(0.16±0.05)组细胞株培养96 h后,OD值明显下降(P<0.05,图2A)。平板克隆形成实验显示,与SW480-Vector(47.00±2.64)/RKO-Vector(65.00±1.73)组相比,SW480-PPAPDC1A(174.33±5.03)/RKO-PPAPDC1A(245.00±7.00)组细胞克隆形成数明显增多(P<0.05,图2B);与SW620-NC(66.00±1.00)/LOVO-NC(23.00±1.00)组相比,SW620-shPPAPDC1A(28.33±1.52)/LOVO-shPPAPDC1A(8.67±0.57)组细胞克隆形成数明显减少(P<0.05,图2B)。
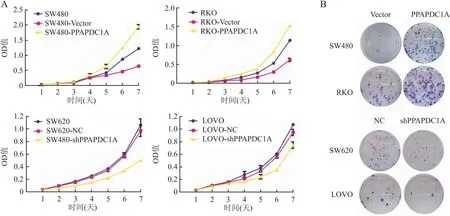
图2 CCK-8实验(A)及平板克隆实验(B)检测PPAPDC1A稳定过表达和干扰对结直肠癌细胞增殖能力的影响
2.4 PPAPDC1A对结直肠癌细胞体内增殖能力的影响裸鼠皮下成瘤实验显示,与Vector组(2.11±0.76)相比,RKO-PPAPDC1A组(4.16±0.91)裸鼠体内形成肿瘤的体积更大(P<0.05,图3A);与NC组(1.11±0.21)相比,LOVO-shPPAPDC1A组(0.56±0.21)的裸鼠肿瘤体积明显较小(P<0.05,图3B)。免疫组化结果显示,Ki67增殖指数在过表达组升高(Vector组:54%,RKO-PPAPDC1A组:91%,P<0.05,图4A),而在干扰组降低(NC组:74%,LOVO-shPPAPDC1A组:26%,P<0.05,图4B)。上述结果表明,PPAPDC1A下调可以有效减弱结直肠癌细胞的增殖能力。
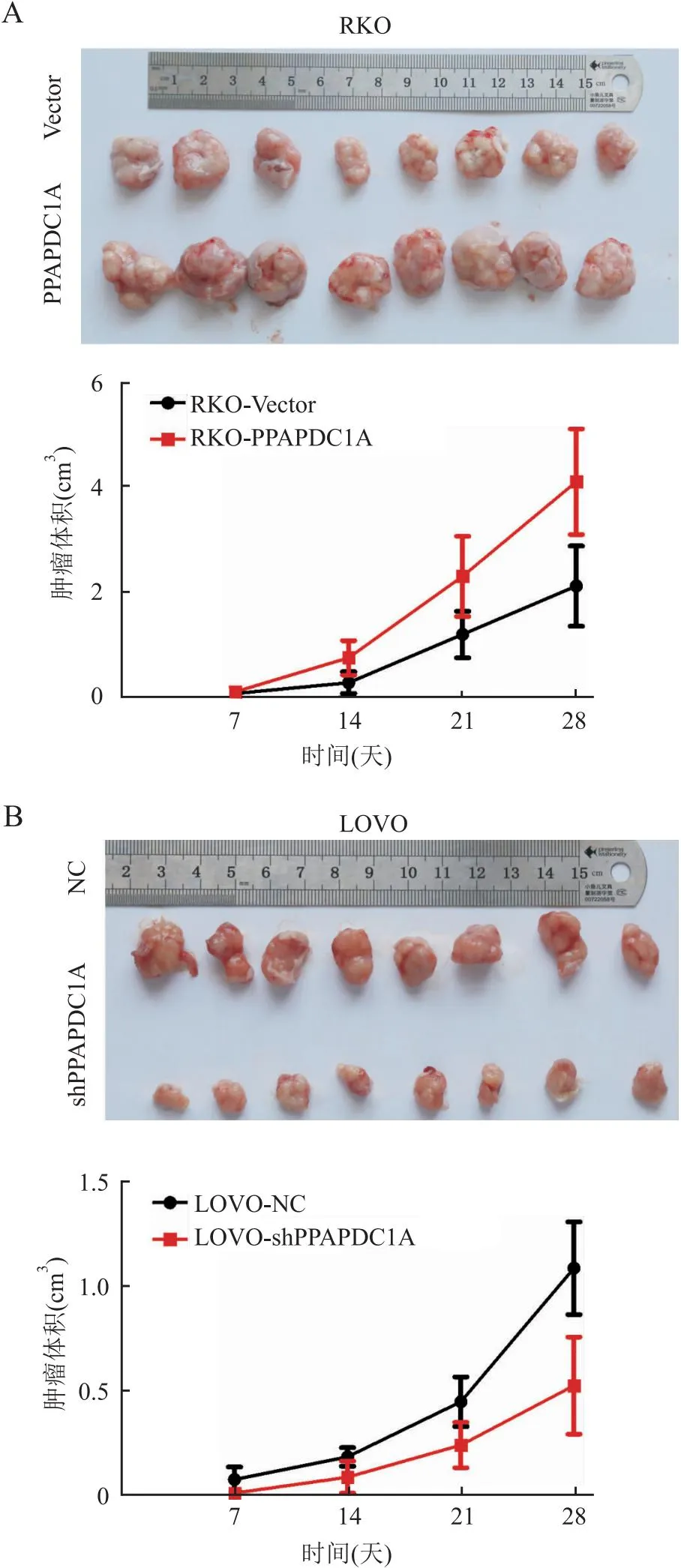
图3 裸鼠皮下成瘤实验中稳定过表达(A)和干扰(B)PPAPDC1A对肿瘤生长的影响

图4 HE染色和免疫组化染色显示裸鼠皮下肿瘤组织中
2.5 PPAPDC1A对结直肠癌细胞体外迁移、侵袭能力的影响划痕愈合实验显示,与对照组相比,过表达组显著增强了RKO和SW480细胞的迁移能力(SW480-Vector、RKO-Vector组:65.90%、72.55%;SW480-PPAPDC1A、RKO-PPAPDC1A组:79.99%、98.16%)(P<0.05,图5A),稳定干扰组的LOVO和SW620细胞迁移能力减弱((SW620-NC、LOVO-NC组:16.27%、42.36%,SW620-shPPAPDC1A、LOVO-shPPAPDC1A组:7.90%、16.96%)(P<0.05,图5B)。Transwell实验结果表明,与对照组相比,PPAPDC1A过表达的细胞株穿透人工基膜的数量明显增加(SW480-Vector、RKO-Vector组:90.66±3.05、14.00±0;SW480-PPAPDC1A、RKO-PPAPDC1A组:218.33±7.09、96.33±1.52),侵袭能力明显的增强(P<0.05,图5C);而稳定干扰组则相反,PPAPDC1A干扰组的细胞株侵袭数量大大减少(SW620-NC、LOVO-NC组:65.67±0.57、66.33±2.51,SW620-shPPAPDC1A、LOVO-shPPAPDC1A组:13.33±0.57、18.33±0.51)(P<0.05,图5D)。

图5 划痕实验检测PPAPDC1A稳定过表达(A)和干扰(B)对结直肠癌细胞迁移能力的影响;Transwell实验检测PPAPDC1A稳定过表达(C)和干扰(D)对结直肠癌细胞侵袭能力的影响
2.6 PPAPDC1A对结直肠癌细胞体外肺转移能力的影响裸鼠尾静脉注射实验结果显示,RKO-Vector、RKO-PPAPDC1A、LOVO-NC和LOVO-shPPAPDC1A裸鼠的肺部转移灶数目分别为1.1±1.85、5.1±3.84、4.6±2.17、1.2±1.03。与对照组相比,PPAPDC1A过表达组的肺部转移灶数量明显增加(P<0.05,图6A);而干扰组转移灶数目则显著减少(P<0.01,图6B)。结果表明,下调PPAPDC1A的表达可以抑制高转移结直肠癌细胞株的肺转移能力。

图6 尾静脉注射实验检测PPAPDC1A稳定过表达(A)和干扰(B)对结直肠癌细胞体内肺转移能力的影响
3 讨论
PAP对磷脂酸盐进行去磷酸化,形成二酰甘油和无机磷酸盐[9]。PAP酶有两种形式,PAP1(Mg2+依赖型)和PAP2(Mg2+非依赖型)[10],这些酶主要参与细胞脂质信号传导,特别是在酵母和哺乳动物细胞中[11]。PAP2蛋白由酵母中的LPP1和DPP1基因编码。与酵母DPP1蛋白相比,DPPL1和DPPL2蛋白均表现出广泛的底物特异性。研究表明,磷酸酶可作为细胞信号传导的激活剂,并可能在致癌过程中发挥重要作用[12]。最新研究结果显示,PPAPDC1A介导细胞内Ca2+升高,通过促进细胞周期的进展,诱导肺癌增殖和肿瘤的发生,PPAPDC1A高表达与肺癌患者的晚期临床病理特征呈正相关,并与肺癌患者的低生存率密切相关。PPAPDC1A除了促进肿瘤进展外,还有助于上皮-间充质转化[13]。此外,PPAPDC1A被认为是促进卵巢癌患者肠道转移的关键基因之一[14],但其在结直肠癌发生中的功能尚未得到阐述。因此,本研究分析了PPAPDC1A在结直肠癌中的表达情况。
磷酸酶PPAPDC1B和PTP1B,被认为是癌症、糖尿病和肥胖症的治疗靶点[15]。PPAPDC1B在胰腺癌、肺癌和乳腺癌中表达升高[16]。磷酸酶PTP1B在结直肠癌细胞株和组织中表达升高,其在结直肠癌细胞株中表达沉默可降低细胞的侵袭、迁移和增殖能力[17]。脂质磷酸酶3(LPP3;PPAP2B)是磷酸酶家族的一员。PPAP2B作为一种去磷酸化的跨膜蛋白,通过增加β-catenin的稳定性和CYCLIN-D1的合成来促进肿瘤的生长[18-19],并在人类结直肠癌SW480细胞株中表达升高。如上所述,磷酸酶在癌症发病机制中起至关重要的作用。研究发现,PVT1-PPAPDC1A融合基因存在于胃癌细胞系中,同时TACC2-PPAPDC1A融合基因在弥漫性胃癌患者中表达升高,可能是由于TACC2启动子驱动,导致PPAPDC1A的过表达,并促进了胃癌患者的转移和复发,并且多种与PPAPDC1A相关的融合基因均与胃癌患者的预后存在密切的关系[20]。本实验随后建立了PPAPDC1A稳定过表达和干扰细胞系,通过CCK-8、平板克隆形成、裸鼠皮下成瘤、Transwell、细胞划痕和裸鼠尾静脉注射等实验,检测了实验组和对照组对结直肠癌细胞株的影响。
综上所述,PPAPDC1A在结直肠癌组织及细胞株中表达上调,在高转移潜能细胞株中表达尤为明显。下调PPAPDC1A的表达,可以明显抑制结直肠癌细胞在体内和体外的增殖、侵袭、迁移和转移能力,提示该基因可能与结直肠癌转移及预后不良密切相关,并可以作为结直肠癌患者治疗的相关靶点。PPAPDC1A在结直肠癌进展中的分子机制仍需进一步分析。

