基于生物信息技术筛选肝硬化铁死亡相关差异基因与中药预测研究
王雅欣,刘汶,吴颖,宋思琦,刘颖初,宋瑾,3,张会存,3
1. 首都医科大学附属北京中医医院,北京 100010 2. 北京中医药大学,北京 100029 3. 北京市中医药研究所,北京 100010
肝硬化是病毒、饮酒、自身免疫疾病和化学毒物刺激等因素对肝脏长期影响而引起的一种进行性慢性肝病。肝硬化发展过程中患者常会出现腹水、感染、肝性脑病、肝肾综合征和癌症等并发症,严重危害患者健康[1-2]。中西医结合治疗被认为是控制肝硬化发生发展的有效途径之一,明确肝硬化发生机制,针对相关的基因靶点挖掘潜在的治疗中药,对肝硬化的临床诊断及治疗具有重大意义[3]。
铁死亡是一种铁依赖性的脂质过氧化所致的新型的程序性细胞死亡形式。大量研究表明,铁死亡与慢性肝脏疾病的发生发展有着密切的联系,多种中药成分被证明可以通过诱导肝星状细胞铁死亡抑制肝纤维化来达到治疗肝硬化的目的[4-7]。本研究利用生物信息技术筛选肝硬化铁死亡相关差异基因,并预测具有潜在治疗作用的中药及有效成分,为临床通过诱导铁死亡途径治疗肝硬化提供新思路。
1 材料与方法
1.1 数据获取利用美国国立生物技术信息中心平台下的基因表达综合数据库(GEO)(http://www.ncbi.nim.nih. gov/geo/)获取肝硬化相关基因数据集,将样本量大于20,同时包含正常样本和疾病样本作为筛选条件[8]。选取的数据集编号为GSE77627,该数据集包含36 例样本,其中22 例为肝硬化患者样本,14 例为对照组样本[9]。以|log2FC|≥1,校正后P值<0.05 作为筛选条件,使用R 软件对该数据集进行差异化分析,获取肝硬化差异表达基因集(DEGs),并通过R 语言绘制热图及火山图[10]。利用FerrDb 数据库(http://www.zhounan.org/ferrdb/current/)收集铁死亡相关基因(FRGs),取DEGs 和FRGs 交集,得到与铁死亡相关的肝硬化差异表达基因。
1.2 蛋白质互作(PPI)网络分析将肝硬化中铁死亡相关的差异表达基因导入STRING 数据库(https://cn. string-db. org/)进行 PPI 网络分析, 采用Cytoscape3.8.0 软件将结果进行可视化; 利用cytohubba 插件中的最大集团中心性(MCC)算法进行核心基因筛选,得分排前5 的基因作为核心基因[11]。
1.3 富集分析利用Metascape 数据库(http://metascape.org/)进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)通路富集分析,其中GO 富集分析包括分子功能(MF)、细胞成分(CC)、生物过程(BP)分析,通过在线工具将富集分析结果进行可视化。为了进一步了解核心基因与铁死亡的相关性,将基因芯片样本按核心基因表达量中位数分为高表达组和低表达组,以“WP_FERROPTOSIS 基因集”作为背景,通过GSEA4.3.2 软件采用默认加权富集法,设置随机组合次数1 000 次,以校正P值<0.05,|NES |>1 作为阈值条件对核心基因进行基因集富集分析(GSEA)[12]。
1.4 中药及成分预测利用Coremine Medical 数据库(https://coremine.com/medical/#search)搜集核心基因对应的中药,通过中药系统药理学数据库与分析平台(TCMSP)(http://tcmspw. com/tcmsp.php)以口服生物利用度(OB)≥30%,类药性(DL)≥0.18 为条件进行有效活性成分筛选[13]。借助Cytoscape3.8.0 软件构建核心中药-活性成分网络图,根据degree 值由高到低进行排序,筛选出degree 值排名前4 位的活性成分作为核心活性成分。
1.5 分子对接验证利用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov)获得核心活性成分3D 结构文件,通过PDB 数据库(https://www.rcsb.org)获得核心基因的3D 结构文件,采用Autodock Vina 软件将核心活性成分和核心基因进行分子对接。利用Pymol 软件将分子对接结果进行可视化。
2 结果
2.1 肝硬化铁死亡相关差异表达分析结果见图1、图2。利用R 软件对GSE77627 基因芯片数据集进行基因差异表达分析,共获得3 675 个DEGs,包括2 301 个上调基因和1 374 个下调基因,将结果绘制为火山图,对上下调最大的5 个基因进行标注,将差异表达最大的20 个基因绘制基因热图。在FerrDb数据库中获得483 个FRGs。将DEGs 和FRGs 基因取交集,共得到67 个与肝硬化铁死亡相关差异表达基因。
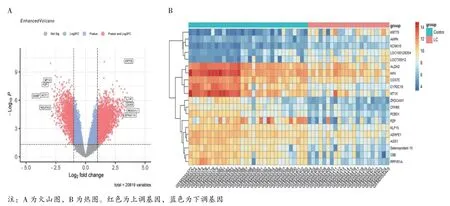
图1 肝硬化铁死亡相关差异表达基因分析图
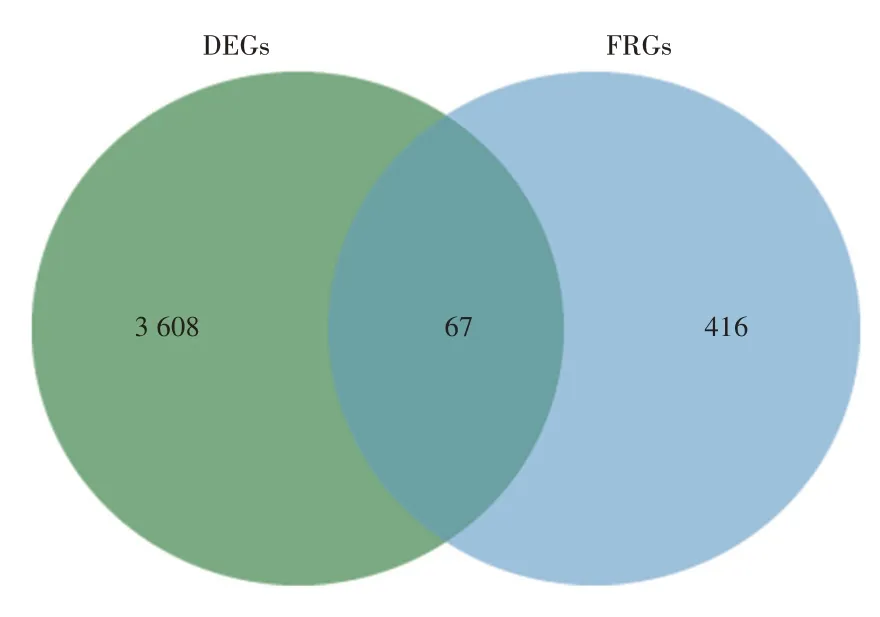
图2 肝硬化差异表达基因和铁死亡相关基因韦恩图
2.2 PPI 网络分析及核心基因获取结果见图3。将67 个基因导入STRING 数据库进行PPI 网络分析,结果导入Cytoscape3.8.0 软件进行可视化,颜色越深代表与该基因靶点相互作用的靶点数量越多。通过cytohubba 插件中MCC 算法确定核心基因,排名前5的核心基因分别为沉默信息调节因子1(SIRT1)、表皮生长因子受体(EGFR)、白细胞介素6(IL-6)、过氧化物酶体增殖活化受体α(PPARα)和核因子红细胞2 相关因子2(NFE2L2)。

图3 PPI 网络分析图与核心基因网络图
2.3 富集分析结果见图4、图5。对67 个基因进行GO 和KEGG 通路富集分析,将KEGG 通路富集分析结果绘制为气泡图,将GO 分析中的MF、BP、CC 结果绘制为条形图。结果显示,主要KEGG 通路包括p53 信号通路、谷胱甘肽代谢、FoxO 信号通路等。GO 分析富集的MF 包括RNA 结合、蛋白磷酸结合、磷酸酶结合等;BP 包括单体代谢过程、细胞对压力的反应、含磷化合物代谢过程等;CC 包括胞质溶胶、细胞器内腔、膜封闭腔等。
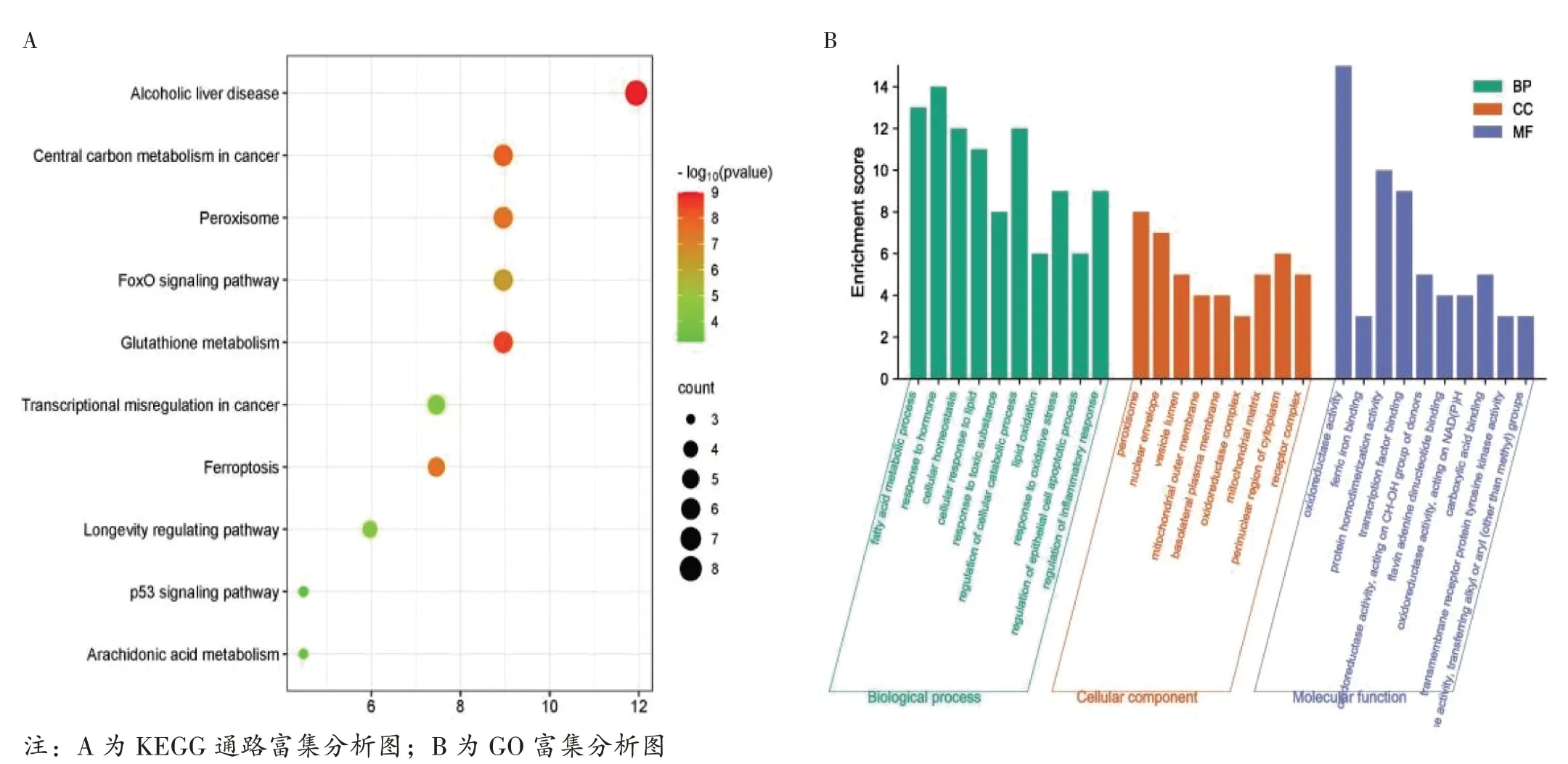
图4 GO 及KEGG 通路富集分析图
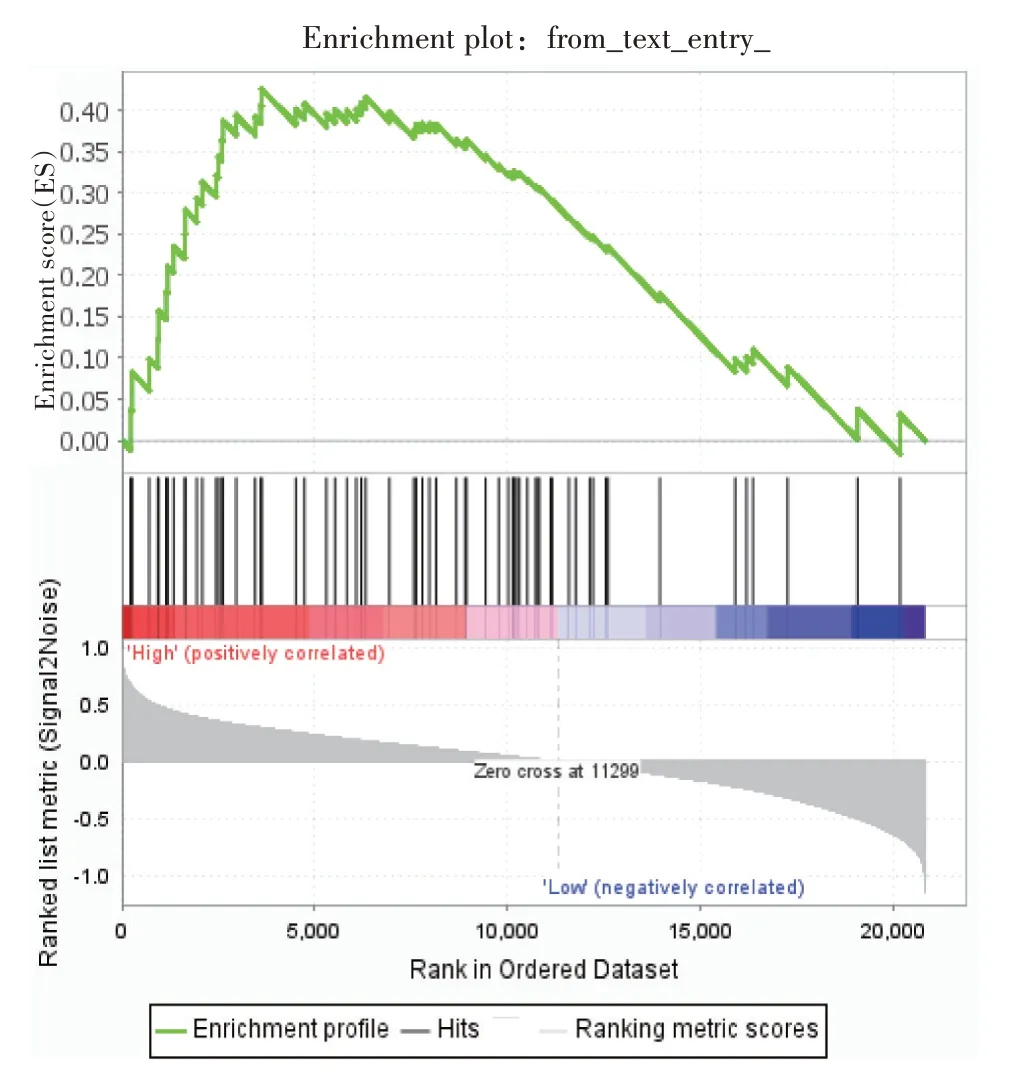
图5 GSEA 富集分析结果图
为了进一步了解核心基因在肝硬化患者中表达,且与铁死亡的相关性,用GSEA4.3.2 软件进行GSEA富集分析。富集结果显示,核心基因NES>1.78,P<0.01,提示核心基因在铁死亡通路中高度富集,进一步验证了核心基因与铁死亡通路密切相关。
2.4 潜在中药及成分预测见表1、图6。将核心基因导入Coremine Medical 数据库,得到核心基因对应的中药。将上述中药取交集,得到核心基因的共有中药17 味,包括丹参、枸杞子、黄芩、赤芍、银杏叶、人参、红花、白果、大黄、黄连、人参叶、乌梅、石榴皮、生姜、干姜、姜黄、厚朴,其中degree值排名前4 位的分别是丹参、枸杞子、黄芩、赤芍。通过TCMSP 收集得到271 个活性成分,利用Cytoscape3.8.0 软件构建核心中药-活性成分网络图,将degree 值排名前4 位的活性成分确定为核心活性成分,分别为β-谷甾醇、豆甾醇、槲皮素、山柰酚。
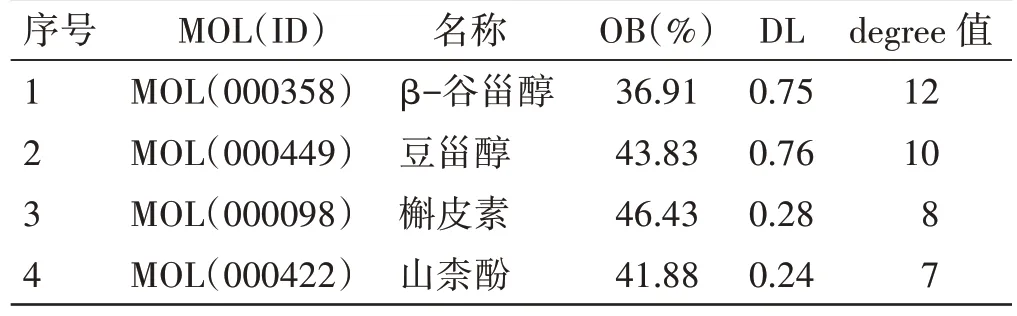
表1 核心活性成分

图6 核心中药-活性成分网络
2.5 分子对接验证结果一般认为化合物和靶点结合能<0,提示两者可自发结合,结合能越低,配体和受体结合越稳定,发生作用的可能性越大[14]。见表2、图7。利用Autodock Vina 将4 个核心活性成分与5 个核心基因进行分子对接,使用PyMol 软件对分子对接结合能排前4 位分子对接结果进行可视化。结果显示,β-谷甾醇、豆甾醇、槲皮素、山柰酚与SIRT1、EGFR、IL-6、PPARα、NFE2L2 的结合能均<0。
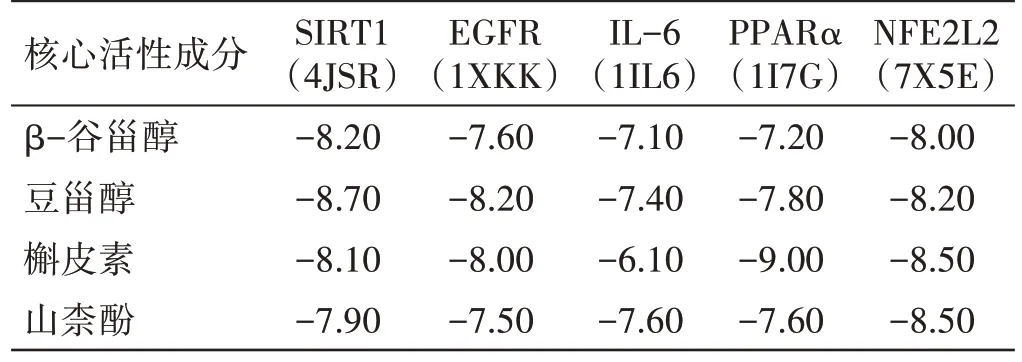
表2 核心活性成分与核心靶点分子对接结果 kcal/mol

图7 核心成分与核心基因靶点分子对接示意图
3 讨论
肝硬化是以广泛性肝细胞变性坏死、结节性再生、肝脏弥漫性纤维化伴肝小叶结构破坏和假小叶形成为特征的慢性肝脏疾病[15]。本研究通过生物信息技术筛选得到5 个核心基因分别为SIRT1、EGFR、IL-6、PPARα 和NFE2L2。SIRT1 是一种组蛋白去乙酰化酶,参与调节多种生物学功能,在肝星状细胞活化和肝纤维化的过程中起着关键作用。SIRT1 介导的SIRT1/核因子E2 相关因子2(NRF2)/血红素加氧酶1(HO-1)途径是调控铁死亡的关键途径之一,研究发现干预SIRT1/NRF2/HO-1 途径能够抑制铁死亡,减轻药物诱导的急性肝损伤[16]。SIRT1 可以通过诱导肝星状细胞铁死亡阻断肝星状细胞活化[17]。EGFR 是一种Ⅰ型跨膜糖蛋白,为重要的信号通路受体,其介导的信号转导途径是肝再生过程中最主要的信号通路之一,和肿瘤的发生、发展关系紧密。研究发现通过促进泛素化介导的EGFR 降解和加速细胞内内涵体运输能抑制EGFR 活化,可以增强索拉非尼诱导的肝癌细胞铁死亡[18]。IL-6 是由多种细胞合成的促炎细胞因子,临床上发现慢性乙型肝炎患者血清中IL-6 水平异常升高;实验研究也发现通过抑制IL-6 等促炎细胞因子的释放,可以抑制铁死亡诱导的肝细胞损伤[19]。PPARα 是一种过氧化物酶体增殖活化受体,研究发现PPARα 可以通过调控谷胱甘肽过氧化物酶4(GPX4)及转铁蛋白(TRF)来减轻肝脏中的铁死亡[20]。同时本研究团队前期实验研究发现调肝祛脂方可以提高SIRT1/PPARα 表达来改善非酒精性脂肪肝大鼠肝功能,减轻非酒精性脂肪肝肝脏细胞变性[21]。NFE2L2 是一种转录因子,是响应氧化损伤的内源性细胞防御机制中的重要因子,参与细胞内稳态的恢复过程。NFE2L2 在研究中被发现可以抑制铁死亡,在调控细胞铁死亡中起到重要作用[22]。上述结果表明,核心基因SIRT1、EGFR、IL-6、PPARα 和NFE2L2 可能是治疗肝硬化的潜在靶点。
本研究通过KEGG 通路分析发现上述基因参与的信号通路包括p53 信号通路、谷胱甘肽代谢、FoxO 信号通路等。FoxO 信号通路与SIRT1 通路密切相关,研究发现FoxO 信号通路可以通过自噬、细胞凋亡和脱铁途径以减少氧化应激损伤[23-24]。谷胱甘肽代谢是铁死亡的关键途径,谷胱甘肽耗竭,脂质氧化物不能经GPX4 催化的还原反应代谢,继而二价铁离子氧化脂质产生大量活性氧簇,促使细胞发生铁死亡[25]。P53 可以调控胱氨酸-谷氨酸反向转运体抑制GSH 合成,从而诱导铁死亡[26]。GSEA 结果发现,核心基因在铁死亡通路中高度富集。上述研究结果表明p53 信号通路、谷胱甘肽代谢、FoxO 信号通路等可能调控铁死亡途径治疗肝硬化。
通过Coremine Medical 数据库预测得到17 种中药,其中排名前4 的中药为丹参、枸杞子、黄芩和赤芍。刘汶教授认为肝硬化本质为气机升降失常、气血运行不畅,常用丹参、枸杞子等药物组成养血活血方治疗,常取得良好疗效[27]。临床研究发现,应用恩替卡韦、丹参联合螺内酯治疗乙肝后肝硬化腹水可以提升整体治疗疗效[28]。仝小林院士认为肝硬化早期病机以瘀阻血络为主,治疗应以活血化瘀、软坚散结为总则,临床应用丹参、赤芍、醋鳖甲组成的三味小方,在此基础上加减化裁治疗肝硬化,可取得良好的疗效[29]。既往研究发现,枸杞子通过抗氧化还原反应,对于肝损伤具有明显的保护作用[30]。黄芩-赤芍能通过抑制Toll 样受体4/髓样分化因子88/核转录因子-κB(TLR4/MyD88/NF-κB)和磷脂酰肌醇3-激酶/蛋白激酶B/哺乳类动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路的表达来抑制肝纤维化的发展,从而缓解药物引起的肝损伤[31]。本研究得到β-谷甾醇、豆甾醇、槲皮素、山柰酚核心活性成分可能是通过调控铁死亡治疗肝硬化的有效活性成分。β-谷甾醇存在于黄芩、枸杞子及赤芍等药物中,研究发现其可以减轻四氯化碳诱导大鼠的氧化应激和慢性肝损伤[32];研究发现黄芩可以调控铁死亡逆转肿瘤细胞耐药,而其中的β-谷甾醇可能是主要有效成分之一[32]。豆甾醇存在于黄芩、枸杞子及赤芍等药物中,目前研究豆甾醇调控铁死亡治疗肝硬化的实验研究较少。生物信息研究显示,豆甾醇可以通过调控铁死亡治疗非酒精性脂肪性肝炎,含有豆甾醇的中药具有抑制肝纤维化的作用[33]。槲皮素是一种重要的黄酮类化合物,广泛存在于多种植物中,其可以通过调节肝星状细胞活化来减少肝纤维化[34]。已有研究证明槲皮素可以通过减少活性氧、脂质过氧化物和铁过载来抑制铁死亡,从而控制非酒精性脂肪性肝病的发展[35]。山柰酚属于黄酮类化合物的一种,研究显示山奈酚与铁死亡关系密切,山柰酚可以通过NRF2 通路激活抑制肝细胞铁死亡,能够预防对乙酰氨基酚诱导的肝损伤[36]。分子对接结果显示,核心活性成分与靶点之间具有良好的结合性,进一步验证了上述分析结果。本研究虽然利用生物信息及分子对接技术对潜在具有治疗作用的中药及成分进行了分析预测,但是由于生物信息分析的局限性,未来需要构建实验进一步验证。
综上所述,丹参、枸杞子、黄芩和赤芍等中药所含的成分可以通过SIRT1、EGFR、IL6、PPARα和NFE2L2 等靶点治疗肝硬化,其作用机制可能与p53 信号通路、谷胱甘肽代谢、FoxO 等信号通路调控铁死亡有关。

