艾司洛尔联合阿托伐他汀对严重脓毒症合并心功能不全的临床疗效分析
曹家军,熊 盟,尚晶晶,罗 艳,舒艾娅
(重庆大学附属涪陵医院重症医学科,重庆 408000)
脓毒症是机体对感染产生的持久、失控的全身炎症反应综合征,其预后较差,患者若未能接受有效诊治,可能影响心、肝、肾等多个脏器功能,甚至危及生命,死亡率可高达25.0%。心脏是脓毒症较常累及的器官,超过一半的患者伴有不同程度的心功能不全,表现为心输出量降低、心率过快等,具体机制尚未完全清楚[1-2],可能与促炎/抗炎平衡失调、神经交感神经应激、细菌毒素、氧化应激等有关,其诊治也一直是临床关注的焦点[3-7]。对于脓毒症合并心功能不全患者,既往临床上主要采用β受体兴奋剂类正性肌力药物进行治疗,而β受体阻滞剂因能抑制心肌收缩与血压水平,并不推荐应用。近年来,有研究表明艾司洛尔等β受体阻滞剂可通过抑制儿茶酚胺类物质的释放来发挥抑制交感神经过度兴奋的作用,改善心肌抑制和心功能不全,从而改善脓毒症患者的预后[8-11]。阿托伐他汀是一种选择性3-羟基-3-甲基戊二酸单酰辅酶A还原酶抑制剂,除了具有降脂作用外,还有抗炎、抗氧化、改善血管内皮功能和凝血功能等功效,具有一定的心肌保护作用,临床应用广泛[12-14],但其与艾司洛尔在严重脓毒症合并心功能不全患者的联用效果尚不清楚。本研究旨在探讨艾司洛尔联合阿托伐他汀对患者血清炎症因子与心肌酶谱的影响,为临床提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料
本研究为前瞻性、双盲、随机对照临床试验。选取2021年1月至2022年12月本院收治的153例严重脓毒症合并心功能不全患者为研究对象。纳入标准:(1)符合国际Sepsis 3.0脓毒症诊断标准[15];(2)根据患者的病史、临床症状、体征(如循环淤血表现)、辅助检查判断存在心功能不全,包括呼吸困难、乏力、肺部啰音、颈静脉征、心脏奔马律、B型钠尿肽升高等;(3)临床资料完整可靠。排除标准:(1)脓毒症发生前已存在先天性心脏病、急性心肌梗死、原发性心肌病、代谢性心肌病、心肌炎等器质性心脏病者;(2)合并窦性心律过缓、哮喘、Ⅱ~Ⅲ度房室传导阻滞或其他对本研究用药有禁忌证者;(3)合并肝、肾、肺等脏器的严重原发性疾病或恶性肿瘤者;(4)对阿托伐他汀、艾司洛尔过敏者或有过敏体质者。全部患者均自愿参加本研究,已签署知情同意书。本研究符合医学伦理学原则,研究方案已通过本院医学伦理委员会的批准。采用随机数字表法将患者分为A、B、C组,各51例,3组患者的性别、年龄、BMI、原发病分布、急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分等基线资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
1.2 方法
1.2.1治疗方法
A组患者入院后均依据《中国严重脓毒症/脓毒性休克治疗指南(2014)》[16]给予抗炎、早期积极的液体复苏、血管活性药物、吸氧或机械通气等对症支持治疗。在A组治疗方案的基础上,B组患者给予盐酸艾司洛尔注射液(济南齐鲁制药有限公司,国药准字H19991059),首先静脉注射200 mg,然后以0.02 mg·kg-1·min-1微泵输注,维持3 d。在B组治疗方案的基础上,C组患者加用阿托伐他汀钙片(辉瑞制药有限公司,国药准字H20051408)口服,10 mg/次,1次/d。在研究期间,患者及主管医师均不清楚患者所属组别,仅研究组织者知晓。并且,A组患者给予静脉滴注与盐酸艾司洛尔同体积的生理盐水注射液,同时口服与阿托伐他汀钙片外形相似的淀粉片进行安慰剂对照;B组患者给予口服淀粉片进行安慰剂对照。
1.2.2观察指标
在干预前及干预5 d后,记录全部患者的心率、平均动脉压(mean arterial pressure,MAP)、心脏指数(cardiac index,CI)、体循环阻力指数(systemic vascular resistance index,SVRI)等血流动力学指标,同时采用全自动生化分析仪及配套试剂检测空腹静脉血的肌酸激酶同工酶(creatine kinase-MB,CK-MB)、心肌肌钙蛋白Ⅰ(cardiac troponin Ⅰ,cTnⅠ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、超敏C-反应蛋白(high sensitive C-reactive protein,hs-CRP)等水平。记录干预前及干预后5 d的APACHE Ⅱ评分,以及重症监护室(intensive care unit,ICU)住院时间、28 d死亡率等预后情况。
1.3 统计学处理
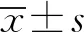
2 结 果
2.1 3组干预前后血流动力学指标比较
3组干预前心率、MAP、CI、SVRI比较,差异均无统计学意义(P>0.05)。组内比较:3组干预5 d后心率、SVRI均低于干预前,CI均高于干预前,差异有统计学意义(P<0.05)。组间比较:干预5 d后,C组心率、SVRI均低于A组与B组,且B组低于A组;C组CI高于A组与B组,且B组高于A组,差异均有统计学意义(P<0.05),见表2。
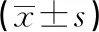
表2 3组干预前后血流动力学指标比较
2.2 3组干预前后血清学指标比较
3组干预前血CK-MB、cTnⅠ、TNF-α、IL-6、hs-CRP水平比较,差异均无统计学意义(P>0.05)。组内比较:3组干预5 d后血CK-MB、cTnⅠ、TNF-α、IL-6、hs-CRP水平均低于干预前,差异有统计学意义(P<0.05)。组间比较:干预5 d后,C组血CK-MB、cTnⅠ、TNF-α、IL-6、hs-CRP水平均低于A组与B组,且B组低于A组,差异均有统计学意义(P<0.05),见表3。
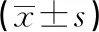
表3 3组干预前后血清学指标比较
2.3 3组临床预后比较
C组ICU住院时间较A组与B组缩短,且B组短于A组,差异均有统计学意义(P<0.05);3组28 d死亡率无明显差异(P>0.05),见表4。

表4 3组临床预后比较
3 讨 论
心功能不全是严重脓毒症的常见并发症,这可能是由于失控的炎症反应导致心率过快与代偿性低心输出量,增大心脏负担,引起心肌缺氧,影响冠状动脉的血流灌注,从而出现心功能降低。经过早期目标导向治疗后,多数患者的临床症状能得到改善,但多存在持续的心率异常,心输出量仍有轻度降低,可能与交感神经兴奋有关[17]。经典的临床理念认为,艾司洛尔、美托洛尔等β受体阻滞剂会降低血压、抑制心肌收缩力,不宜用于合并心功能不全、休克的脓毒症患者。但近年来多项研究表明,β受体阻滞剂能通过抑制肾上腺素能受体来减慢心率、降低心脏耗氧量、抑制心肌收缩,阻断儿茶酚胺对心肌的毒性作用,改善左心室的舒张功能,同时能减轻钙超载,达到抗凋亡的作用[18-19],具有一定的心脏保护作用,逐渐成为脓毒症患者的重要治疗药物之一[8-11,20]。武冬等[21]的一项基础研究表明,艾司洛尔能降低心肌细胞氧化损伤反应,从而减轻脓毒症大鼠的心肌损伤程度,这可能是由于其能抑制炎症信号通路核因子-κB,进而抑制凋亡因子p53、胱天蛋白酶(caspase)-3、caspase-6、caspase-9的表达。周洁等[22]研究表明,艾司洛尔可明显改善脓毒性休克患者的心功能,保护心肌细胞,抑制炎症因子,改善患者预后,且安全性较好。
阿托伐他汀是当前最常用的调脂药物之一,能明显降低患者的总胆固醇和低密度脂蛋白水平,同时也是一种强效的血管内皮细胞稳定剂,具有抗氧化、改善血管内皮功能、影响凝血机制、抑制炎症反应等作用。马宏恩等[23]研究表明,艾司洛尔联合阿托伐他汀能明显改善冠心病心绞痛患者的临床症状、心功能,降低血脂,抑制炎症反应,效果优于单纯艾司洛尔治疗。受该研究的启示,本研究前瞻性选取153例严重脓毒症合并心功能不全患者为研究对象,探讨艾司洛尔联合阿托伐他汀的疗效,结果表明:3组干预5 d后心率、SVRI、血CK-MB、cTnⅠ水平明显降低,CI明显升高,且C组的干预效果最佳,提示艾司洛尔联合阿托伐他汀能明显改善患者心功能,缓解心肌损伤和心功能不全,应用效果优于单用艾司洛尔,这可能是由于阿托伐他汀具有较强的抗炎效果,能有效抑制白细胞介素-1(interleukin-1,IL-1)、TNF-α等炎症因子的释放,进而减轻心肌损伤[24]。王之余等[25]研究表明,阿托伐他汀可以抑制脓毒症大鼠血TNF-α及cTnⅠ的表达水平,减轻炎症反应,保护心肌。本研究结果表明,干预5 d后,C组血清TNF-α、IL-6、hs-CRP等炎症因子水平明显低于A组与B组,且ICU住院时间较A组与B组明显缩短(P<0.05),提示艾司洛尔联合阿托伐他汀的抗炎效果优于单纯艾司洛尔,能在一定程度上促进疾病康复,缓解患者家庭负担。预后方面,3组28 d死亡率无明显差异(P>0.05),提示艾司洛尔联合阿托伐他汀可能不会明显改善患者的生存状况,但本研究为单中心研究,样本量较小,有待大样本量的多中心研究进一步证实。
综上所述,艾司洛尔联合阿托伐他汀能明显抑制严重脓毒症合并心功能不全患者的炎症反应,改善心肌损伤,促进病情康复,应用效果优于单用艾司洛尔。

