复发性急性胰腺炎合并代谢综合征患者的临床特征及其发生重症的影响因素分析
沈娜思,刘英豪,谭泉鑫,谯 敏
(重庆医科大学附属第一医院消化内科,重庆 400016)
急性胰腺炎(acute pancreatitis,AP)是一种常见的急腹症,AP患者的临床转归各不相同,部分患者会反复发作AP。研究发现,AP的复发率为10%~30%[1-3]。复发性急性胰腺炎(recurrent acute pancreatitis,RAP)可发展为慢性胰腺炎,并可能和胰腺癌相关,严重影响患者的生活质量,增加患者的经济负担[4-5]。代谢综合征(metabolic syndrome,MS)是一组以肥胖、高血糖、血脂异常及高血压为临床特征的临床症候群。与不合并MS的AP患者相比,合并MS的AP患者临床症状往往更重、住院时间更长、死亡率更高,但MS与RAP的关系尚不清楚[6]。本研究旨在探讨RAP合并MS患者的临床特征,并分析RAP严重程度的影响因素。
1 资料与方法
1.1 一般资料
收集重庆医科大学附属第一医院2012年6月至2022年6月收治的382例RAP患者的临床资料,根据是否合并MS分为MS组(142例)和非MS组(240例),根据严重程度分为重症组(29例)与非重症组(353例)。重症组仅含重症,非重症组包含轻症及中度重症。本研究经医院伦理委员会审批(K2023-216)。纳入标准:(1)符合RAP的诊断标准,且AP符合《中国急性胰腺炎诊治指南(2021)》[7]中的诊断标准;(2)AP的严重程度根据2012年修订的亚特兰大国际共识[8]进行诊断;(3)符合《中华医学会糖尿病学分会关于代谢综合征的建议》[9]的诊断标准。排除标准:(1)第1次发作AP;(2)确诊为慢性胰腺炎;(3)恶性肿瘤、心脑血管疾病,以及肝、肾及肺疾病;(4)妊娠期或哺乳期妇女;(5)首诊于其他医院或临床资料不全。
1.2 方法
收集患者一般资料:病因、年龄、性别、体重指数(body mass index,BMI)、高血压及糖尿病史;血清学指标:甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、白细胞计数(white blood cell,WBC)、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血钙、D-二聚体(D-dimer,D-D)、乳酸脱氢酶(lactate dehydrogenase,LDH)、ALT、AST;ICU入住率、总住院时间等。
1.3 统计学处理
2 结 果
2.1 MS组与非MS组临床资料比较
MS组引起RAP最常见的病因为高脂血症性(66.2%),非MS组引起RAP最常见的病因为胆源性(44.6%),不同病因比较差异有统计学意义(P<0.05)。与非MS组相比,MS组BMI、TC、TG水平更高,住院时间更长,血钙、D-D、ALT、AST水平更低(P<0.05)。两组间比较发现高血压、糖尿病比例,RAP严重程度比较差异均有统计学意义(P<0.05);年龄、性别、ICU入住率,以及WBC、LDH、NLR水平比较差异均无统计学意义(P>0.05),见表1。
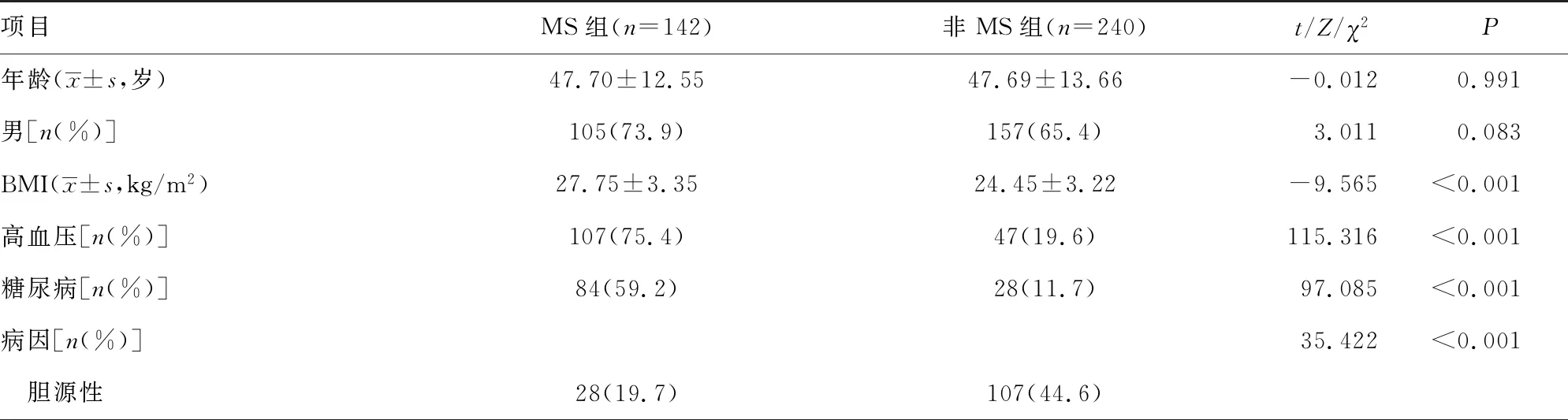
表1 MS组与非MS组一般资料比较
2.2 重症组与非重症组临床资料比较
两组年龄、性别,高血压、糖尿病、MS比例,住院时间,LDH、血钙、D-D、NLR水平比较差异有统计学意义(P<0.05);BMI、WBC、TC、TG水平比较差异均无统计学意义(P>0.05),见表2。
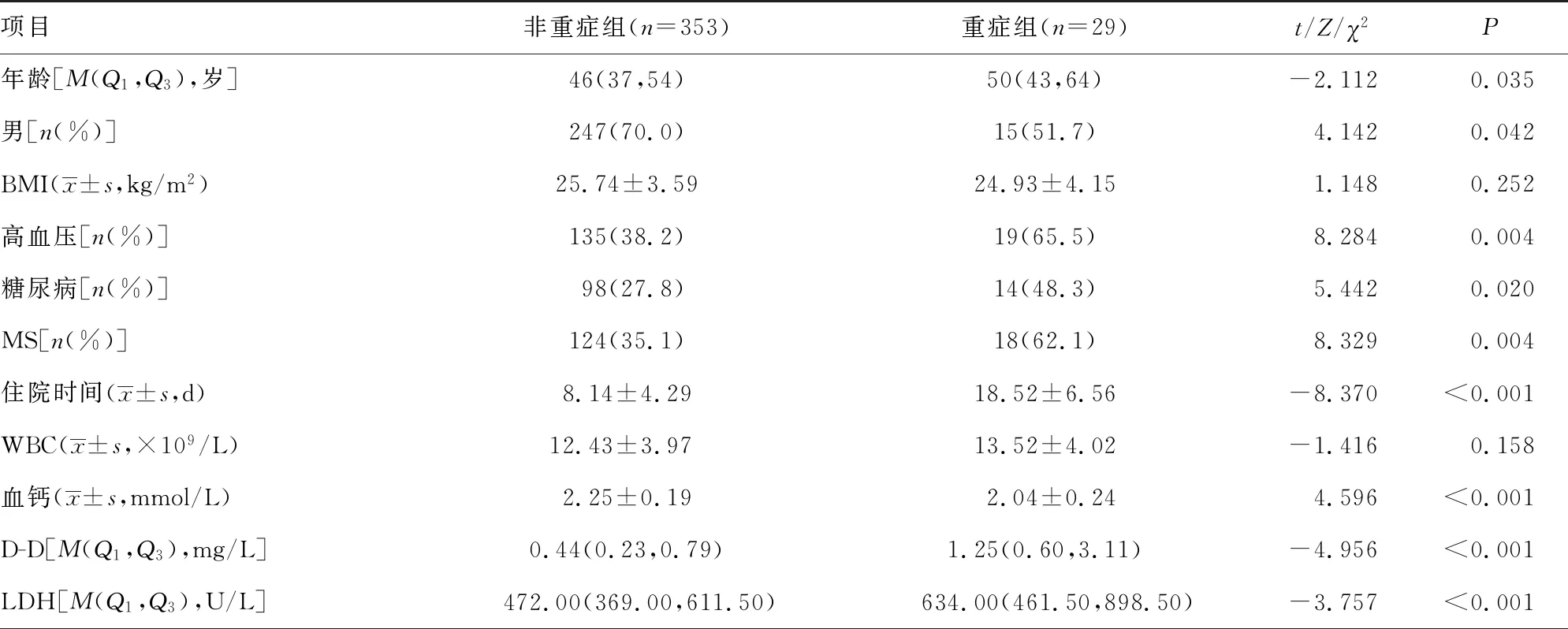
表2 重症组和非重症组一般资料比较
2.3 二元logistic回归分析
将P<0.05的指标构建二元logistic回归方程,结果显示D-D(OR=1.597,95%CI:1.241~2.054)、血钙(OR=0.034,95%CI:0.006~0.202)、NLR(OR=1.068,95%CI:1.012~1.126)、LDH(OR=1.001,95%CI:1.001~1.002)、MS(OR=4.018,95%CI:1.034~15.605)是RAP发生重症的独立影响因素(P<0.05),见表3。
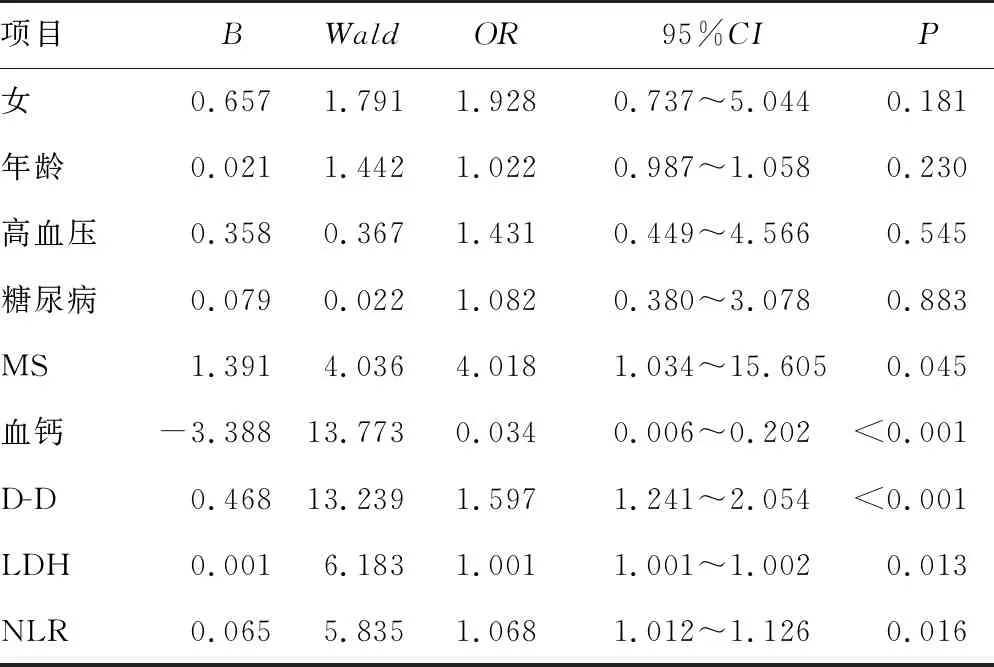
表3 二元logistic回归分析RAP发展为重症的影响因素
2.4 ROC曲线分析
LDH、血钙、D-D、NLR单独诊断对RAP发生重症有一定的预测价值,联合诊断的预测价值更高,见图1、表4。

图1 RAP发生重症的ROC曲线分析

表4 临床指标对RAP发展为重症的预测价值
3 讨 论
随着生活水平的提高,我国MS的发病率也在逐渐增高[10]。已有研究证实MS增加了心脑血管疾病、肾脏疾病、癌症的发生及死亡风险[11-12]。近年来,MS与AP的关系得到临床工作者的广泛关注,有研究表明[13],MS、肥胖、高血糖、高TG血症不仅加重了AP患者的病情严重程度,还增加了AP患者器官衰竭的发生率。
本研究病因学分析表明,非MS组患者发生RAP的主要病因为胆源性,而MS组患者发生RAP的病因以高脂血症性更常见。胆源性RAP患者通常伴有肝功能异常,本研究也发现非MS组RAP患者的ALT、AST水平明显高于MS组,MS组RAP患者更容易发生重症,且住院时间更长。同时,还发现在RAP起病的早期可以通过简单的血清学指标(如血钙、D-D、NLR、LDH)预测疾病的严重程度,从而早期干预以期改善患者预后。
本研究发现,重症组MS比例明显高于非重症组(P<0.05),说明MS与RAP是否发生重症密切相关。在本研究中,重症组患有糖尿病和高血压比例明显高于非重症组。何强等[14]研究表明,RAP患者中重症患者的BMI明显高于非重症组,且多因素logistic回归分析提示BMI与RAP患者的病情严重程度呈正相关。但在本研究中两组BMI水平比较差异无统计学意义(P>0.05)。
当RAP患者进展为重症时,死亡率大大增加。因此,寻找指标预测疾病的严重程度具有重要的临床意义。本研究发现RAP患者重症组LDH、D-D和NLR水平明显高于非重症组(P<0.05)。AP患者发生一些并发症,如胸腔积液[15]和急性肾损伤[16]时,伴随着炎症反应的进展,细胞损伤和坏死,导致LDH释放到血清中并造成血清LDH水平的升高。HUANG等[17]研究发现,LDH升高的AP患者胸腔积液和急性肾损伤的发生率分别比LDH正常的AP患者高1.906和4.277倍。本研究发现,血清LDH是RAP发生重症的独立影响因素,ROC曲线分析显示AUC为0.710,灵敏度和特异度分别为58.6%和75.1%。
D-D是交联纤维蛋白降解的特异性产物,是特异性的纤溶过程标志物,间接反映凝血障碍。有研究表明,D-D水平升高与AP的严重程度和并发症的发生率相关[18],可能与以下致病机制[19]有关:D-D水平的升高反映了AP中纤维蛋白溶解的激活,其程度与疾病的严重程度有关,并可能逐渐从“单纯激活”(表现为轻度、无并发症的胰腺炎患者中D-D水平的轻微升高)发展到更大程度的受累,进展到弥散性血管内凝血前期状态,最后发展到明显的弥散性血管内凝血和多器官衰竭。胰腺局部炎症可导致与凝血系统激活有关的因子蛋白酶的产生,而蛋白酶介导的高凝状态和纤维蛋白溶解激活表现为D-D水平升高,这可能是AP早期D-D水平升高的原因之一。发生AP时,胰酶的异常激活导致胰腺炎症和损伤,诱发血栓形成并进一步加重胰腺损伤。KRONER等[20]研究表明,接受抗凝治疗的AP患者发生急性肾损伤、多器官衰竭、ICU入住率和住院死亡率通常较低,说明在AP治疗的早期阶段预防微血栓的形成可能对患者有利,但这一结论还有待多中心研究进一步验证。本研究表明,入院时D-D≥1.03 mg/L预示着RAP发生重症的风险较高。
AP发作期间血钙水平通常较低,AP的严重程度评分系统中已包括血钙监测。目前的观点认为,脂肪酶对胰腺脂肪组织的自身消化可导致游离脂肪酸的产生,脂肪酸与血钙结合形成脂肪酸钙,沉积在胰腺表面形成白色皂斑,并导致血钙水平下降[21]。AP患者出现低钙血症常提示发生胰腺坏死,是其病情严重的表现。本研究结果显示,发生重症患者RAP血钙水平明显低于非重症组,血钙水平降低是RAP发生重症的危险因素。同时,ROC曲线分析证实血钙可作为患者病情严重程度的预测指标,当血钙≤2.09 mmol/L时,预示着RAR发生重症的风险更大(AUC=0.759)。
NLR可反映作为炎症激活剂的中性粒细胞和作为调节剂的淋巴细胞之间的平衡,NLR越高,炎症程度越高。升高的NLR是一种可靠且敏感的炎症标志物,可以作为感染、败血症、中风、心血管疾病和癌症患者预后不良的重要预测指标[22]。一项meta分析表明[23],NLR对预测重症AP有较高的诊断价值,AUC为0.82。本研究发现,NLR对RAP发生重症同样有一定的预测价值,入院时NLR≥8.75,预示着RAP发生重症的灵敏度为69.0%,特异度为56.1%。
血钙、D-D、LDH、NLR联合预测RAP发生重症的AUC为0.841,灵敏度为72.4%,特异度为80.7%,预测价值更高。重症患者病情进展快、死亡率高,因此发现可预测RAP发生重症的血清学指标对于确定早期分诊、积极复苏和降低重症发生率至关重要。
综上所述,MS组最常见的病因是高脂血症性,非MS组最常见的病因是胆源性。血钙、D-D、LDH、NLR是预测RAP发生重症的可靠指标,联合诊断的准确性更高。但是本研究仍有一定的局限性:(1)仅收集入院后48 h内的血钙、D-D、LDH、NLR数据,未进行更长时间的动态观察。(2)因样本量小,未对合并或不合并MS的RAP患者的严重程度进行亚组分析,可能会限制本研究得出的结论,需要进一步的前瞻性和多中心大样本量研究来证实这些结论。

