大豆分离蛋白与黄原胶复合对胡麻油乳液及其模板油凝胶物理性质的影响
杨 晨 ,韩雅倩,郑凯文,胡海玥,杨雨曈,汪建明
(1. 天津科技大学食品科学与工程学院,天津 300457;2. 优滋福(天津)食品科技有限公司,天津 300457)
固体脂肪在改善食品质地和风味、提供理想的性状和提供饱腹感等方面发挥着重要作用,是食品加工中不可或缺的成分[1]。然而,目前商业固体脂肪中含有大量饱和脂肪酸和反式脂肪酸,过量摄入极易引发肥胖、糖尿病、心血管疾病等慢性病,严重影响人体健康。
胡麻油作为一种营养价值高的食用植物油,含有多种不饱和脂肪酸,尤其富含人体必需多不饱和脂肪酸α-亚麻酸,具有预防心血管疾病、高血压、高血脂以及抗衰老等重要功效[2]。胡麻油凝胶化可以拓宽其在食品中的应用,提高食品的营养价值,为人体补充α-亚麻酸。加热温度的升高会降低胡麻油的不饱和脂肪酸含量[3]。因此,需要寻找一种可以保留胡麻油亚麻酸含量的油脂凝胶化方法。油脂凝胶化是一种利用凝胶剂将液体油转化为类固体凝胶材料但不改变油的化学特性的有效方法[4]。与传统固体脂肪相比,油凝胶的饱和度或反式脂肪酸含量较低,有益于人类饮食健康[5]。早期研究主要针对各种低分子凝胶剂,例如甘油单酯[6]、植物甾醇[7]、蜡[8]、神经酰胺[9]和卵磷脂[10]。小分子凝胶网络的形成需要高温和剪切,且所需浓度较高,可能会限制其商业化应用。近年来,采用高分子物质制备的油凝胶受到普遍关注,其中乳液模板法被认为是一种很有前途的制备油凝胶的方法[11-12]。蛋白质具有较高的营养价值和消费者接受度,采用乳液模板法制备的蛋白质基油凝胶表现出优异的物理和化学性能。Yu 等[13]研究了原花青素和多糖对蛋白质油凝胶形成的影响,发现多糖能有效吸附在单层乳液表面,提高了油凝胶的稳定性,增强了氧化稳定性。如何制备具有良好稳定性的理想油凝胶仍值得探索。
大豆分离蛋白(soybean protein isolate,SPI)具备优越的功能特性,具有两亲基团,是食品体系中重要的加工配料,当蛋白质分散在油水界面时,界面张力降低形成乳液[14]。Zou 等[15]使用SPI 和单月桂酸甘油酯(GML)用乳液模板法制备了油凝胶;与直接分散法相比,采用乳液模板法制备的油凝胶的物理稳定性强,形成致密的三维网络结构,具有较高的触变回收率和防失油能力;但蛋白质微粒单独稳定的乳液容易出现失稳现象。黄原胶(xanthan gum,XG)是一种阴离子多糖,其水溶液具有显著的增稠性和弱凝胶结构的特点,可以明显提高乳液的物理稳定性[16]。
因此,本研究以胡麻油为油相,大豆分离蛋白为结构剂,黄原胶为乳液稳定剂,采用乳液模板法制备胡麻油基油凝胶,通过液滴粒径分布、Zeta 电位、流变学分析、乳化性质、油损失率和傅里叶变换红外光谱等方法对乳液和油凝胶进行评价,分析大豆分离蛋白与黄原胶添加比例对胡麻油乳液及凝胶物理性质的影响,旨在为蛋白质油凝胶替代传统的塑性脂肪以及促进固体脂肪的绿色加工提供参考。
1 材料与方法
1.1 材料
大豆分离蛋白,蛋白质含量为(87.72±0.62)%,山东天博食品配料有限公司;黄原胶,食品级,阿拉丁试剂(上海)有限公司;胡麻油,宁夏索米亚生态农业科技有限公司。
AB204-N 型电子分析天平,梅特勒-托利多仪器(上海)有限公司;HJ-6A 型数显恒温多头磁力搅拌器,上海易友仪器有限公司;DK-8D 型三温三控水槽,上海博迅实业有限公司;FD-1A-50 型真空冷冻干燥机,博医康(北京)仪器有限公司;D-500 型高剪切均质乳化机,德国Wiggens 公司;Zetasizer Advance 型纳米粒度及Zeta 电位分析仪,英国马尔文帕纳科公司;U120 Pro 型紫外-可见分光光度计,翱艺仪器(上海)有限公司;NICOLET IS50 型傅里叶变换红外光谱仪,德国Thermo Scientific 公司;Bettersize 2600 型激光粒度分析仪,丹东百特仪器有限公司;MARS 60 型动态流变仪,德国哈克公司。
1.2 乳液模板及胡麻油基油凝胶的制备
参照刘洋[17]的方法并稍作修改,称取一定质量的大豆分离蛋白溶于去离子水中,配制质量分数5%SPI 溶液,磁力搅拌过夜,得到SPI 溶液。称取一定质量的黄原胶粉末溶解在去离子水中(质量分数0.5%),磁力搅拌过夜,得到XG 溶液。将SPI 溶液和XG 溶液按体积比1∶1、2∶1、3∶1、5∶1、10∶1、1∶0 的比例混合,磁力搅拌1 h,随后将SPI-XG 复合溶液95 ℃加热30 min,然后在冷水浴中迅速冷却。向SPI-XG 复合溶液中加入胡麻油(根据预实验结果,选定油相为40%),19 000 r/min 剪切2 min 制备乳液模板。将乳液模板-40 ℃预冻24 h,冷冻干燥。取出干燥产品,使用搅拌器剪切,得到油凝胶。
1.3 液滴粒径及Zeta电位的测定
采用激光粒度分析仪测定乳液的粒径。参数设置:颗粒吸收率0.001,颗粒折射率1.450,分散剂为水,折射率1.333。结果取3 次测定的平均值。乳液Zeta 电位用纳米粒度及Zeta 电位分析仪测定。
1.4 乳化活性及乳化稳定性的测定
参照Hou 等[18]的方法并稍作修改。从新鲜乳液的底部取 200 μL,用 1 mg/mL 十二烷基硫酸钠(SDS)溶液稀释400 倍,在500 nm 处测定吸光度A0,以SDS 溶液为空白对照。静置30 min 后,根据上述实验方法进行操作,再次测定吸光度At。乳化活性和乳化稳定性分别按照式(1)和式(2)进行计算。
乳化活性用乳化活性指数(EA)表示,为
式中:EA为乳化活性指数,表示1 g 蛋白质的乳化区域,m2/g;N为稀释倍数;θ为油相所占比例;ρ为蛋白质质量浓度,g/mL;L为比色皿中光路长度,1 cm。
乳化稳定性用乳化稳定指数(ES)表示,为
式中:A0为0 min 时的吸光度;At为30 min 时的吸光度;Δt为时间差,30 min。
1.5 乳液流变学特征的测定
乳液流变学特征通过动态流变仪进行测定。参考Wang 等[19]的方法并进行适当修改。取一定体积的新鲜乳液置于平行板上,去除多余的样品,在25 ℃条件下测定并记录数据。
剪切黏度:平板与底盘间隙为1 mm,剪切速率为0.1~100 s-1,记录表观黏度随剪切速率的变化。
小幅动态振荡测量:通过振荡幅度扫描,对乳液进行初步应变扫描,确定乳液的线性黏弹性区,再进行频率扫描,频率为0.1~10 Hz。记录储能模量(G′)和损耗模量(G″)。
1.6 油损失率的测定
采用离心法测定油凝胶样品的油损失率[1]。称取适量的油凝胶样品(m1),以转速10 000 r/min 离心20 min。记录除去游离油后的样品质量(m2)。根据式(3)计算油损失率(R)。
1.7 油凝胶流变学特征的测定
参照Wang 等[19]的方法并稍作修改。采用应变扫描(应变范围0.01%~100%,频率1 Hz)和频率扫描(频率范围0.1~10 Hz,应变0.01%)研究油凝胶的黏弹性性能。表观黏度在剪切速率0.1~100 s-1范围内进行测定。
1.8 傅里叶变换红外光谱分析
1 mg SPI 或XG 粉末样品与150 mg 充分烘干后的溴化钾混合研磨,用压片机将研磨好的混合粉末压成透明的薄片,在 400~4 000 cm-1的范围内,以4 cm-1的分辨率扫描16 次,以空气为采集背景,测试环境温度为25 ℃。
用衰减全反射(attenuated total reflection,ATR)法采集纯油和油凝胶样品的红外光谱。在 400~4 000 cm-1范围内进行32 次扫描。
1.9 数据处理
所有实验均基于3 次独立样品测定,数据以“平均值±标准差”表示。所得数据用SPSS 20 进行统计分析,不同字母表示组间差异显著(P<0.05)。
2 结果与分析
2.1 黄原胶添加比例对乳液粒径分布及Zeta 电位的影响
乳液液滴的大小会影响乳液的稳定性,通常乳液的粒径越小稳定性越好[20]。不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板粒径分布的影响如图1 所示。
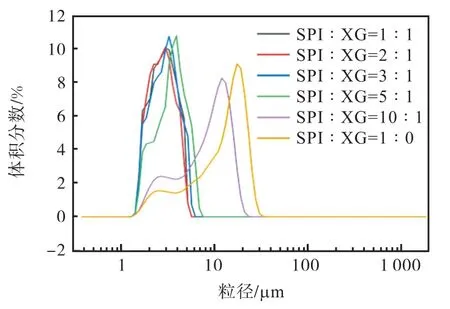
图1 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板粒径分布的影响Fig. 1 Effect of different soy protein isolates and xanthan gum ratio on particle size distribution of emulsion
不同比例的SPI-XG 复合物制备的乳液具有不同的液滴大小。随着黄原胶的不断添加,乳液越来越稳定,小油滴不易聚集,平均粒径较小,且当大豆分离蛋白与黄原胶的体积比为1∶1、2∶1、3∶1、5∶1时呈单峰分布。在大豆分离蛋白与黄原胶的体积比为2∶1 时,乳液的粒径达到最小,为(2.99±0.29)μm。这是因为随着黄原胶添加比例的增大,乳液黏度持续增加从而形成了较大的界面厚度,在液滴周围形成保护层,延缓了脂肪球的碰撞,粒径逐渐减小[21]。此时,复合溶液呈中性,蛋白质分子带净负电荷,但由于蛋白质分子上的某些基团带有正电荷,加热处理后蛋白质分子展开,正电荷基团可能暴露在外面[22]。当加入黄原胶这一阴离子多糖时,蛋白质分子的正电荷区域会和黄原胶分子的阴离子基团发生静电相互作用[22],因此使得液滴吸附层的负电荷增加,乳滴之间的静电排斥力增强,乳液稳定性也随之增强。
乳液Zeta 电位的绝对值越大,乳化体系越稳定[23]。不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板Zeta 电位的影响如图2 所示。所有乳液的Zeta 电位均为负值,这是因为大豆分离蛋白的等电点为4.5,乳液的pH 高于蛋白质的等电点,乳液电位呈负值[24]。随着黄原胶添加比例的不断增加,SPI-XG 复合乳液Zeta 电位绝对值呈现增大趋势。当大豆分离蛋白与黄原胶的体积比为2∶1 时,Zeta 电位绝对值增加至(50.82±1.80)mV,表明乳液体系稳定性增加。这可能是因为黄原胶是一种阴离子多糖,当黄原胶添加比例逐渐增大时,体系内分布大量的负电基团,这导致乳液中的静电斥力增大,显著减缓颗粒之间的碰撞,增强了乳液的稳定性[25]。

图2 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板Zeta电位的影响Fig. 2 Effect of different soy protein isolates and xanthan gum ratio on Zeta potential of emulsion
2.2 黄原胶添加比例对乳液乳化活性和乳化稳定性的影响
蛋白质颗粒具有两亲性质,其覆盖包裹在油滴表面形成乳状液,降低了油滴的界面张力,阻止油滴之间的聚集。乳化性能包括乳化活性和乳化稳定性,乳化活性指的是蛋白质形成油-水界面的能力,乳化稳定性是指乳化液形成小液滴的抗应变能力[26]。不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板乳化活性和乳化稳定性的影响分别如图3和图4 所示。
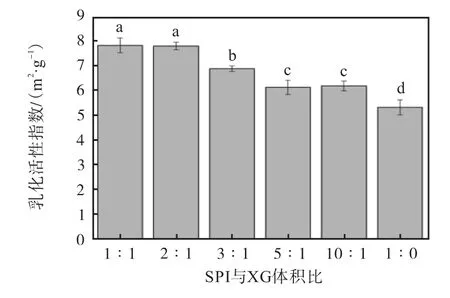
图3 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板乳化活性的影响Fig. 3 Effect of different soy protein isolates and xanthan gum ratio on emulsification activity of emulsion
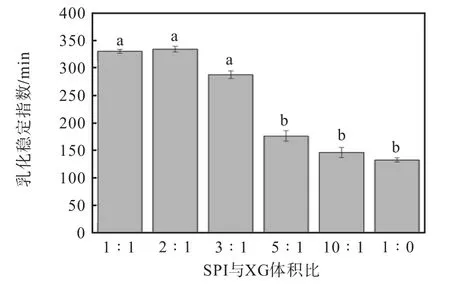
图4 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板乳化稳定性的影响Fig. 4 Effect of different soy protein isolates and xanthan gum ratio on emulsification stability of emulsion
由图3 可知,黄原胶的添加能够显著改善大豆分离蛋白的乳化活性。蛋白质经多糖大分子修饰后,表面疏水性增加,同时黄原胶能显著增加溶液体系的黏度,从而稳定乳液,与未添加黄原胶的乳液相比,乳化活性得到显著提高(P<0.05)。SPI-XG 复合物的乳化稳定性(图4)也得到了一定的改善,当SPI 与XG的体积比为2∶1 时,乳化稳定性比对照组增加了1.5倍,这与粒径及Zeta 电位的结果一致,表明黄原胶能明显改善大豆分离蛋白的乳化性能。
2.3 黄原胶添加比例对乳液表观黏度、储能模量和损耗模量的影响
不同大豆分离蛋白与黄原胶体积比对胡麻油乳液模板表观黏度的影响如图5 所示。从图5 可以看出,乳液的表观黏度随着黄原胶添加比例的增加而增大,且所有样品都表现出剪切变稀的情况,黏度随着剪切速率的增加而降低。这些结果可能是由于乳液中油滴的网络被破坏,油滴重新排列成一定的方向,导致流动阻力减小[28]。

图5 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板表观黏度的影响Fig. 5 Effect of different soy protein isolates and xanthan gum ratio on viscosity of emulsion
不同大豆分离蛋白与黄原胶体积比对胡麻油乳液模板储能模量和损耗模量的影响如图6 所示,其中实心表示G′值,空心表示G″值。随着黄原胶添加比例的增加,其储能模量(G′)和损耗模量(G″)显著增加(P<0.05),说明较高添加比例的黄原胶增强了乳液的凝胶强度。在所有频率范围内,G′值均高于G″值,这表明所有样品都表现出类似固体的性质。因此,较高添加比例的黄原胶比较低添加比例的黄原胶的乳液形成了更好的凝胶网络结构,在一些涉及聚合物的乳液中也出现了同样的现象[29]。
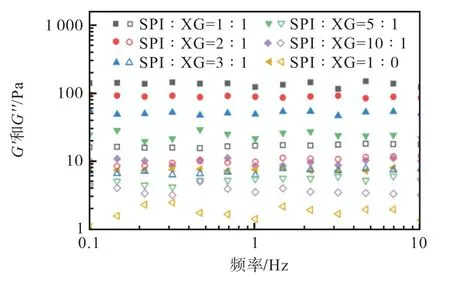
图6 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对胡麻油乳液模板储能模量和损耗模量的影响Fig. 6 Effect of different soy protein isolates and xanthan gum ratio on storage modulus and loss modulus of emulsion
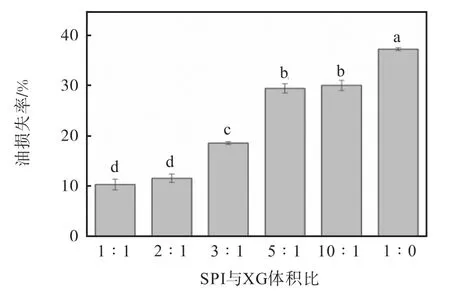
图7 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶油损失率的影响Fig. 7 Effect of different soy protein isolates and xanthan gum ratio on oil loss rate of oleogels
2.4 黄原胶添加比例对油凝胶油损失率的影响
用离心法测定了油凝胶样品的油损失率,用以评估油凝胶的油结合能力,油损失率与油结合能力成反比[30]。随着黄原胶添加比例的增加,油损失率显著降低(P<0.05),当大豆分离蛋白与黄原胶的体积比为1 ∶1 时,油损失率较未添加黄原胶组减少了26.87%。这主要是因为油滴的弹性界面层是由大豆分离蛋白颗粒和少量黄原胶形成的,黄原胶在连续相中形成的凝胶网络结构抑制了油滴的聚集。因此,黄原胶添加比例越大,油凝胶的物理结构越强,越有利于油获得更好的结合能力[31]。这与乳液粒径及乳化性能结果一致,乳液模板的粒径越小,乳液稳定性越高,通过冷冻干燥、剪切后得到的油凝胶样品的油结合能力越强。
2.5 黄原胶添加比例对油凝胶表观黏度、储能模量和损耗模量的影响
不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶表观黏度的影响如图8 所示。从图8 的表观黏度曲线可以看出,所有的油凝胶样品都表现出明显的剪切变稀行为,并且随着黄原胶添加比例的增加,油凝胶的表观黏度增大,这种现象可能是由于颗粒在剪切作用下向一定方向重新排列,流动阻力减小所致,表明油凝胶在外力作用下没有发生凝胶-溶胶转变,油滴被结构良好的界面所覆盖[29]。
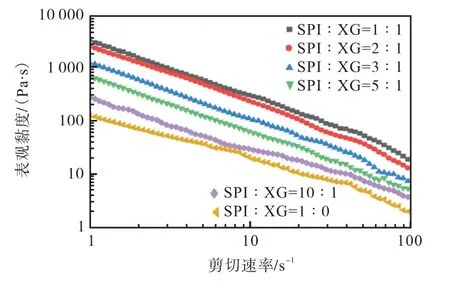
图8 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶表观黏度的影响Fig. 8 Effect of different soy protein isolates and xanthan gum ratio on viscosity of oleogels
不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶储能模量和损耗模量的影响如图9 所示。所有油凝胶样品在线性黏弹性范围内均表现为类似固体的性质(G′>G″)。随着黄原胶添加比例增加,油凝胶的凝胶强度显著增加。当大豆分离蛋白与黄原胶体积比为2∶1、3∶1 时,G′>11 000 Pa;当大豆分离蛋白与黄原胶体积比为1∶1 时,G′达到16 000 Pa,明显高于未添加黄原胶组(1 900 Pa)(P<0.05)。在0.1~10 Hz 范围内,所有的G′值都大于对应的G″值,G′和G″值表现出较低的频率依赖性。没有一条曲线显示G′=G″的交叉点,这表明即使在更高的频率下,油凝胶也没有从凝胶转变为溶胶。黄原胶添加比例越高,油凝胶的G′值越高,凝胶强度越强。这可能是由于黄原胶在乳液中形成了牢固的凝胶网络,并在冷冻干燥和剪切后的油凝胶中保持良好,且黄原胶添加比例越高,形成的网络越硬,油凝胶的凝胶强度越强[29]。

图9 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶储能模量和损耗模量的影响Fig. 9 Effect of different soy protein isolates and xanthan gum ratio on storage modulus and loss modulus of oleogels
2.5 黄原胶添加比例对油凝胶傅里叶变换红外光谱的影响
傅里叶变换红外光谱用于确定油与聚合物之间相互作用的分子信息。大豆分离蛋白、黄原胶、油和油凝胶的傅里叶变换红外光谱如图10 所示。大豆分离蛋白和油凝胶的光谱在3 200~3 450 cm-1处有宽峰,而游离油的光谱没有宽峰。宽峰对应的—OH 拉伸振动归因于大豆分离蛋白分子内或分子间氢键[19]。因此,聚合物链内的氢键是聚合物油凝胶形成的重要驱动力。3 010 cm-1峰值带是油不饱和的标志[32]。油凝胶在3 010 cm-1处的峰值强度始终低于液体油的峰值强度,这表明当油滴被困在聚合物网络中时,双键(=C—H 和C=O)受到限制[33]。油凝胶和油的光谱显示了大多数食用油中所含甘油三酯的典型带[34]。
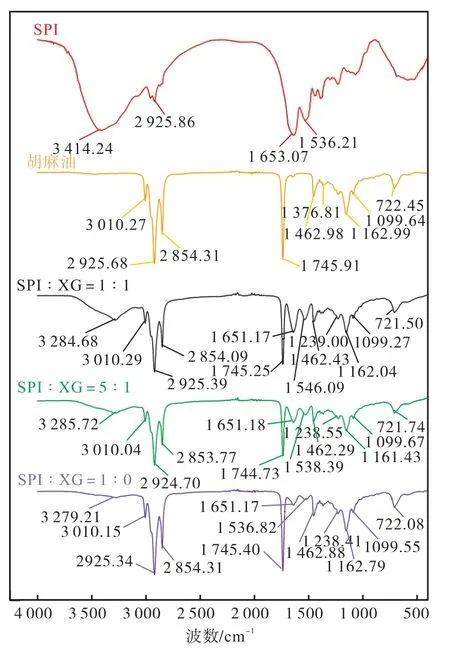
图10 不同大豆分离蛋白(SPI)与黄原胶(XG)体积比对油凝胶傅里叶变换红外光谱的影响Fig. 10 Effect of different soy protein isolates and xanthan gum ratio on Fourier infrared spectroscopy of oleogels
3 结 语
本研究以大豆分离蛋白和黄原胶为原料,采用乳液模板法制备胡麻油基油凝胶。随着黄原胶比例的增加,乳液液滴粒径不断减小,当大豆分离蛋白与黄原胶体积比为2∶1 时,乳液平均粒径达到最小,为(2.99±0.29)μm,Zeta 电位绝对值增加至(50.82±1.80)mV,乳化稳定性比对照组增加了1.5 倍,乳液呈现稳定状态。油损失率、流变学分析和红外光谱分析结果表明,当大豆分离蛋白与黄原胶体积比为1∶1 时,油凝胶的稳定性增加,油损失率较未添加黄原胶的油凝胶减少了26.87%,凝胶强度G′可达16 000 Pa,明显大于未添加黄原胶的油凝胶(1 900 Pa),表现出类似固体的性质。将乳液进行简单冷冻干燥,再将干燥产物进一步剪切而成的油凝胶具有独特的微观结构,凝胶强度高,油结合能力好。通过傅里叶变换红外光谱分析可知,蛋白质分子内或分子间氢键是聚合物油凝胶形成的重要作用力。胡麻油基油凝胶的营养价值、消化特性及其在食品(如饼干、肉制品、巧克力、冰淇淋)中的具体应用值得进一步研究。本研究为可食用聚合物开发胡麻油基油凝胶作为食品工业固体脂肪替代品提供理论支持。

