miR-146a通过TGF-β1/SMAD通路调控脊柱结核进展的分子机制
李小鹏 厉锋 董阳 张扬 赵晓栋 张骁 孙泉 王军 陈高扬
脊柱结核是最常见的肺外结核,可破坏病人椎体与椎间盘,进而形成流注脓肿,常并发脊柱畸形与截瘫,甚至导致死亡,严重影响了人们的生活质量[1-3]。脊柱结核最重要的特征性改变是椎间盘破坏[4],但其破坏机制不明确。转化生长因子β1(transforming growth factor-β1,TGF-β1)是调控椎间盘代谢的重要因子,可通过上调基质金属蛋白酶的表达促进胶原蛋白的降解,导致椎间盘破坏,同时对椎间盘细胞基质的合成与增殖起重要调节作用[5-6]。在脊柱结核的相关研究中,有学者报道TGF-β1能够促使细胞内结核杆菌大量繁殖,降低单核巨噬细胞的吞噬能力,其大量聚集时可导致细胞外基质及骨质破坏、空洞和纤维化[7]。可见TGF-β1 在脊柱结核破坏的病理过程中起着重要的作用,但导致TGF-β1在脊柱结核中表达失衡的机制尚不明确。
微小RNA(miRNA)被认为是转录后水平关键调控因子,其可通过调控目标mRNA 的水平参与转录后调控,进而影响生理和病理过程[8-9]。近年来,miR-146a被证实是重要的调控性非编码RNA,其在调节免疫炎症反应、肿瘤、骨与软骨代谢中发挥重要调控作用[10]。有研究提示miR-146a 通过靶向母亲抗肢瘫同系物4(SMAD4)调节TGF-β1表达,调控疾病进展[11-12]。TGF-β1 主要通过与其特异性受体结合激活SMAD 同系物2(SMAD2)、SMAD 同系物3(SMAD3)蛋白进入细胞核,且通过SMAD4、SMAD同系物7(SMAD7)蛋白的调控激活或抑制目的基因转录从而发挥生物学作用,研究显示SMAD4在TGF-β1/SMAD信号通路占据着核心地位,是信号传导过程中共同需要的介质[7]。因此,我们提出假设:miR-146a 通过结合SMAD4 调控TGF-β1/SMAD 通路,进而调控脊柱结核进展。
在本文中,我们拟探究miR-146a是否通过介导TGF-β1/SMAD通路调控脊柱结核进展,以期为深入了解脊柱结核发生发展提供新的见解,以及为脊柱结核的防治提供新的策略。
材料与方法
一、标本收集
试验对象为在潍坊市人民医院脊柱外科行脊柱结核病灶清除手术及脊柱外伤手术可取得的髓核及血液标本的病人,遵循其知情同意。在取得病人的知情同意书后方能入组,其中结核组病人10 例,男5,女5,年龄为(34.2±10.3)岁;外伤对照组病人10例,男5,女5,年龄为(32.1±14.0)岁。
入组标准:结核组根据术前影像学(图1)及临床症状,术后的组织病理检查等明确诊断,排除其他疾病。对照组病人排除脊柱其他感染性疾病、肿瘤及免疫学疾病等。本实验所有临床标本均根据《赫尔辛基宣言》经病人及家属同意后采集,研究方案获得潍坊人民医院伦理委员会批准(伦理批号:KYLL20190412-1)。
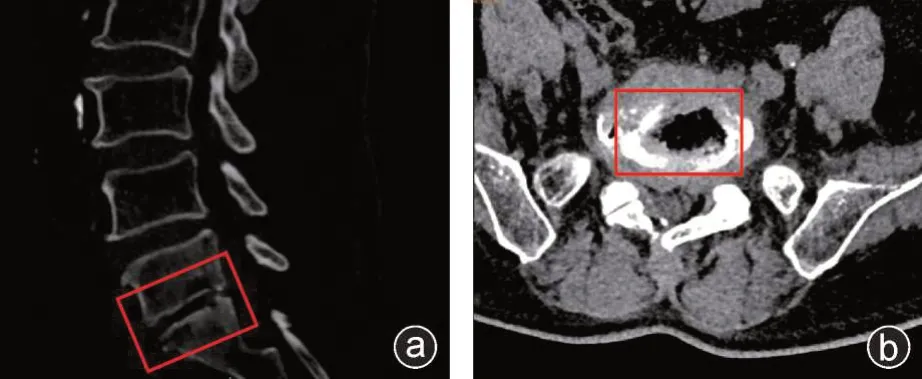
图1 CT 检查矢状位(a)和水平位(b)所示结核感染椎间盘及椎体骨破坏
二、试剂与仪器
由武汉普诺赛生命科技有限公司购得人椎间盘髓核细胞完全培养基,由中国汉恒生物科技有限公司购得miR-146a 的抑制剂(inhibitor,序列为:5'-AACCCAUGGAAUUCAGUUCUCA - 3')、模 拟 物(mimics,序列为:5'-UGAGAACUGAAUUCCAUGGGUU-3',5'-CCCAUGGAAUUCAGUUCUCAUU-3')以及野生型和突变型(miR-146a 结合位点突变)SMAD4序列的萤火虫荧光素酶报告基因质粒,由日本TAKARA 公司购得PrimeScript RT 试剂,由中国碧云天购得RIPA 裂解缓冲液、PBS 溶液、ELC 显色液,由美国Invitrogen 购得liposome 2000、Trizol 试剂和蛋白第二抗体,由上海生工生物技术有限公司设计合成荧光定量PCR 引物(表1),由美国Signalway Antibody 公司购得蛋白提取试剂盒,由英国Abcam公 司 购 得GAPDH(ab9485;1∶5 000)、SMAD2(ab280888;1∶1 000)、SMAD3(ab40854;1∶1 000)、SMAD4(ab40759;1∶1 000)、SMAD7(ab216428;1∶1 000)抗体。由美国菌种保藏中心购得293T细胞,由美国Applied Biosystems 购得StepOne Plus 荧光定量PCR仪,由美国ThermoFisher公司购得酶标仪,由德国Leica公司购得倒置荧光显微镜。

表1 本研究中使用的引物序列
三、细胞分离与培养
结核组病人和对照组病人椎间盘髓核细胞的分离方法参照前期文献[13],细胞培养在人椎间盘髓核细胞完全培养基中,放置于细胞培养箱中(5%CO2,37 ℃),每3天更换培养液,待贴壁细胞扩增至80%,0.25%胰蛋白酶消化传代。
四、构建miR-146a的抑制剂和模拟物及细胞转染方法
由汉恒生物构建miR-146a 的抑制剂(inhibitor)和模拟物(mimics),用于细胞水平敲低和过表达miR-146a。细胞转染步骤简述如下:将脊柱结核病人髓核细胞均匀铺种于12孔板或96孔板,待细胞密度达50%,更换培养基为无血清培养基,应用liposome 2000 将miR-146a mimics(mimics 组)和miR-146a inhibitor(inhibitor 组)转染进入脊柱结核病人髓核细胞,同时设置control组,6小时后更换为正常培养基,每个实验重复3次。
五、增殖实验
将结核组和对照组髓核细胞、敲低/过表达miR-146a 脊柱结核病人髓核细胞铺种于96 孔板(100 μL/孔),然后将培养板放在培养箱中预培养。24小时后向每孔加入10 μL 的CCK-8 溶液,将培养板置于培养箱内孵育1~4 h 后,上清液转入新的96 孔板中,应用酶标仪测定在450 nm 处的吸光度,每个实验重复3次。
六、迁移实验
将结核组和对照组髓核细胞、敲低/过表达miR-146a脊柱结核病人髓核细胞铺种于12孔板,待细胞贴壁后,应用直尺和20 μL枪头均匀地划横线,宽度约500 μm,PBS 清洗划除的细胞后,培养皿放置于37 ℃,2%CO2细胞培养箱中。培养24、48 h后拍照并计算划痕处细胞相对位移,每个实验重复3次。根据位移计算细胞迁移能力,细胞迁移率=(初始划痕宽度-24/48小时后划痕宽度)/初始划痕宽度×100%。
七、RNA表达检测
应用TRIZOL 法提取结核组病人和对照组病人髓核组织及外周血、敲低和过表达miR-146a脊柱结核病人髓核细胞的总RNA,然后应用逆转录试剂逆转录为cDNA。使用StepOnePlus定量PCR系统通过荧光定量PCR 扩增cDNA。U6 和甘油醛-3-磷酸脱氢酶(GAPDH)分别用作miRNA 和mRNA 的内部参考基因。
八、Western blot检测蛋白表达
使用蛋白提取试剂盒提取结核组病人和对照组病人髓核组织、敲低和过表达miR-146a脊柱结核病人髓核细胞的总蛋白,将变性蛋白在SDS-PAGE 凝胶上分离,然后转移到PVDF 膜上。接下来,将PVDF 膜 与GAPDH(ab9485;1∶5 000)、SMAD2(ab280888;1∶1 000)、SMAD3(ab40854;1∶1 000)、SMAD4ab40759;1∶1 000)、SMAD7(ab216428;1∶1 000)抗体在4°C下孵育过夜后,将PVDF膜与相应的第二抗体(A32731)在25 ℃下培养1小时。最后,将ECL显色溶液添加到PVDF膜中以显示蛋白质带。
九、荧光素酶报告基因实验
将293T 细胞接种到96 孔板,由汉恒生物构建野生型和突变型(miR-146a 结合位点突变)SMAD4序列的萤火虫荧光素酶报告基因质粒,将上述质粒分别与miR-146a mimics 或mimics control 转染入293T细胞,设置单纯转染萤火虫荧光素酶报告基因质粒为对照组。同时,向每组中加入等量海参荧光素酶报告基因质粒为参照。转染48小时后,应用酶标仪检测两种荧光活性,并计算相对荧光活性。
十、统计学分析
数据描述为均值±标准差,通过GraphPad Prism 7.5(GraphPad Software,美国)进行分析和可视化。使用学生Student t检验比较两组之间的差异,P<0.05 提示差异有统计学意义。使用Pearson 相关系数分析分子之间表达的相关性。
结 果
一、结核感染椎间盘细胞增殖和迁移能力变化
通过划痕实验发现,结核组病人的髓核细胞24 h和48 h 的迁移率显著低于对照组病人的髓核细胞(图2 a、b),同时CCK-8实验提示结核组病人髓核细胞的增殖活性显著低于对照组病人(图2 c)。上述结果提示结核感染可导致髓核细胞的迁移及增殖活性显著减弱。

图2 结核组病人的髓核细胞增殖(a、b)和迁移能力(c)显著减低,和对照组比较,***P<0.001
二、miR-146a在结核病人组织中表达量鉴定
miR-146a 在脊柱结核病人的髓核组织中表达量显著低于对照组(差异倍数:0.55±0.24,P<0.001,图3 a),miR-146a 在脊柱结核病人的外周血中的表达量显著低于对照组(差异倍数:0.56±0.36,P<0.05,图3 b),提示miR-146a表达量与脊柱结核的进展呈负相关。
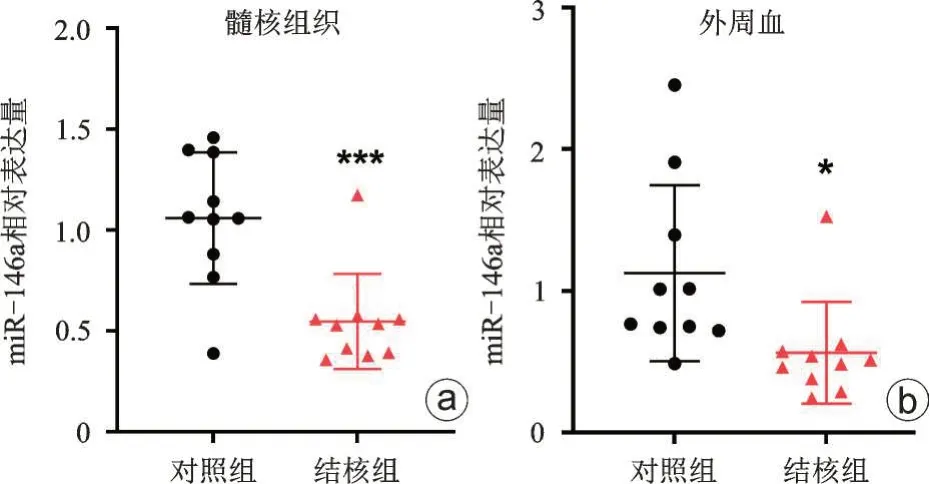
图3 miR-146a在脊柱结核病人髓核组织(a)和外周血(b)中表达量显著减低,和对照组比较,*P<0.05,***P<0.001
三、SMAD 通路在髓核组织中的表达水平与miR-146a表达量相关性检测
我们进一步检测了Smad 通路关键基因及蛋白在结核组病人和对照组病人髓核组织中的表达量,PCR 结果发现髓核组织中SMAD2(差异倍数:2.58±2.19,P<0.05)、SMAD3(差异倍数:9.69±4.44,P<0.001)、SMAD4(差异倍数:10.11±6.48,P<0.001)、TGF-β1 mRNA(差异倍数:5.26±1.66,P<0.001)在脊柱结核病人髓核组织中的表达量显著增高,而SMAD7 mRNA(差异倍数:0.47±0.33,P<0.01)表达显著减低(图4 a),Western blot结果提示蛋白表达趋势与qPCR一致(图4 b、c)。上述结果提示miR-146a表达量与SMAD2、SMAD3、SMAD4、TGF-β1 显著负相关,而与SMAD7呈显著正相关。以上结果提示在髓核组织中,SMAD 通路活性与miR-146a 显著负相关,在髓核细胞中miR-146a对SMAD 通路可能具有抑制作用。
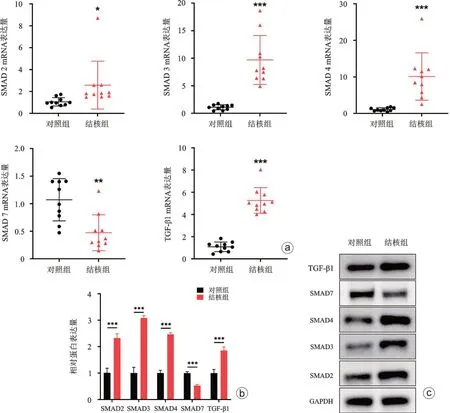
图4 SMAD通路关键基因mRNA(a)和蛋白(b、c)在脊柱结核髓核组织中表达量鉴定,和对照组比较,*P<0.05,**P<0.01,***P<0.001
四、miR-146 靶向Smad4 调控SMAD/TGF-β1 通路鉴定
已有研究提示miR-146a可靶向结合SMAD4 3’-UTR 端进而抑制其表达,我们在实验中构建了包含SMAD4 3’-UTR端野生型或突变型序列的荧光素酶报告基因质粒(图5 a),并与miR-146a mimics共同转染293T 细胞,结果提示:与对照组相比,SMAD4 3’-UTR 端野生型荧光素酶报告基因质粒与miR-146a mimics共同转染时,荧光活性显著减低,而SMAD4 3’-UTR 端野生型荧光素酶报告基因质粒与mimics 对照组,以及SMAD4 3’-UTR 端突变型荧光素酶报告基因质粒与miR-146a mimics 或mimics 对照组荧光活性无明显变化,提示miR-146a mimics可靶向识别SMAD4 3’-UTR 端(图5 b)。为了进一步明确miR-146a 在髓核细胞中对SMAD 通路的调控作用,我们通过体外实验在脊柱结核病人髓核细胞中过表达或敲低miR-146a(图6 a),并检测SMAD/TGF-β1 通路表达变化,结果提示过表达miR-146a 可显著下调SMAD2、SMAD3、SMAD4和TGF-β1 mRNA及蛋白表达水平,但可上调SMAD7表达水平;相反,敲低miR-146a 可显著上调SMAD2、SMAD3、SMAD4 和TGF-β 1 mRNA 及蛋白表达水平,但可下调SMAD7 表达水平(图6 b~d)。上述实验结果进一步证实miR-146a在髓核细胞中可调控SMAD/TGF-β1通路。

图5 SMAD4 3’-UTR端miR-146a结合位点预测(a)及荧光素酶报告基因实验验证(b),和对照组比较,***P<0.001

图6 敲低/过表达miR-146a(a)对SMAD通路关键基因mRNA(b)和蛋白(c、d)表达影响,和对照组比较,*P<0.05,***P<0.001
五、miR-146a调控脊柱结核髓核细胞增殖及分化作用及机制鉴定
我们同时验证了过表达或敲低miR-146a 对脊柱结核病人髓核细胞增殖、凋亡及迁移的影响,结果提示:相较于control组,过表达miR-146a(mimics组)可显著促进髓核细胞增殖及迁移活性并降低其凋亡活性,而敲低miR-146a(inhibitor 组)可显著降低髓核细胞增殖及迁移活性并促进其凋亡活性(图7 a~c),上述结果提示miR-146a是促进髓核细胞增殖及迁移活性的关键因子。
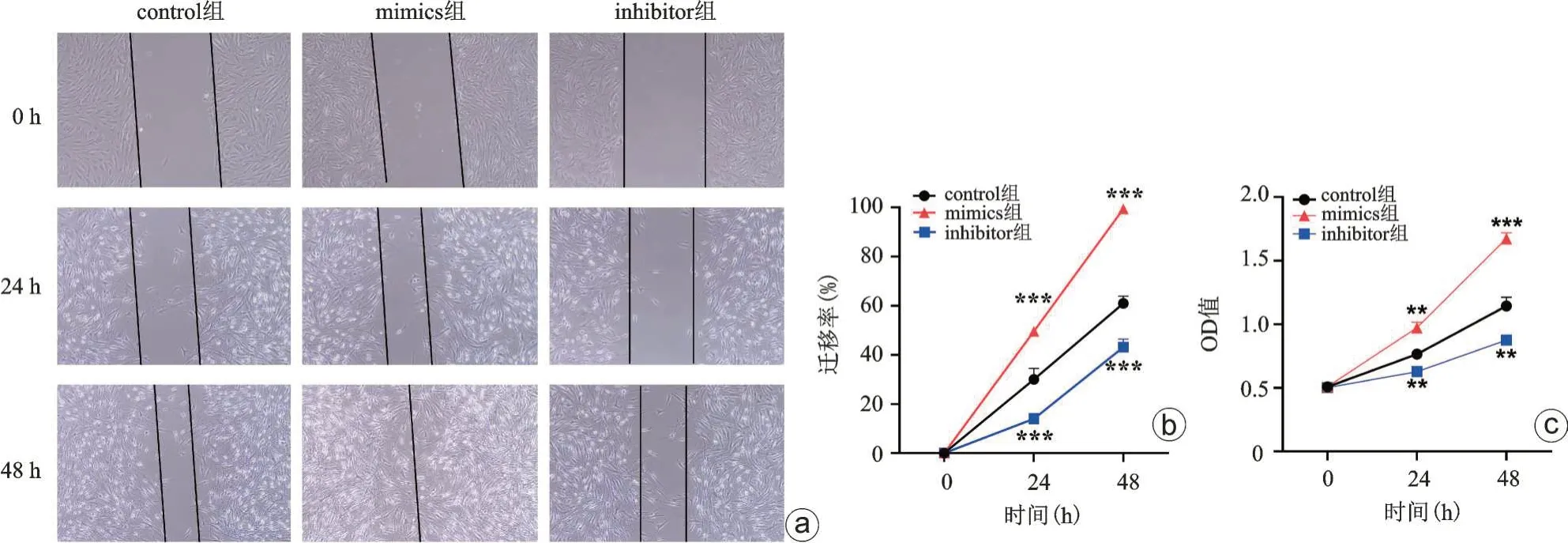
图7 敲低/过表达miR-146a对结核髓核细胞迁移(a、b)和增殖(c)影响,和对照组比较,**P<0.01,***P<0.001
讨 论
脊柱是全身骨关节结核最易发生的部位,其中以椎体结核占大多数[3]。研究表明,结核感染可致椎间盘髓核破坏,是造成椎间盘破坏的重要因素[14]。
miR-146a 的编码基因位于人类5 号染色LOC285628 基因上的第二外显子,miR-146a 功能极其强大,是首个具有免疫系统调节作用的miRNA,其主要作用是负性调节免疫炎症反应,包括类风湿性关节炎、红斑狼疮等多种免疫性疾病[15-16]。在我们的研究中发现miR-146a 表达量在脊柱结核中显著减低,提示其可能与脊柱结核进展相关,但其可能参与的机制仍鲜有研究报道。
有研究发现全反式维甲酸可诱导miR-146a通过靶向SMAD4调节急性粒细胞白血病细胞的增殖[17]。Liu等[18]的研究发现miR-146a通过靶向调控SMAD4进而调节TGF-β1 诱导人上皮成纤维细胞分化。上述所有的文献均揭示了SMAD4 是miR-146a 的标靶蛋白。TGF-β1/SMAD 通道是脊柱结核椎间盘破坏发生发展的关键信号通路,研究报道高剂量TGF-β1可通过结合特异性受体激活SMAD2、SMAD3蛋白进入细胞核,进而通过调控髓核细胞代谢促进髓核退变[5,19-20]。SMAD4在TGF-β1/SMAD信号通路占据着核心地位,SMAD4 是促进SMAD2/3 蛋白入核过程中的关键介质,而SMAD7 在此过程中发挥抑制作用[5,19-20]。同时,目前已有证据证明SMAD4 与椎间盘退变密切相关,在椎间盘退变组织中的表达明显高于正常椎间盘组织[21],而miR-146a 是SMAD4 的关键抑制剂,因此我们推测miR-146a在脊柱结核中是否可通过TGF-β1/Smads 通路调控脊柱结核髓核退变(图8)。

图8 miR-146a调控TGF-β1/SMAD通路示意图(绘图作者:陈高扬)
在我们的研究中,我们首先通过相关性分析证实miR-146a 表达量与SMAD2、SMAD3、SMAD4 和TGF-β1 表达量呈显著负相关,而与SMAD7 呈正相关,提示miR-146a 对TGF-β1/SMAD 通路具有抑制作用。进一步体外细胞实验证实,过表达miR-146a可显著抑制TGF-β1/SMAD 通路活性并促进髓核细胞增殖、迁移并抑制凋亡,而敲低miR-146a 结果相反,进一步证实miR-146a可通过抑制TGF-β1/SMAD通路促进髓核细胞增殖及迁移活性。
当然,本研究仍存在一定的不足。一方面,本研究仅用PCR 法检测了miR-146a 在结核病人外周血及滑膜组织中的表达量,未能在组织水平对miR-146a进行免疫荧光原位杂交定位,以及miR-146a与组织标本中相关分子免疫组化的关联研究;另一方面,本研究基于样本检测解释了miR-146a在脊柱结核组织中的表达趋势,并通过体外细胞实验证实了miR-146a 对TGF-β1/SMAD 通路活性及髓核细胞增殖及迁移活性的调控作用,但由于脊柱结核动物模型造模难度较大,因此并未能从动物水平阐明miR-146a对脊柱结核的治疗功效。因此,未来仍需开展动物实验探讨miR-146a 在治疗脊柱结核中的应用前景。
综上所述,通过本研究,我们发现miR-146a 是脊柱结核进展的关键调控因子,其可通过抑制TGFβ1/SMAD 通路活性进而调控髓核细胞增殖及迁移活性,本研究为深入了解脊柱结核发生发展的分子机制提供了新的见解,同时为脊柱结核的治疗提供新思路。

