N6-甲基腺苷(m6A)转移酶METTL3和m6A调控LINC01465在肝细胞癌增殖转移中的作用机制
刘肸琳,龙朴泽, 黄云美,罗春英,4
(1.右江民族医学院 研究生学院,广西 百色 533000;2.湖北医药学院附属东风医院 病理科,湖北 十堰 442008;3.右江民族医学院附属医院 病理科,广西 百色 533000;4.广西肝胆疾病分子病理重点实验室,广西 百色 533000)
肝癌是中国最常见的恶性肿瘤之一,可分为原发性和继发性[1]。具有高发病率和高死亡率的特点。是全球癌症死亡率第三的恶性肿瘤[2]。由于术后的复发和转移,治愈性手术后肝癌患者的5年生存率仅为35%~43%[3]。其中肝细胞癌(hepatocellular carcinoma, HCC)是最普遍的亚型,占所有原发性肝癌的90%以上[4]。HCC的发病率和多种原因有关,其中包括乙型肝炎病毒(hepatitis B virus, HBV)和/或丙型肝炎病毒(hepatitis C virus, HCV)的慢性感染、酗酒、非酒精性脂肪性肝炎(nonalcoholic fatty liver disease, NASH)、自身免疫性肝病、药物性肝损伤和黄曲霉毒素暴露[5]。近些年对于肝细胞癌的探索层出不穷,但对其机制的研究仍不清晰。寻找和肝细胞癌有关的靶向分子标志物以及影响其预后的分子机制亟待解决。
N6-甲基腺苷(N6-methyladenosine, m6A)是现在发现最丰富的RNA修饰形式之一,由甲基转移酶复合物(甲基转移酶样3[met L3]、甲基转移酶样14[met L14]和WT1相关蛋白[WTAP])催化[6],其中甲基转移酶样3(methyltransferase like 3, METTL3)是唯一的催化亚单位[7]。METTL3全长有580个氨基酸,由锌指结构域(ZFD)和甲基转移酶结构域组成。据报道METTL3对骨髓细胞瘤、卵巢癌等多种癌症的发生发展进程中发挥着关键作用,促进肿瘤发生、癌细胞的增殖转移、干细胞的分化[8]。研究显示,在肝癌中METTL3能够抑制HCC细胞中的糖酵解过程[9]参与HCC中的代谢重编码[10]以及促进肝癌的增殖转移[11],而METTL3在肝癌中发挥作用的机制尚不清晰。
LncRNAs是一种非蛋白编码的RNA,通常由超过200个核苷酸组成,在细胞增殖分化中发挥着重要作用。并参与肿瘤发生、转移以及耐药性[12]。LINC01465被验证在卵巢癌中具有促进癌细胞增值转移的作用[13]。其在肝细胞癌中的作用研究尚未提及。本研究旨在探究METTL3对肝细胞癌增殖转移的作用及潜在机制,为进一步探索临床中METTL3作为HCC的重要标志物提供理论基础。
1 材料与方法
1.1 材料
1.1.1 组织和细胞系 收集2021年7月至2022年12月右江民族医学院附属医院手术切除的新鲜肝癌及配对癌旁组织30例,并放于-80 ℃冰箱保存。所收集的患者标本术后均确诊为肝细胞癌,患者未接受过放疗化疗等治疗,所获取的组织标本已通过右江民族医学院附属医院伦理委员会审批(NO:YYFY-LL-2023-171)。实验所用正常人肝细胞LO2和肝癌细胞系SMMC-7721、BEL-7404、HepG2购自中科院上海生物化学与细胞生物研究所。
1.1.2 主要试剂和仪器 于达尔伯克改良伊格尔培养基(DMEM)、FBS(胎牛血清)、0.25%胰蛋白酶(含酚红)、青霉素-链霉素双抗溶液购于美国Gibco公司;蛋白预制胶(7.5%)、三色预染蛋白Marker、RIPA高强度裂解液购自上海雅酶生物医药科技有限公司;TRIzol试剂、MonScript TM RTIII Super Mix with dsDNase(Two-Step)试剂盒、RT-qPCR试剂盒Mon AmpSYBR Green qPCR Mix (HighROX))-均购于武汉莫纳生物科技公司;EpiQuik m6A RNA Methylation Quantification Kit(Colorimetric)试剂盒购于美国EPIGENTEK公司;METTL3抗体购于美国Cell Signaling Technology公司;实验所涉及的细胞培养瓶、离心管、96孔板、6孔板均购自广州洁特生物过滤有限公司;Molecular 多功能酶标仪 SpactraMaxi3x(美国 Molecular Devices);实时定量PCR仪(BTK-96);恒温细胞培养箱 HH-B11(美国ThermoFisher公司); 荧光倒置显微镜 OLYMPUS-51(日本OLYMPUS公司)。
1.2 方法
1.2.1 细胞培养与传代 人正常肝细胞(LO2)和肝癌细胞系(SMMC-7721、BEL-7404、HepG2)放置于完全培养基中。培养基为DMEM,添加 10% 胎牛血清(FBS),以及0.5 mL的青链霉素配制成完全培养基。培养条件为 37 ℃,5% CO2恒湿环境。
1.2.2 RT-qPCR RNA提取后,使用微量紫外可见分光光度计对RNA的浓度和纯度进行检测,进行cDNA的反转录。MonAmpTMSYBR Green qPCR Mix试剂盒及正向引物、反向引物配置成20 uL的体系,使用实时定量PCR仪进行qPCR实验。将GAPDH设置为内参,用2- △△Ct计算目的基因和内参基因的相对表达量,基因引物序列见表1。

表1 引物序列
1.2.3 Western blot 提取蛋白后,配置蛋白质预制胶,将提取的蛋白上样,进行电泳,随后采用“三明治”法湿转进行转膜,转膜结束后用1×的TBST漂洗5 min、3次。用封闭液封闭2 h。TBST洗涤,4 ℃一抗孵育过夜。约15 h后,结束孵育,用TBST洗涤3次,每次10 min,二抗孵育1 h后,再洗涤3次,随后配置显影液进行显影。
1.2.4 比色法检测细胞内m6A水平 购入比色法试剂盒,将条带井从密封袋中取出,加入试剂盒中的80 μL BS溶液,以及2 μL NC、2 μL PC作为阴性和阳性对照组,加入200 ng RNA样本,轻轻摇晃混匀。用Parafilm M覆盖条带井,37 ℃孵育90 min。用枪头吸出BS溶液,用WB溶液清洗。依次加入50 μL CA溶液、50 μL DA溶液和50 μL ES溶液,Parafilm M封闭,室温孵育1 h,WB洗涤。每个孔加入100 μL DS溶液,室温下避光孵育,当阳性对照组的颜色变为中蓝色,加入SS溶液终止反应,在酶标仪450 nm处检测其吸光度。
1.2.5 细胞转染 慢病毒转染24 h前,将细胞均匀铺在六孔板中,转染时细胞密度达到70%。用Gibco替换完全培养基,向培养基内加入适量病毒以及助转染试剂,16 h后用完全培养基进行换液。分别于24、48、72、96 h观察细胞内荧光。
1.2.6 细胞增殖能力检测(CCK-8) 购入Cell Counting Kit-8(CCK-8)试剂,将肝癌细胞以1×104每孔均匀铺在96孔板内,每孔100 μL细胞悬液,设置5 d分别为0、24、48、72、96 h,以1∶9的比例将CCK-8试剂和完培配置成100 μL的混合液,放入37 ℃,5% CO2的细胞培养箱,培养2 h,检测450 nm处的吸光度。
1.2.7 克隆形成实验 以每孔800个细胞的浓度,接种在六孔板上,约14 d后,取出六孔板,用4%的多聚甲醛固定液固定细胞6 min,随后用结晶紫染色10 min,用PBS轻轻漂洗干净结晶紫,拍照并分析图像。
1.2.8 Transwell小室侵袭实验 Transwell小室上室面用Matrigel(50 mg/L)稀释液包被后以FN涂抹在小室下面并干燥,紫外线消毒30 min。各孔加入1% BSA无血清培养基0.1 mL,Matrigel充分浸润后吸掉残余培养基。然后,制备细胞悬液,将细胞浓度调整为1×106个/mL,细胞悬液0.2 mL(1×105)加于预包被培养板各孔,于下室缓慢加入10% FBS培养基0.5 mL,温箱培养16 h。最后,用棉签将Transwell小室上室面未穿过基底层膜的细胞擦去,显微镜下进行计数细胞并比较。
1.2.9 Transwell小室迁移实验 向Transwell小室上室内加入200 μL配置好的完全培养基,激活小室底部膜后吸出,用1% BSA无血清培养基配置0.2 mL(1×105)的细胞悬液,加入小室的上室,向小室下室加入600 μL含FBS(胎牛血清)的完全培养基,37 ℃,5% CO2细胞培养箱培养24 h,取出24孔板,吸出残留液体,4%的多聚甲醛固定液固定细胞10 min,用PBS清洗2次。1%的结晶紫染色10 min,用PBS清洗,直至将结晶紫溶液清洗干净。用棉签将上室面未穿过基底层膜的细胞擦掉,显微镜下观察拍照并计数。
1.2.10 全转录组RNA甲基化(m6A)测序(MeRIP-seq) 细胞培养浓度至1×108/mL,按照培养瓶面积每1 cm2加入1 mL TRIzol将所有细胞消化掉,加入冻存管中,用干冰运输至上海天昊生物公司,进行MeRIP-seq。

2 结果
2.1 METTL3在HCC细胞和组织中表达情况、与患者预后的相关性 通过TCGA数据库,我们探究了METTL3在肝癌中的表达量,选取371例肝癌组织以及50例癌旁组织,分析METTL3在组织中的表达差异,发现其在肝癌组织中的表达量明显高于癌旁组织(图1A)。随后采用RT-qPCR检测正常肝细胞、肝癌细胞系以及肝癌组织和癌旁组织中METTL3的表达差异,发现其在肝癌组织以及肝癌细胞株SMMC-7721、BEL-7404中表达量显著高于正常肝细胞和癌旁组织(图1B、D)。通过western blot检测正常肝细胞、肝癌细胞系以及肝癌组织和癌旁组织中METTL3的蛋白表达差异,并进行定量分析。肝癌细胞及组织中METTL3的蛋白表达量高于正常肝细胞及癌旁组织(图1C、E)。在TCGA数据库中进行Kaplan-Meier生存分析,在肝细胞癌中,高表达的METTL3多提示预后不良(图F)。
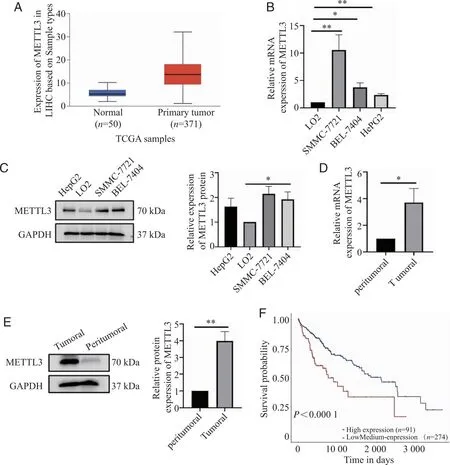
A: METTL3在肝癌中的表达水平TCGA samples;B、D:RT-qPCR检测正常肝细胞LO2、HCC细胞系(SMMC-7721、BEL-7404、HePG2)和癌旁组织以及HCC组织中METTL3的mRNA的表达量;C、E:WB检测正常肝细胞LO2、HCC细胞系(SMMC-7721、BEL-7404、HEPG2)和癌旁组织以及HCC组织中METTL3的蛋白表达水平;F: METTL3对HCC预后的影响; *、**:P<0.05、P<0.01。
2.2 下调METTL3抑制肝癌细胞的增殖 METTL3在肝癌中呈高表达,且多提示不良预后,因此我们推测METTL3对肝癌的增殖迁移、侵袭有促进作用。敲低METTL3,RT-qPCR进行敲低效果的验证(图2A、B),随后采用western blot检测蛋白水平的敲低效果并进行定量分析(图2C、D)。在7721细胞中选取敲低效果最好的sh-METTL3-3进行后续试验,7404细胞株中选取sh-METTL3-1进行后续功能试验。CCK-8实验(图2E、F)及克隆形成实验(图2G、H)显示METTL3表达量降低后,细胞增殖能力下降。
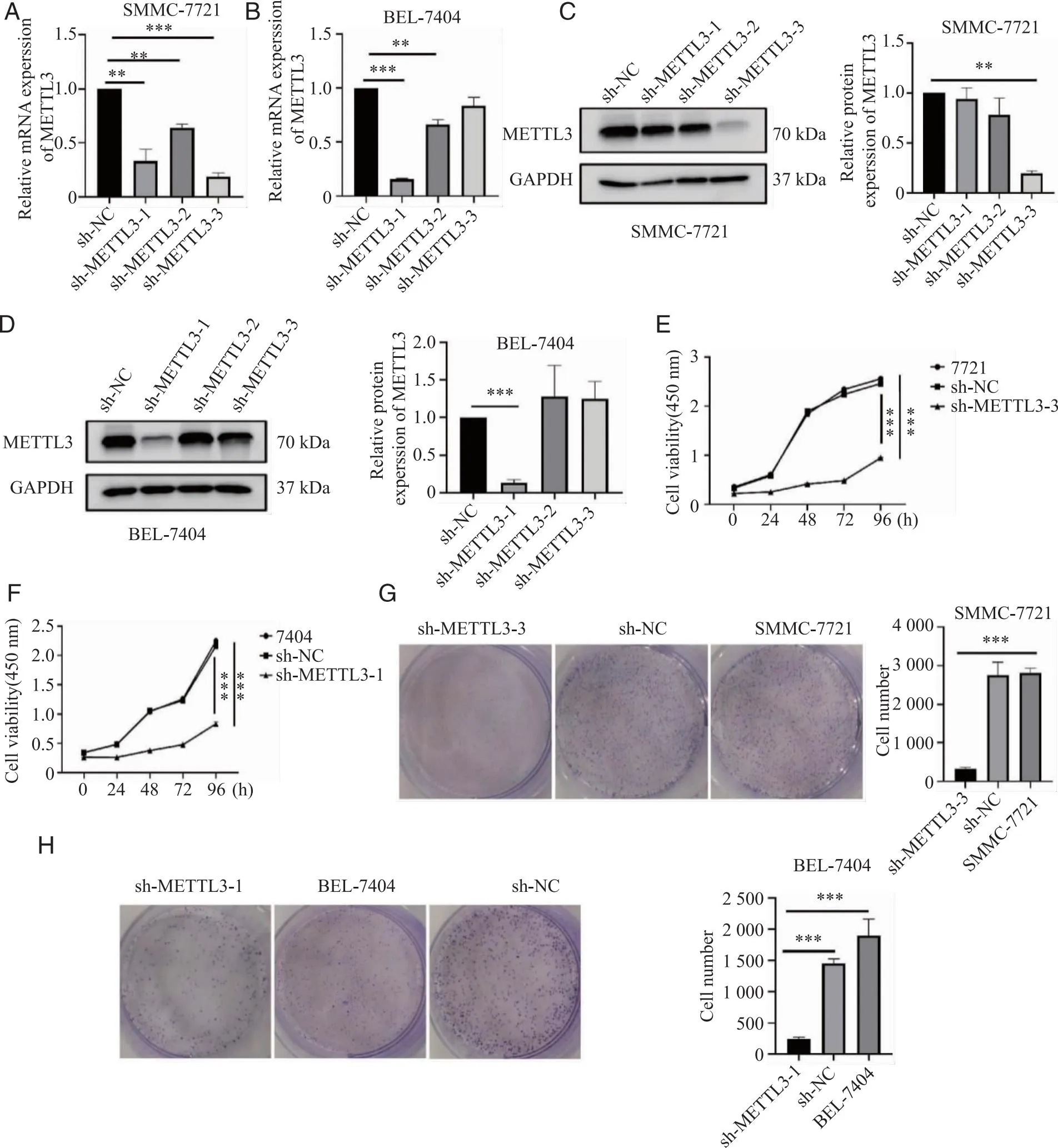
A、B:RT-qPCR检测肝癌细胞的转染效率;C、D:Western blotting检测肝癌细胞转染效率;E、F:CCK-8实验检测对照组和实验组细胞增殖情况;G、H:克隆形成实验检测对照组和实验组细胞增殖情况;**、***:P<0.01、P<0.001。
2.3 下调METTL3抑制肝癌细胞的迁移 敲低METTL3后HCC细胞迁移能力比较:在SMMC-7721和BEL-7404细胞中敲低METTL3后, transwell迁移实验检测到METTL3表达量下降后敲低组细胞穿过小室的数量明显下降,肝癌细胞迁移能力明显降低,结果表明METTL3有促进肝癌细胞迁移的作用(图3)。
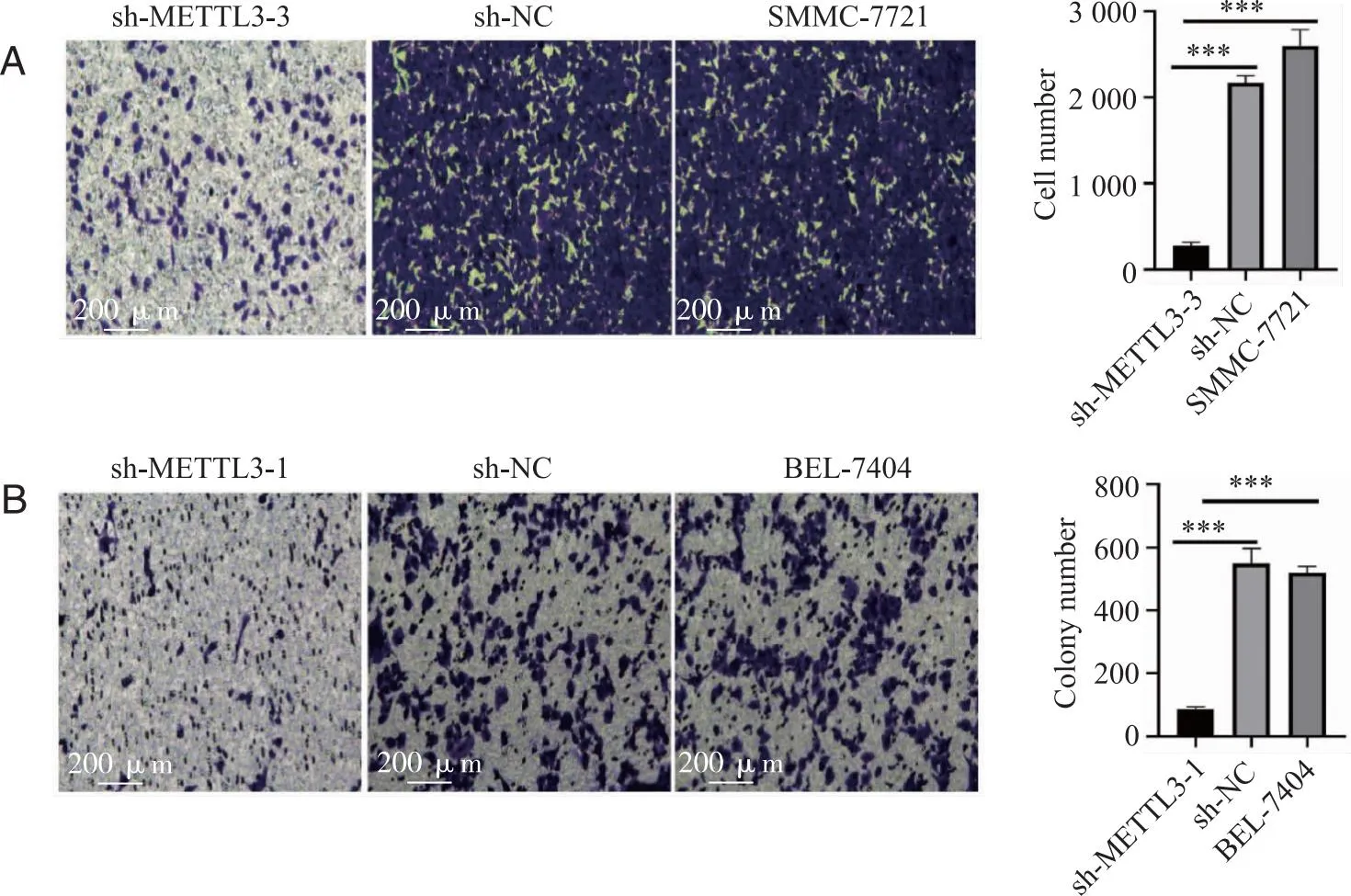
A:SMMC-7721中对照组和敲低组细胞迁移能力情况;B:BEL-7404中对照组和敲低组细胞迁移能力情况;***:P<0.001。
2.4 下调METTL3抑制肝癌细胞的侵袭 敲低METTL3后HCC细胞侵袭能力比较:在SMMC-7721和BEL-7404细胞中敲低METTL3后, transwell侵袭实验表明METTL3表达量降低后,敲低组细胞穿透基底膜的数量降低,HCC细胞侵袭能力降低。结果显示高表达的METTL3会更快的穿透基底膜,促进肝癌细胞的侵袭(图4)。

A:SMMC-7721中对照组和实验组细胞侵袭能力情况;B:BEL-7404中对照组和实验组细胞侵袭能力情况;*、**:P<0.05、P<0.01。
2.5 沉默METTL3对m6A水平、LNCRNA表达及功能的影响 用m6A比色法试剂盒检测到肝癌细胞的m6A水平显著高于正常肝细胞(图5A)。MeRIP-seq测序对NC组与METTL3敲低组进行分析得到差异m6A峰值(Peak),有262个peak上调,355个peak下调(图5B),并得到差异peak基因分布区域的饼状图,其比例显示和NC组相比m6A峰主要位于exonic、nc-rnaexonic、UTR5(图5C)。此外,NC组和敲低组的差异性peak分布显示其主要分布在起始密码子附近(图5D)。与NC组相比敲低组的m6A峰值及基因表达量都发生了改变,其中表达量上调的基因图有308个,下调的有284个。m6A峰值上调的有227个,下调的有306个(图5E)。对于METTL3敲低组中有18个转录本在差异m6A甲基化修饰转录本中下调(图5F)。GO富集结果显示在分子功能(MF)中,METTL3敲低组和NC组相比较,其主要差异表现在参与GTP酶激活蛋白结合、硫酯酶结合、细胞周期蛋白依赖性蛋白丝氨酸/苏氨酸激酶抑制剂活性、蛋白质丝氨酸/苏氨酸激酶抑制剂活性、肿瘤坏死因子受体超家族结合。在细胞组分(CC)中差异性体现在突触后特化,细胞内成分、富含ficolin-1的颗粒膜以及SCF泛素连接酶复合物方面。在生物学过程(BP)中甘油三酯代谢过程、子宫发育、溶酶体定位表现为显著差异(图5G)。KEEG富集结果显示和NC组相比敲低组有几条重要的信号通路发生显著改变,主要表现在Rap1信号通路、肌动蛋白细胞骨架的调控、胰岛素信号通路(图5H)。
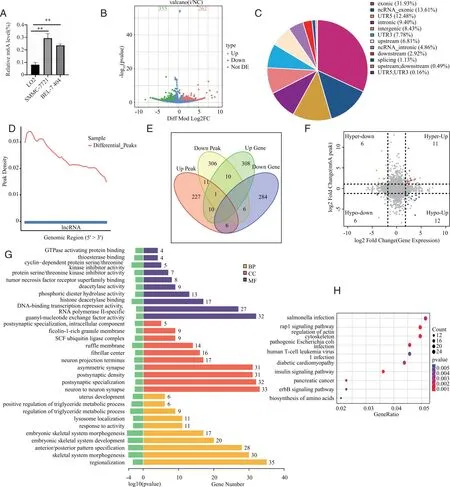
A:比色法测定正常肝细胞LO2及肝癌细胞系(SMMC-7721,BEL-7404)中m6A水平;B:火山图展示了上调和下调peak数量;C:饼状图展示了peak的基因分布区域;D:差异peak基因分布密度;E:veen图显示上调的下调的差异性peak及基因表达量;F:交集四象限图;G:GO富集显示生物学功能的差异性改变;H:KEGG分析显示通路的变化;**:P<0.01、。
2.6 敲低METTL3逆转了LINC01465对肝细胞癌进程的促进作用 筛选出log2Fold Change绝对值大于1的基因,表示其有差异性。LINC01465在HCC中并无相关报道,且在样本中具有显著差异性。为了确认LINC01465是METTL3作用的靶基因,随后分析了TCGA数据库中50例正常肝组织,369例癌旁组织的LINC01465水平,显示LINC01465基因在HCC组织中显著高表达(图6A)。网站预测发现METTL3和LINC01465在肝细胞癌中呈现正相关(图6B)。通过qPCR验证,在HCC细胞中敲低METTL3后LINC01465表达水平降低(图6C)。在HCC细胞中LINC01465的mRNA水平显著高于正常肝细胞(图6D)。

A :TCGA 预测了LINC01465在肝细胞癌和癌旁组织中的表达[num(T)=369; num(N)=160];B :GEPIA预测METTL3和LINC01465的相关性;C:通过 RT-qPCR 检测沉默 METTL3 后LINC01465的表达;D:通过 RT-qPCR 检测LINC01465在正常细胞LO2、HCC细胞系(SMMC-7721,BEL-7404)中的表达水平;***:P<0.001。
3 讨论
N6-甲基腺苷(m6A)是高等真核生物中mRNA和长链非编码RNA中最为丰富的内部修饰,在RNA代谢和多种生物学过程中发挥着重要作用,m6A甲基化过程是一个可逆的过程[14]。m6A甲基化受一组m6A调控酶进行动态调节,包括写入酶(METTL3、METTL14、WTAP)、擦除酶(FTO、ALKBH5)和读取酶(YTHDF-1、YTHDF-2)[15]。这一过程可以影响多种生物学功能,包括昼夜节律调节、干细胞更新分化、早期胚胎发育等[16]。m6A可以调节基因表达并促进细胞的各种过程,包括细胞更新、免疫、凋亡、分化及癌细胞的侵袭[17]。参与m6A这一过程的酶可以通过影响m6A水平来调节癌基因和抑癌基因[18]。
METTL3作为最重要的甲基转移酶之一,在肿瘤形成和进展过程中有不可忽视的作用。先前研究显示,METTL3在膀胱癌[19]、胶质母细胞瘤[20]等肿瘤中起到了非常关键的影响。在结直肠癌中METTL3通过促进IGF2BP2的m6A水平来促进结直肠癌的进程[21]。在膀胱癌中METTL3以m6A依赖的方式促进Pri-miR221/222的成熟,来促进癌细胞增殖转移[22]。也有研究发现,METTL3通过上调基因的m6A水平来成为肿瘤抑制因子[23]。对于METTL3在肝癌中的作用之前的研究中有提到,Chen等[24]发现METTL3通过YTHDF2转录后沉默SOCS2来促进肝癌的增殖转移。但关于METTL3对lncRNA发挥的作用以及对肝癌增殖转移的作用机制尚不清晰。
lncRNA是一种不编码蛋白质,长度大于200 nt的转录物[25]。越来越多研究显示lncRNA参与疾病的发生和病理生理学过程。其参与细胞周期[26]、骨髓生成[27]、癌症上皮间质转化[28],以及调节癌细胞的增殖、侵袭、凋亡和转移[29],lncRNA可以与蛋白质相互作用参与肿瘤发生的各种信号通路[30]。这些lncRNA通过在基因转录和转录后修饰中发挥作用,在癌症中发挥着重要作用。LINC01465在卵巢癌中过度表达,并促进癌症进展[31],但其在肝细胞癌中的作用机制并未有研究。
本研究发现METTL3在肝癌细胞系以及肝癌组织中都呈高表达,且和患者预后相关。因此可以确定METTL3在肝细胞癌中是一个高表达的促癌基因。通过沉默METTL3基因后进行功能试验,进行结果分析后发现,METTL3表达量降低后,CCK-8结果显示450 nm处的吸光度明显降低,克隆形成以及Transwell的细胞数也发生明显差异,由此可得出METTL3在肝细胞癌中起到促进增殖、迁移的作用。研究证实在胰腺癌、胃癌中METTL3也发生了促进癌细胞增殖转移的作用[32-33],这些研究结果也可以证实本实验结果的正确性。敲低METTL3后,高通量测序结果显示下游靶基因LINC01465的表达量以及m6A水平发生差异性改变,干扰METTL3后,qPCR检测LINC01465的表达水平,结果表明sh-METTL3会抑制LINC01465的表达。在TCGA数据库分析发现LINC01465在正常肝组织中的表达量低于肝癌组织,与qPCR结果显示一致,LINC01465在正常肝细胞中的表达量显著低于HCC细胞,在肝细胞癌中发挥促癌作用。在HCC中,高表达的METTL3会通过m6A依赖方式影响LINC01465的m6A水平,进一步促进LINC01465的表达水平来促进HCC细胞的发展进程。
本研究结果显示,METTL3作为一个促癌基因对HCC的进程起到了促进作用,测序结果显示沉默METTL3会抑制靶基因LINC01465的m6A水平,来降低LINC01465的表达量,从而实现抑制HCC增殖转移的效果。
综上所述,本研究揭示了一个新的机制,METTL3以m6A依赖方式调控LINC01465的m6A水平来改变LINC01465的表达水平,进而影响HCC的进程。METTL3在肝细胞癌中呈高表达,通过升高LINC01465的m6A水平促进了LINC01465的表达量来加快HCC发展,其表达量的改变与HCC细胞的侵袭、迁移和增殖有关。这一机制可使METTL3作为HCC早诊和早治疗的关键分子,其有望成为未来临床对HCC治疗的重要靶向分子标志物。

