丁苯酞与尤瑞克林在大动脉粥样硬化性脑卒中患者治疗中的效果研究
王琼琼
脑卒中分为出血性脑卒中及缺血性脑卒中, 缺血性脑卒中发病率高于出血性脑卒中, 可达总数70%[1]。缺血性脑卒中又可由病因归类为大动脉粥样硬化性脑卒中、小动脉病变性脑卒中及心源性脑卒中, 大动脉粥样硬化斑块破裂是导致缺血性脑卒中发生的关键环节, 大动脉粥样硬化发生的主要原因为高血压, 当血压过高, 冲击血管壁造成损害, 为脂质提供更有利的沉积环境, 进而堵塞血管形成动脉粥样硬化斑块, 而血管流通不畅又会升高血压, 形成恶性循环, 最终硬化斑块破裂释放组织因子及血小板活化因子形成血栓引发缺血性脑卒中[2]。根据中国急性期缺血性卒中诊疗指南推荐, 临床主要应用尤瑞克林与丁苯酞进行治疗。尤瑞克林为激肽释放酶重要组成成分, 可通过促进激肽原生成具有扩张血管能力的激肽, 扩张脑部动脉, 恢复血流供应, 改善脑部血流量, 减小梗死面积, 并可抑制脑部神经细胞凋亡, 促进神经干细胞增殖、迁移、分化为新神经元, 起到修复神经的作用, 尤瑞克林还可通过修复血管内皮减轻炎症反应[3], 但因其扩张脑血管过快可能造成再次出血及缺血再灌注损伤。为保护脑细胞, 常加用丁苯酞进行联合治疗, 丁苯酞为新型抗血小板聚集药物, 可通过多种方式保护脑组织, 包括升高脑内一氧化氮水平, 降低脑细胞内钙离子数量, 抑制受损部位氧自由基损害, 抗血小板聚集减少血栓形成, 减轻患者脑水肿, 增大血流量改善患者脑梗死症状[4]。本研究对比单独应用尤瑞克林、丁苯酞及联合应用两种药物治疗大动脉粥样硬化性脑卒中的疗效, 旨在为临床提供更有利的用药方案, 现报告如下。
1 资料与方法
1.1 一般资料 将本院2020 年6 月~2022 年6 月收治的114 例大动脉粥样硬化性脑卒中患者作为研究对象。纳入标准:①年龄≥18 岁;②确诊为急性缺血性脑卒中[5];③分析病因为大动脉粥样硬化所致脑卒中;④既往无脑卒中发病史;⑤知情并同意参加本项研究。排除标准:①影像学检查显示有颅内出血情况;②失聪、失语或精神异常以致不能进行认知评估;③合并轻、重度全身性感染;④妊娠或哺乳妇女;⑤正在使用卡托普利、贝那普利等药物;⑥对本研究使用药物过敏。将研究对象随机分为丁苯酞组、尤瑞克林组及联合组,每组38 例。三组患者一般资料包括年龄、性别、吸烟史、饮酒史、高血脂病史、高血压病史、糖尿病病史进行对比, 三组患者组间比较差异不具备统计学意义(P>0.05), 具有可比性。见表1。
表1 三组患者一般资料比较(n, ±s)

表1 三组患者一般资料比较(n, ±s)
组别 例数 性别 年龄(岁) 吸烟史 饮酒史男女丁苯酞组 38 22 16 61.55±11.24 23 24尤瑞克林组 38 24 14 64.73±11.72 22 22联合组 38 25 13 65.96±10.33 24 20 χ2/F 0.523 1.588 0.220 0.864 P 0.770 0.209 0.896 0.649
续表1
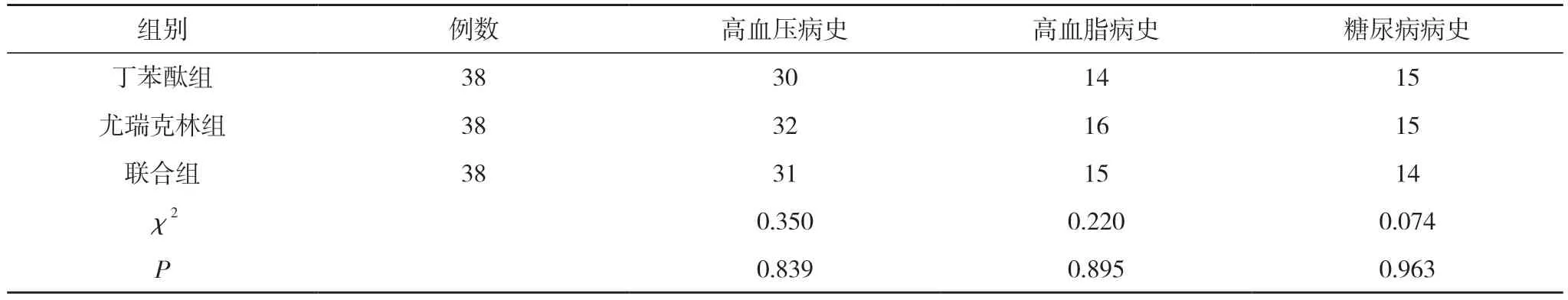
表1 三组患者一般资料比较(n, ±s)
注:三组比较, P>0.05
组别 例数 高血压病史 高血脂病史 糖尿病病史丁苯酞组 38 30 14 15尤瑞克林组 38 32 16 15联合组 38 31 15 14 χ2 0.350 0.220 0.074 P 0.839 0.895 0.963
1.2 方法 三组患者均给予常规治疗, 包括:给予瑞舒伐他汀钙片口服, 10 mg/次, 1 次/d, 随晚餐服用, 用于调脂;给予阿司匹林片口服, 100 mg/次, 1 次/d, 用于防止血小板聚集, 抗凝效果不好时可加用替格瑞洛片, 90 mg/次, 2 次/d;给予依拉达奉注射液静脉滴注,30 mg/次, 2 次/d, 合理控制患者血压、血糖。①丁苯酞组在常规治疗基础上给予丁苯酞软胶囊(石药集团恩必普药业有限公司, 国药准字H20050299, 规格:0.1 g×24 粒)空腹口服, 0.2 g/次, 3 次/d, 用药21 d。②尤瑞克林组在常规治疗基础上给予注射用尤瑞克林(广东天普生化医药股份有限公司, 国药准字H20052065, 规格:0.15PNA 单位×10 瓶)静脉滴注, 0.15PNA 单位/次,1 次/d, 用药21 d。③联合组在丁苯酞组治疗基础上联用尤瑞克林注射液, 方式同尤瑞克林组, 联合用药21 d。
1.3 观察指标及判定标准 比较三组患者不同时间点NIHSS 评分、治疗前后炎症指标(hs-CRP、PLR、NLR)、不良反应发生情况。①NIHSS 评分:对患者治疗前、治疗第7 天、治疗第15 天进行NIHSS 判定,NIHSS 量表包括视野范围、指令配合度、意识水平、肢体运动障碍程度等11 项, 总计42 分, 分数与患者神经受损程度呈正相关;②炎症指标:于治疗前、治疗第7 天抽取三组患者治疗前后空腹静脉血5 ml, 离心处理后取上层清液, 使用全自动生化分析仪测定hs-CRP水平、白细胞数量、血小板数量及淋巴细胞数量,依 照Karatas 公 式[6]计 算PLR, PLR= 血 小 板 数 量(×109/L)/淋巴细胞数量(×109/L), NLR=静脉血白细胞数量(×109/L)/淋巴细胞数量(×109/L)。③不良反应发生情况:记录三组患者治疗过程中发生的不良反应,包括腹部不适、皮疹、幻觉、头晕、乏力、心悸、皮肤出血、颅内出血等。
1.4 统计学方法 采用SPSS19.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 多组间比较作方差分析, 两组间比较采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 三组患者不同时间点NIHSS 评分比较 治疗前,三组患者NIHSS 评分比较, 差异不具备统计学意义(P>0.05)。治疗第7、15 天, 三组患者NIHSS 评分均较治疗前下降, 差异具有统计学意义(P<0.05)。治疗第7、15 天, 丁苯酞组与尤瑞克林组NIHSS 评分比较, 差异均不具备统计学意义(P>0.05)。治疗第7、15 天, 联合组NIHSS 评分低于丁苯酞组及尤瑞克林组, 差异均具有统计学意义(P<0.05)。见表2。
表2 三组患者不同时间点NIHSS 评分比较( ±s, 分)
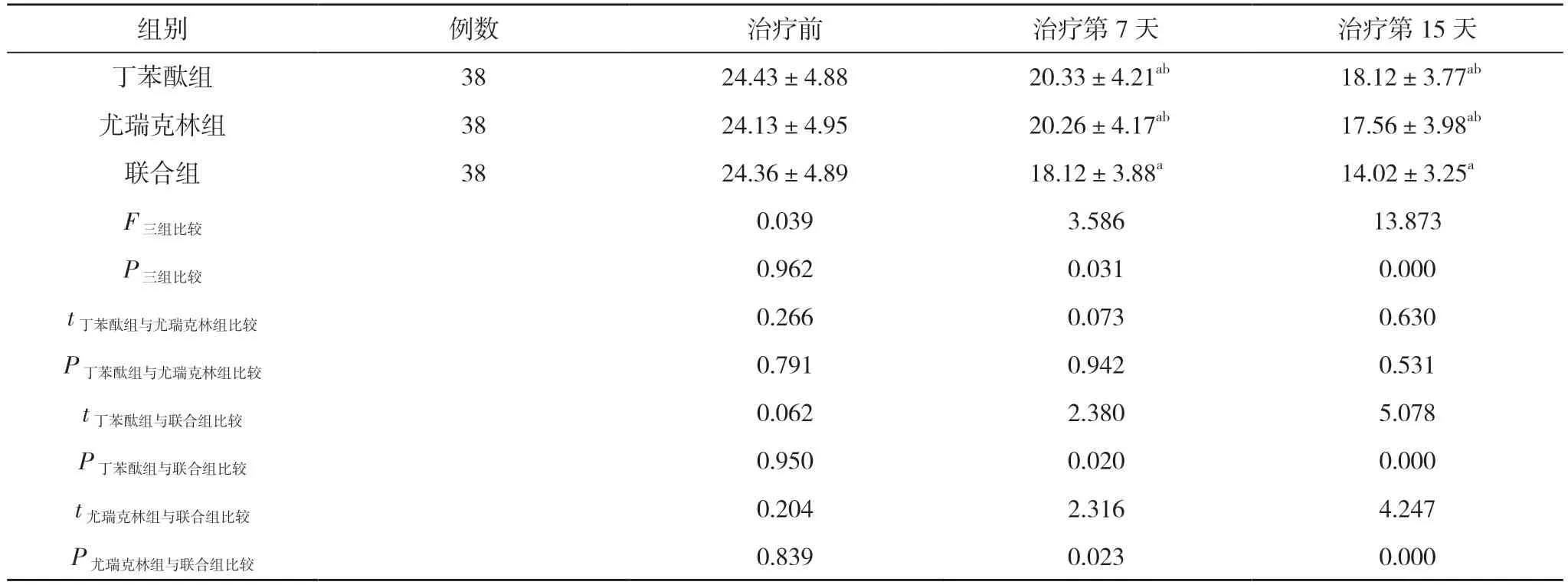
表2 三组患者不同时间点NIHSS 评分比较( ±s, 分)
注:与本组治疗前比较, aP<0.05;与同期联合组比较, bP<0.05
组别 例数 治疗前 治疗第7 天 治疗第15 天丁苯酞组 38 24.43±4.88 20.33±4.21ab 18.12±3.77ab尤瑞克林组 38 24.13±4.95 20.26±4.17ab 17.56±3.98ab联合组 38 24.36±4.89 18.12±3.88a 14.02±3.25a F三组比较 0.039 3.586 13.873 P三组比较 0.962 0.031 0.000 t丁苯酞组与尤瑞克林组比较 0.266 0.073 0.630 P丁苯酞组与尤瑞克林组比较 0.791 0.942 0.531 t丁苯酞组与联合组比较 0.062 2.380 5.078 P丁苯酞组与联合组比较 0.950 0.020 0.000 t尤瑞克林组与联合组比较 0.204 2.316 4.247 P尤瑞克林组与联合组比较 0.839 0.023 0.000
2.2 三组患者治疗前后炎症指标比较 治疗前, 三组患者hs-CPR、NLR、PLR 差异不具备统计学意义(P>0.05)。治疗后, 三组患者hs-CRP、NLR、PLR 均较治疗前下降, 差异均具有统计学意义(P<0.05)。治疗后, 丁苯酞组hs-CRP、NLR、PLR 低于尤瑞克林组,联合组hs-CRP、NLR、PLR 均低于丁苯酞组和尤瑞克林组, 差异均具有统计学意义(P<0.05)。见表3, 表4。
表3 三组患者治疗前后hs-CRP 水平比较( ±s, mg/L)
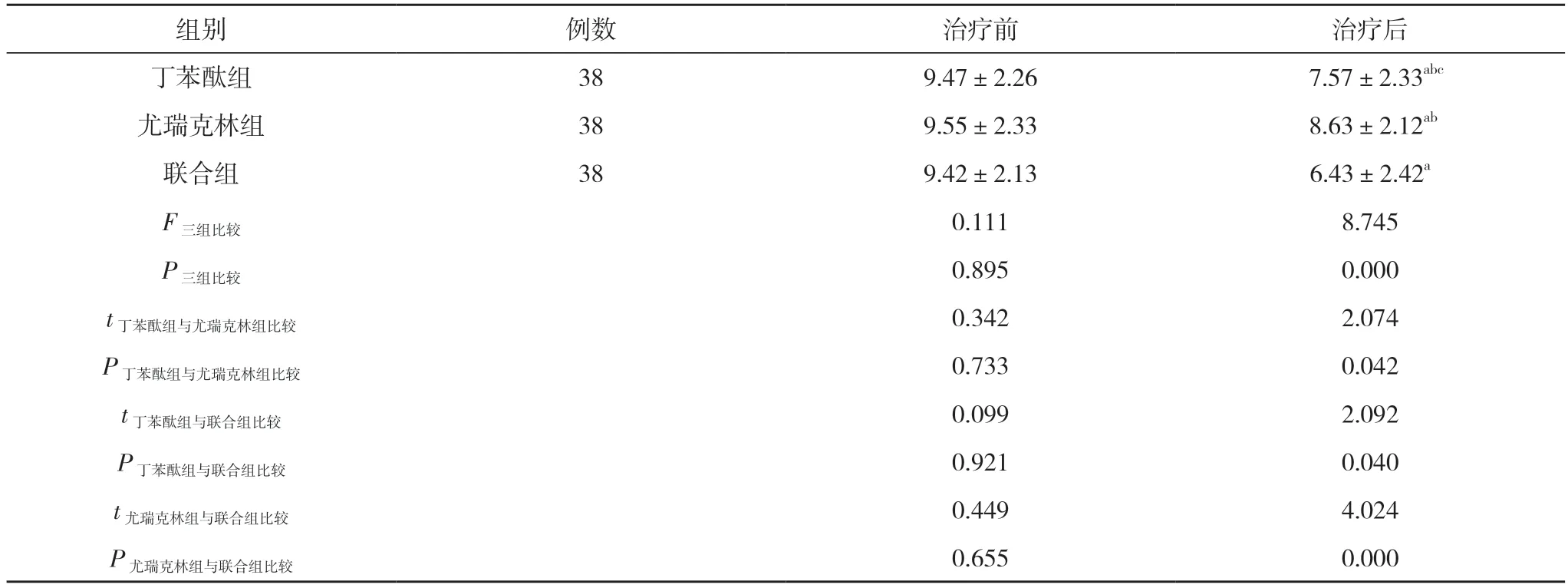
表3 三组患者治疗前后hs-CRP 水平比较( ±s, mg/L)
注:与本组治疗前比较, aP<0.05;与同期联合组比较, bP<0.05;与同期尤瑞克林组比较, cP<0.05
组别 例数 治疗前 治疗后丁苯酞组 38 9.47±2.26 7.57±2.33abc尤瑞克林组 38 9.55±2.33 8.63±2.12ab联合组 38 9.42±2.13 6.43±2.42a F三组比较 0.111 8.745 P三组比较 0.895 0.000 t丁苯酞组与尤瑞克林组比较 0.342 2.074 P丁苯酞组与尤瑞克林组比较 0.733 0.042 t丁苯酞组与联合组比较 0.099 2.092 P丁苯酞组与联合组比较 0.921 0.040 t尤瑞克林组与联合组比较 0.449 4.024 P尤瑞克林组与联合组比较 0.655 0.000
表4 三组患者治疗前后NLR、PLR 比较( ±s)

表4 三组患者治疗前后NLR、PLR 比较( ±s)
注:与本组治疗前比较, aP<0.05;与同期联合组比较, bP<0.05;与同期尤瑞克林组比较, cP<0.05
组别 例数 NLR PLR治疗前 治疗后 治疗前 治疗后丁苯酞组 38 2.78±0.45 1.88±0.48abc 132.87±19.94 120.36±18.39abc尤瑞克林组 38 2.76±0.48 2.26±0.53ab 133.52±20.14 130.16±18.44ab联合组 38 2.79±0.43 1.36±0.35a 132.95±20.22 109.35±18.18a F三组比较 0.043 36.717 0.012 12.249 P三组比较 0.958 0.000 0.998 0.000 t丁苯酞组与尤瑞克林组比较 0.187 3.276 0.141 2.320 P丁苯酞组与尤瑞克林组比较 0.852 0.002 0.888 0.023 t丁苯酞组与联合组比较 0.099 5.396 0.123 2.625 P丁苯酞组与联合组比较 0.921 0.000 0.902 0.011 t尤瑞克林组与联合组比较 0.287 8.735 0.037 4.954 P尤瑞克林组与联合组比较 0.775 0.000 0.971 0.000
2.3 三组患者不良反应发生情况比较 三组患者治疗期间均出现腹部不适、皮疹、头晕、乏力等不良反应, 组间比较差异不具备统计学意义(P>0.05)。且三组均未见幻觉、心悸、皮肤出血、颅内出血等情况发生。见表5。

表5 三组患者不良反应发生情况比较[n(%)]
3 讨论
大动脉粥样硬化性脑卒中多发于40 岁以上男性[7],合并糖尿病、高血压、高血脂均可诱发缺血性脑卒中。临床治疗多从抗凝、抗血小板聚集以及保护脑组织入手, 尤瑞克林可选择性扩张脑部细小动脉, 改善大脑缺氧状态, 促进受损神经、血管再生[8]。丁苯酞可减少血小板聚集, 改善脑组织血流循环, 还可活化大脑抗氧化酶, 减轻炎症反应。本研究结果可见三组患者治疗后NIHSS 评分均有不同程度的显著降低, 尤瑞克林组与丁苯酞组治疗后第7、15 天测试结果差异不明显,提示尤瑞克林与丁苯酞可改善患者脑卒中症状, 且能力相近, 与其他文献得出的结论吻合[9], 原因为丁苯酞具有抑制血小板聚集作用, 减少血栓形成, 减小梗死面积;尤瑞克林扩张脑血管, 改善脑细胞缺氧缺血状态,促进神经细胞修复。提示联合用药方案可降低脑卒中患者死亡风险, 治疗效果较单独应用更好, 究其原因,尤瑞克林扩张脑内血管时, 易造成缺血再灌注损伤, 而丁苯酞可保护受损细胞, 维护线粒体功能, 预防脑组织二次损伤, 起到协同作用[10], 故联合方案改善血流循环效果好且减少脑细胞损伤, 加速血管修复, 改善脑卒中症状效果优于单独用药。
有资料显示, 炎症反应对脑卒中患者预后有很大影响, 原因为患者脑部恢复血流易出现缺血再灌注损伤现象, 损伤脑血管, 引发炎症反应, 炎症因子激活,提高白细胞数量, 粘附于血管造成堵塞[11-13], 可能加重病情。本研究发现治疗7 d 后三组患者NLR、PLR、hs-CRP 水平均显著低于治疗前, 提示两种药物均可降低炎症反应, 防止血管再堵塞, 丁苯酞组治疗后NLR、PLR、hs-CRP 水平明显低于尤瑞克林组, 提示丁苯酞减轻炎症反应治疗效果强于尤瑞克林。尤瑞克林虽亦可通过促进脑细胞及血管再生以减少脑卒中患者炎症反应, 但能力有限, 而丁苯酞可拮抗神经细胞氧化应激直接缓解炎症症状[14-18], 联合组NLR、PLR、hs-CRP水平较单独应用丁苯酞明显更低, 探究原因可能为当联用两种药物时, 在尤瑞克林扩张血管、增加血流的作用下, 脑组织活性增强, 此时丁苯酞保护脑组织避免缺血再灌注损伤时, 可帮助脑组织修复, 恢复速度大于单独应用丁苯酞[12,19], 与前文论述三种方案改善患者卒中症状的结果相符。三组患者不良反应组间比较差异不具备统计学意义(P>0.05)。提示两种药物联用时不会增加不良反应发生率, 安全性较高。
综上所述, 单独应用尤瑞克林与丁苯酞均可有效治疗大动脉粥样硬化性脑卒中患者, 治疗效果相近, 联合使用两种药物时治疗效果更强, 可改善患者脑卒中症状, 降低患者炎症因子水平, 安全性良好, 值得临床推广。

