广西北部湾海洋弧菌多样性研究进展
覃欣怡,赵华显,杨恕,黄炯清,廖能健,李晓丽,姜宫凌侠,李楠,*
(1.南宁师范大学北部湾环境演变与资源利用教育部重点实验室,地理与海洋研究院,广西南宁 530001)(2.鲁东大学农学院,山东烟台 264025)(3.桂林理工大学环境科学与工程学院,广西桂林 541004)(4.广东海洋大学近海海洋变化与灾害预警实验室,广东省高等学校陆架及远海气候、资源与环境重点实验室,海洋与气象学院,广东湛江 524088)
弧菌(Vibrio)隶属γ-变形菌纲(Gammaproteobacteria),是一类菌体短小、呈弯曲或逗点状、兼性厌氧及化能异养的革兰氏阴性细菌,可在硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(Thiosulfate Citrate Bile Salts Sucrose Agar Culture Medium,TCBS)弧菌分离培养基上生长[1-3]。
弧菌在沿海地区,包括河口、海湾,以及沉积物和海洋动物体内普遍存在[4],其种群动态与季节变化、物理化学特性及生物因素多种因素密切相关。例如,Siboni 等[5]研究揭示了悉尼港河口不同季节海洋弧菌群落组成的变化主要是由温度、盐度和亚硝酸盐驱动。Singleton 等[6]发现霍乱弧菌(V.Cholerae)的生存和生长会受到盐度和有机养分浓度的影响。徐伟等[7,8]研究了东山湾海洋弧菌群落结构的时空分布特征,结果发现东山湾海洋弧菌多样性主要由温度、溶解氧、硝酸盐和亚硝酸盐驱动。深入探讨海洋弧菌多样性与环境因子之间的响应机制,有利于阐明海洋弧菌群落的生态效应。
大量研究表明,海洋弧菌广泛参与海洋生态系统元素循环,并发挥重要作用。例如,海洋弧菌通过胞外水解酶(包括几丁质酶、琼脂酶、海带多糖酶和淀粉酶等)降解多糖等复杂有机物的方式参与海洋中的有机碳循环[9]。此外,Li 等[10]发现海洋弧菌属(Vibriosp.Y1-5)可以通过去除硝酸盐和铵盐来实现氮的固定。还有相关研究发现少数海洋弧菌具有发光特性。例如,海洋费氏弧菌(V.fischeri)的发光程度与生物毒性浓度呈线性负相关关系[11],可以应用于生物毒性检测。除了降解多糖、固氮及发光能力外,以霍乱弧菌、创伤弧菌(V.vulnificus)、副溶血弧菌(V.parahaemolyticus)、溶藻弧菌(V.alginolyticus)为主的部分海洋弧菌还具有致病性,不仅会对水产养殖业造成危害,也可通过食物链威胁人类健康[12-15]。海洋弧菌群落结构及其多样性研究,对海洋弧菌资源高值化利用和致病性海洋弧菌爆发预警具有重要意义。
广西北部湾位于我国沿海西南端,总面积约20 000 km2,平均水深约45 m,有多条河流汇入,营养物质通过河流汇入广西北部湾海域河口地区[16,17],使广西北部湾成为了生物富集的区域。广西北部湾海洋弧菌多样性研究,对揭示海洋弧菌种群的生态功能和致病性海洋弧菌爆发灾害预警机制至关重要。本文根据相关研究结果,从群落结构特征、环境驱动因子、群落构建机制等方面综述了广西北部湾海洋弧菌多样性的研究进展。
1 广西北部湾可培养海洋弧菌多样性
近年来,噬菌体(Bacteriophage)[18]、蛭弧菌(Bdellovibrio and Like Organisms,BALOs)等[19]微生物菌剂已应用于海洋弧菌病害防治。为了研究海洋弧菌毒力因子及致病机理,人们仍需从海洋环境中分离培养海洋弧菌[20-23]。因此,可培养海洋弧菌的分类鉴定仍是研究热点之一。基于细菌表型的分类学已不适用于现代的细菌分类鉴定的需要[24]。近年来,随着分子生态学技术迅速发展,核酸杂交分析技术[25]、DNA 序列分析[26]、聚合酶链式反应(Polymerase Chain Reaction,PCR)等[27]研究方法,已应用于广西北部湾海洋弧菌分离鉴定。广西疾病与控制中心李秀桂等[28]采用酶触实验方法从广西北部湾海域的牡蛎样本中检测出高丰度的创伤弧菌。韦强等[29]采用随机扩增多态性DNA 标记(Random Amplified Polymorphic DNA,RAPD)技术,对广西北部湾部分海产品中分离获得的24 株副溶血弧菌进行基因分型研究,结果发现广西北部湾副溶血弧菌种群间具有较高的遗传多样性。广西科学院余庆等[30]通过16S rRNA 基因测序对4 株病原菌株进行分离鉴定,根据其表型特征、分子生物学特征和进化关系,判定4 株病原菌株均为溶藻弧菌。南宁师范大学唐金利等[31]基于toxR基因对广西北部湾茅尾海副溶血弧菌进行致病性分析,结果表明,致病性副溶血弧菌的检出率为18.3%。Wang等[32]基于16S rRNA 基因测序技术,在广西北部湾钦州湾检测出哈维氏弧菌(V.harveyi)和沙蚕弧菌(V.nereis)。2019 年,陈博文等[33]于广西北部湾钦州、防城港、北海等沿海地区采集海水、海沙和红树林根际泥土样本,分离获得需钠弧菌(V.natriegens)。Chen 等[34]从广西北部湾茅尾海、钦州湾和北部湾外湾采集海水和生物样本,共分离得到1 037 株弧菌菌株,鉴定出18 种海洋弧菌。据文献报道[3,28-31,34],已知的弧菌包括8 个属,共计160 余种。目前,在广西北部湾共发现可培养海洋弧菌共40 种,主要来源于表层海水、沉积物等(图1,表1)。其中,表层海水中的海洋弧菌物种最多,溶藻弧菌、副溶血弧菌和创伤弧菌则主要来源于牡蛎样品。此外,也有研究发现,从广西北部湾收集的菌株中,存在与已知海洋弧菌序列相似性低于97%的菌株,表明广西北部湾海域可能存在着新的弧菌物种[1,3]。因此,加大可培养海洋弧菌分类鉴定的研究力度,对进一步了解广西北部湾海洋弧菌多样性和揭示海洋弧菌致病机理至关重要。

表1 广西北部湾已发现的可培养海洋弧菌Table 1 Marine cultivable Vibrio found in Guangxi Beibu Gulf.
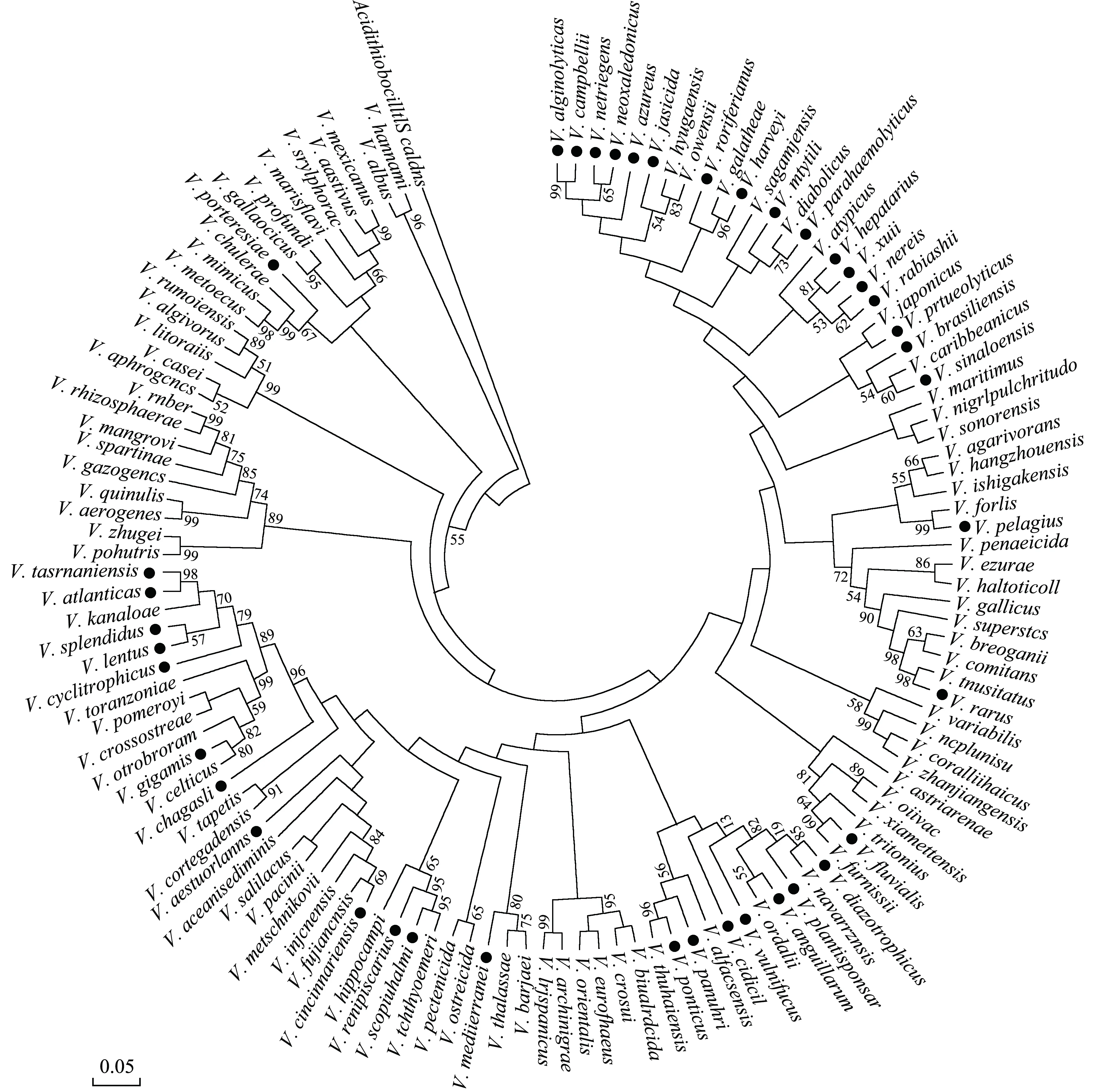
图1 基于邻接法的可培养弧菌16S rRNA 基因序列系统发育树Fig.1 Phylogenetic tree of marine culturable Vibrio 16S rRNA gene sequences based on neighbor-joining criterion
2 广西北部湾海洋弧菌群落结构
细菌在不利环境条件下,如高温[35]、高盐[36]、缺氧[37]等,可进入“活的非可培养(Viable But Nonculturable,VBNC)”状态[38,39]。在这种状态下,细菌能保持代谢活性,但不可在培养基上培养或增殖[40]。据研究报道,海洋弧菌在一定环境胁迫条件下,也可进入VBNC 状态[41]。迄今为止,已发现的可进入VBNC 状态的细菌有80 余种,其中海洋弧菌约20 种[42],约占1/4。在广西北部湾已发现的海洋弧菌中,可进入VBNC 状态的有9 种,分别为鳗弧菌(V.anguillarum)、溶藻弧菌、坎贝氏弧菌(V.campbellii)[3,38]、辛辛那提弧菌(V.cincinnatiensis)[43]、哈维氏弧菌、需钠弧菌、解蛋白弧菌(V.proteolyticus)、创伤弧菌和副溶血弧菌[3,38]。传统的纯培养方法难以检测到VBNC 状态下的海洋弧菌,所以海洋弧菌多样性研究也因此受到了限制。
随着现代生物技术的快速发展,目前,高通量测序技术因其检测速度快、通量高等优点[44],已被广泛应用于海洋弧菌多样性研究。近期,也有学者采用弧菌16S rRNA 基因特异性引物,结合高通量测序方法对广西北部湾海洋弧菌群落结构组成及多样性展开研究[1,3,34,45],结果揭示广西北部湾海洋弧菌多样性在不同海域和季节存在显著差异,营养盐为主要驱动因子。
2.1 广西北部湾海洋弧菌群落组成与多样性
陈星等[34]从广西北部湾茅尾海采集不同季度表层海水样品,采用弧菌16S rRNA 基因特异性引物,应用高通量测序方法对海洋弧菌群落结构组成进行研究。结果表明,茅尾海海洋弧菌群落结构存在显著的季节性差异。其中,夏季海洋弧菌的α多样性显著高于其他季节。河弧菌(V.fluvialis)、长牡蛎弧菌(V.gigantis)、河口弧菌(V.aestuarianus)、需钠弧菌、植物根弧菌(V.planttisponsor)、解蛋白弧菌与副溶血弧菌是茅尾海海域的优势类群[34]。β多样性分析表明,夏季海洋弧菌群落结构与其他的季节存在较大差异。李楠等[45]于茅尾海、钦州湾、钦州外湾、广西北部湾外海、防城湾、雷州半岛、北海市近岸海域、涠洲岛附近八个海域共42 个站点采集126 个样本,利用弧菌16S rRNA 基因特异性引物和高通量测序方法,研究了广西北部湾高度富营养化、中度富营养化和寡营养盐海域的海洋弧菌多样性。结果表明海洋弧菌在高度富营养化海域(茅尾海海域)多样性最高,而在寡营养盐海域(远岸海域)多样性最低且不同海域的弧菌群落结构呈现极显著差异[45]。此外,海神弧菌(V.neptunius)、坎贝氏弧菌和托兰佐氏弧菌(V.toranzoniae)丰度最高,分别占弧菌群落组成的34.21%、22.02%和7.77%[45]。上述研究从群落水平上对广西北部湾海洋弧菌群落特征进行研究,也有学者针对广西北部湾海域单个海洋弧菌种分布特征展开研究。李秀桂等[28]采用最大或然数法(Most Probable Number,MPN)检测广西北部湾海域牡蛎中创伤弧菌的污染水平,发现创伤弧菌的检出率具有显著的季节性差异,其中夏季的检出率最高。对广西北部湾海洋弧菌群落结构特征的研究,有利于揭示海洋弧菌对环境变化的响应机制。
2.2 广西北部湾海洋弧菌群落结构关键控制因子
以往研究表明,海洋弧菌的分布受温度、盐度及氮、磷等营养元素调控[46-48]。2020 年,南宁师范大学李楠等[45]研究了广西北部湾海洋弧菌多样性对海洋富营养化的响应机制,发现海洋富营养化显著改变海洋弧菌群落的α和β多样性。铵盐、硝酸盐和可溶磷分别是影响高度富营养化、中度富营养化和寡营养盐海域海洋弧菌群落结构的关键因子。陈星等[1]对广西北部湾茅尾海海洋弧菌群落结构季节性变化进行了研究,结果发现温度、盐度、总溶解氮、溶解性无机氮和总溶解磷是影响广西北部湾茅尾海海洋弧菌群落结构组成的主要影响因子。通过方差分解分析(Variance Partitioning Analysis,VPA),发现营养盐(总溶解氮、溶解性无机氮、总溶解磷等)是影响茅尾海海洋弧菌群落结构变化的主要因素[1]。这可能是由于广西北部湾海域长期受到来自人类生产活动的扰动,众多河流(如钦江、茅岭江等)将大量营养物质汇集于此,加剧了水体的富营养程度,从而对海洋弧菌群落结构与多样性产生显著影响。因此,笔者认为,深入了解广西北部湾海洋弧菌与环境因子之间的响应机制,可为进一步揭示海洋弧菌群落的生态功能多样性提供重要线索。
3 广西北部湾海洋弧菌群落构建机制
群落构建(Community Assembly)过程是生态学研究热点之一。群落构建是确定性过程(Deterministic Processes)和随机过程(Stochastic Processes)共同作用的结果[49]。确定性过程主要强调了物种种间相互作用以及温度、盐度、pH 值等环境条件对群落结构产生的影响;而随机过程着重于出生、死亡等随机事件对群落结构造成的影响。目前,广西北部湾海洋弧菌群落的构建机制也取得了相关研究进展。Li 等[45]于广西北部湾不同营养水平海域采集海水样品,对海洋弧菌群落构建过程进行研究。研究结果表明,广西北部湾海洋弧菌群落构建机制由随机过程主导,最主要的过程为生态漂移(Ecology Drift)。在高度富营养化样本组中,均质扩散(Homogenizing Dispersal)占主导地位,但在中度富营养化和寡营养化样本组中,生态漂移是最主要的过程。通过广西北部湾海洋弧菌群落构建机制的研究,可以进一步揭示海洋弧菌多样性及其生态功能,对广西北部湾海域生态预警和生物资源高值化利用具有重要意义。
4 结论与展望
海洋弧菌是广西北部湾海洋细菌优势类群,开展海洋弧菌多样性研究对揭示海洋弧菌与地球生物化学循环过程的耦合机制及预防致病性海洋弧菌爆发具有重要意义。大量研究表明,北部湾海洋弧菌多样性较为丰富。在广西北部湾海域,共检测出了40 种可培养海洋弧菌。广西北部湾海洋弧菌多样性在不同海域和季节存在显著差异。营养盐是广西北部湾海洋弧菌群落结构的主要驱动因子。广西北部湾海洋弧菌群落构建过程由随机过程主导。
海洋弧菌生态学研究仍在不断发展,海洋弧菌的分离鉴定技术也在不断更新。结合多组学研究手段,阐明广西北部湾海域不同生境中的海洋弧菌群落结构与多样性及其与元素循环过程之间的耦合机制,是未来北部湾海洋弧菌多样性研究的重要方向之一,这将为该海域渔业健康发展以及生物资源高值化利用提供科学依据。

