智能运动康复训练仪对急性心肌梗死经皮冠状动脉介入术后患者心肺功能和心室重构的影响
汪微微,王晶晶,米亚非
浙江省台州医院 (浙江临海 317000)
急性心肌梗死(acute myocardial infarction,AMI)是心内科常见的急重症,主要表现为持久的胸骨后疼痛。如不及时治疗,患者可出现心力衰竭、恶性心律失常、休克或猝死等并发症[1]。经皮冠状动脉介入(percutaneous coronary intervention,PCI)是治疗AMI 患者的首选手段,能在较短时间内恢复AMI 患者的心肌血供,降低其病死率,但术后患者易出现心室重构,影响心肺功能[2]。近年来,循证医学证据表明,运动训练可显著改善缺血性心脏病患者的预后[3]。智能运动康复训练仪是一种智能化的下肢康复训练系统,具有类似脚踏车运动的连续旋转运动训练模式,逐渐被应用于AMI 介入术后患者中,并取得了较好的效果[4]。基于此,本研究旨在探讨智能运动康复训练仪对AMI 介入术后患者心肺功能和心室重构的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2018 年9 月至2021 年2 月于浙江省台州医院住院治疗的78 例AMI 介入术后患者为研究对象,采用随机双盲法分为对照组与试验组,各39 例。对照组男24 例,女15 例;年龄41~85 岁,平均(64.91±5.78)岁;病程3~11 h,平均(5.51±0.69)h;其中,冠脉病单支病变24 例,多支病变15 例。试验组男22 例,女17 例;年龄42~86 岁,平均(65.16±5.23)岁;病程4~12 h,平均(5.46±0.74)h;其中,冠脉病单支病变21 例,多支病变18 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:符合《急性心肌梗死诊断和治疗指南》中AMI 诊断标准[5];经冠状动脉造影证实;患者有行急诊PCI 治疗的指征;术后生命体征平稳。排除标准:以往有明显的心肺疾病;有溶栓、PCI治疗、冠脉搭桥史;PCI 治疗后生命体征不稳定。
1.2 方法
对照组术后予日常活动干预:术后第2 天,嘱患者卧床休息,指导患者进行肢体关节被动运动,包括肩、肘、腕、踝、膝及手指等部位,10~20 min/次,3 次/d;术后第3 天,嘱患者下床活动,进行床边站立、搀扶行走等训练;术后第3~4 天,嘱患者开展室内步行锻炼,3~5 min/次;术后第5~7 天,嘱患者进行上、下楼梯训练。
试验组术后在对照组基础上应用智能运动康复训练仪(南京康龙威科技实业有限公司,型号:KLW-SKF4)干预。应用扎带固定患者双下肢,用小腿支架支撑下肢,选择心肺模式。设定参数:频率为50 Hz,转速20 r/min,阻力等级5 级,并在干预过程中逐渐提高转速及阻力等级。30 min/次,2~3 次/周。
两组均连续干预8 周。
1.3 评价指标
(1)心肺功能:干预前后,采用心肺功能测定仪(瑞士席勒公司,型号:CS-200)进行评估,包括最大摄氧量(maximal oxygen consumption,VO2max)、最大每搏摄氧量(maximal oxygen consumption/heart rate,VO2max/HR)和最大代谢当量(maximum metabolic equivalent,METmax)。(2)心室重构指标:干预前后,采用心脏彩超(德国西门子公司,型号:SC2000)进行测量,包括左心室射血分数(left ventri cular ejection fraction,LVEF)、 左 心室收缩末期容积(left ventricle end systolic volume,LESV)、左心室舒张末期容积(left ventricular end diastolic volume,LEDV)和左心室短轴缩短率(shortening rate of short axis of left ventricle,FS)。
1.4 统计学处理
采用SPSS 18.0 统计软件进行数据处理,计量资料以±s表示,采用t检验。计数资料以率表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 心肺功能
干预前,两组VO2max、VO2max/HR 和METmax比较,差异无统计学意义(P>0.05);干预后,两组VO2max、VO2max/HR 和METmax均高于干预前,且试验组高于对照组(P<0.05),见表1。
表1 两组干预前后VO2max、VO2max/HR和METmax 比较(±s)
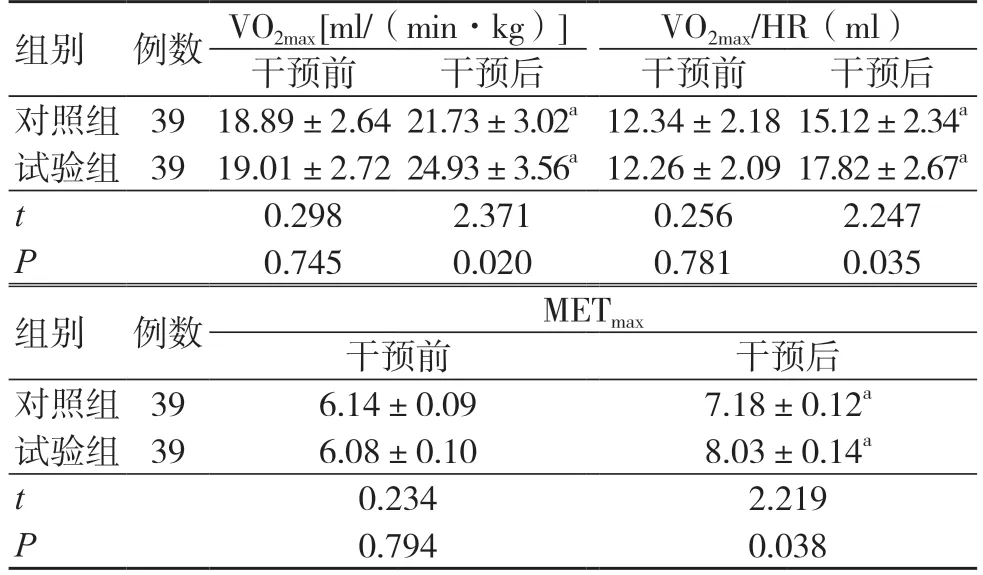
表1 两组干预前后VO2max、VO2max/HR和METmax 比较(±s)
注:与同组治疗前比较,aP<0.05;VO2max 为最大摄氧量;VO2max/HR 为最大每搏摄氧量;METmax 为最大代谢当量
组别 例数 VO2max [ml/(min·kg)] VO2max/HR(ml)干预前 干预后 干预前 干预后对照组 39 18.89±2.64 21.73±3.02a 12.34±2.18 15.12±2.34a试验组 39 19.01±2.72 24.93±3.56a 12.26±2.09 17.82±2.67a t 0.298 2.371 0.256 2.247 P 0.745 0.020 0.781 0.035组别 例数 METmax干预前 干预后对照组 39 6.14±0.09 7.18±0.12a试验组 39 6.08±0.10 8.03±0.14a t 0.234 2.219 P 0.794 0.038
2.2 心室重构指标
干预前,两组LVEF、LESV、LEDV 和FS 比较,差异无统计学意义(P>0.05);干预后,两组LVEF 和FS 均高于干预前,LESV 和LEDV 均低于干预前,且试验组LVEF 和FS 均高于对照组,LESV 和LEDV 均低于对照组(P<0.05),见表2。
表2 两组干预前后LVEF、LESV、LEDV和FS 比较(±s)
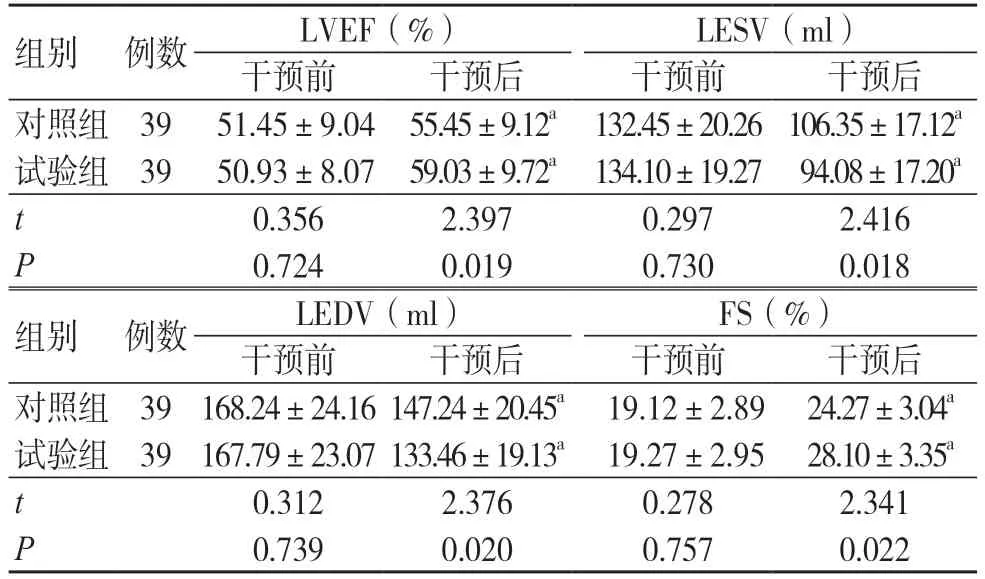
表2 两组干预前后LVEF、LESV、LEDV和FS 比较(±s)
注:与同组治疗前比较,aP <0.05;LVEF 为左心室射血分数;LESV 为左心室收缩末期容积;LEDV 为左心室舒张末期容积;FS 为左心室短轴缩短率
组别 例数 LVEF(%) LESV(ml)干预前 干预后 干预前 干预后对照组 39 51.45±9.04 55.45±9.12a 132.45±20.26 106.35±17.12a试验组 39 50.93±8.07 59.03±9.72a 134.10±19.27 94.08±17.20a t 0.356 2.397 0.297 2.416 P 0.724 0.019 0.730 0.018组别 例数 LEDV(ml) FS(%)干预前 干预后 干预前 干预后对照组 39 168.24±24.16 147.24±20.45a 19.12±2.89 24.27±3.04a试验组 39 167.79±23.07 133.46±19.13a 19.27±2.95 28.10±3.35a t 0.312 2.376 0.278 2.341 P 0.739 0.020 0.757 0.022
3 讨论
随着心血管介入医学的不断发展,PCI 术已成为AMI 的主要治疗方法,但术后易发生心脏收缩舒张功能异常,进而诱发心力衰竭、恶性心律失常或心源性猝死等心血管不良事件[6]。由于PCI 术中仅将狭窄的罪犯血管进行疏通恢复血流,并不能根除AMI 患者冠状动脉斑块的病理基础,难以从而根本上逆转动脉斑块发生、发展的进程;同时,由于PCI 术无法修复已发生坏死的心肌组织,且易出现心肌再灌注损伤,术后患者可因非梗死区及梗死区纤维组织增生,进一步引起心肌纤维化和心室重构,影响患者心肺功能的恢复,甚至可引发血栓、冠脉再狭窄等并发症[7]。
近年来,运动锻炼对心肌梗死后心脏的保护效应及相关机制是心脏运动康复的研究热点[8-9]。研究表明,运动训练可减轻左心室重塑作用,提高心肌细胞线粒体能量供应,加快心脏血管的舒张,有利于微血管的再生,从而实现对梗死心脏的保护作用,并可在降低心血管病病死率及改善患者生命质量等方面获得确切受益[10-11]。智能运动康复训练仪是一种智能化的模拟康复运动仪器,主要通过完全的模拟人体运动增加全身肌力,不仅可提高机体的基础代谢率,达到增加运动耐力及提高生命质量目的,同时可提高心脏前后压力负荷,促进人体的血液循环供应,从而维持心肌氧供需的平衡,改善患者的心血管机能[4,12]。本研究结果显示,干预后,试验组VO2max、VO2max/HR 和METmax均高于对照组(P<0.05);干预后,试验组LVEF 和FS 均高于对照组,LESV 和LEDV 均低于对照组(P<0.05)。表明智能运动康复训练仪不仅可提高AMI 介入术后患者的心肺功能,且可改善其心室重构。分析其原因可能为,智能运动康复训练仪通过提升患者心脏压力负荷,可促进血液循环,增加心肌供氧量,改善术后心肌能量代谢,提高线粒体功能,从而可在一定程度上改善或逆转心室重构过程,提高患者心肺功能[13-14]。
综上所述,智能运动康复训练仪不仅可提高AMI介入术后患者的心肺功能,而且可改善其心室重构。

