低氧对炎性环境下髓核细胞凋亡的作用及机制
李 磊 ,王一范2,施强慧,钟华建,曹佳实
1.温州医科大学附属衢州医院(衢州市人民医院)骨科,衢州 324000
2.海军军医大学长征医院健康管理科,上海 200003
3.中国人民解放军63680 部队医院骨科,江阴 214400
4.海军军医大学长征医院骨科,上海 200003
5.海军军医大学海军特色医学中心,上海 200433
椎间盘是脊柱内包含髓核、纤维环及软骨终板的“三明治”结构,与相邻椎体组成脊柱运动单元,在维持脊柱稳定性及活动度中发挥重要作用[1]。椎间盘退行性变表现为炎性反应,髓核细胞凋亡,细胞外基质代谢紊乱,神经、血管长入椎间盘等,其中炎性反应尤为重要[2-3]。退行性变早期,炎性反应由髓核组织中的髓核细胞或免疫细胞引发,通过增加促炎因子分泌诱导髓核细胞凋亡、细胞外基质降解等,加剧椎间盘退行性变进程;退行性变晚期血管长入椎间盘,循环血液中免疫细胞被募集至椎间盘,进一步加剧炎性反应[4]。
椎间盘是人体内最大的无血管区域,其氧气供应依赖于附着在软骨终板和纤维环外层的毛细血管网,循环血液携带的氧分子通过毛细血管网经椎体终板的渗透作用运输至椎间盘[5],导致椎间盘内(尤其髓核区域)形成生理性低氧环境。当椎间盘发生退行性变时,软骨终板钙化进一步削弱髓核区域的氧供[6],同时,低氧可诱导附着在纤维环外围的毛细血管向椎间盘内部生长,当血管穿透纤维环蔓延至髓核区域时,循环血液中的氧分子可直接进入椎间盘内部,影响低氧环境,该阶段患者通常会出现颈腰痛等临床症状,提示椎间盘退行性变发展至病程晚期[7]。因此,椎间盘内部髓核组织从健康到退行性变中晚期均处于低氧环境,为进一步探究椎间盘退行性变的生物学过程,须明确低氧与炎性反应的相互作用及对髓核细胞的影响。NLRP3 炎性小体是目前已知炎性小体中研究最为透彻的一种,对炎性反应启动具有重要作用,其对椎间盘退行性变的促进作用已基本明确[8]。本研究拟通过体外实验,对大鼠原代髓核细胞施加低氧和炎性刺激双重干预,观察髓核细胞凋亡及NLRP3 炎性小体改变,为阐明低氧对炎性环境下髓核细胞的影响及作用机制提供依据。
1 材料与方法
1.1 试剂
NLRP3 抗体(ab270449)、促炎因子白细胞介素-1β(IL-1β)抗体(ab254360)、Caspase-1 抗体(ab207802)、Caspase-3 抗体(ab13585)、BAX 抗体(ab32503)、Bcl-2 抗体(ab182858)均购自Abcam公司;IL-1β 购自Peprotech 公司,NLRP3 炎性小体激活剂QS-21(HY-101092)购自MedChemExpress公司;大鼠IL-1β ELISA 试剂盒(ab235646)、大鼠IL-18 ELISA 试剂盒(ab213909)购自Abcam 公司,大鼠IL-8 ELISA 试剂盒(ml037351)购自上海酶联生物科技有限公司,Annexin V FITC/PI 流式凋亡试剂盒(APCC101)购自杭州联科生物技术股份有限公司,TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(RR820A)及反转录试剂盒(RR047A)购自TaKaRa 公司,TUNEL 细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。CCK-8 试剂盒(CK04)购自日本同仁化学研究所。
1.2 髓核细胞分离和培养
采用大鼠原代髓核细胞进行实验,髓核细胞提取参照Risbud 等[9]的方法。经分离、消化后获得的髓核细胞采用含10%胎牛血清(Gibco 公司)的DMEM 高糖培养基制备细胞悬液并均匀铺在T25 细胞培养瓶中,置于常规细胞培养箱培养,72 ~ 96 h后更换细胞培养基,之后每3 d更换一次培养基,待细胞生长至约80%汇合时进行铺板、传代或冻存,取2 ~ 3 代的髓核细胞进行实验。
1.3 细胞干预
①采用MIC101低氧密闭小室(Billups-Rothenberg公司)进行低氧干预,将髓核细胞置于小室中并关闭小室,留有进、出气管道,将三元气(1%氧气、5%二氧化碳和94%氮气)经进气孔输注到低氧小室,5 min后,待小室内空气全部被三元气置换后关闭小室进、出气管道,使小室内维持密闭状态,干预24 ~72 h。干预结束后,采用CCK-8 法检测细胞活性,采用流式细胞术及TUNEL 染色检测细胞凋亡情况,采用蛋白质印迹法检测凋亡相关蛋白表达水平。②采用25 ng/mL 的促炎因子肿瘤坏死因子-α(TNF-α)干预髓核细胞模拟椎间盘退行性变时髓核细胞所处的炎性环境,同时施加低氧或常氧干预24 ~ 72 h,采用上述相应方法检测髓核细胞活性及凋亡水平。③采用TNF-α 联合低氧或常氧干预髓核细胞48 h,以低氧或常氧干预48 h 的髓核细胞作为对照,通过实时荧光定量PCR 检测髓核细胞内炎性因子白细胞介素(IL)-1β、IL-8、IL-18 mRNA 表达水平,通过ELISA 检测细胞上清中炎性细胞因子含量,通过蛋白质印迹法检测NLRP3 炎性小体相关蛋白NLRP3、Caspase-1、IL-1β 表达水平。④采用NLRP3 炎性小体激动剂QS-21 刺激炎性环境下髓核细胞,并置于常氧或低氧条件下干预48 h,通过流式细胞术及TUNEL 染色检测细胞凋亡情况,采用蛋白质印迹法检测凋亡相关蛋白表达水平。
1.4 检测方法
①蛋白质印迹法:预冷PBS 缓冲液洗涤髓核细胞2 遍,加入含有蛋白酶抑制剂的RIPA 裂解液,冰上反应10 min 后用细胞刮收集细胞及细胞裂解液,离心取上清,即得蛋白液;取部分蛋白液经BCA 法测定蛋白浓度;剩余蛋白液加入上样缓冲液,95℃加热5 min;根据蛋白浓度计算各组蛋白上样体积,根据目的蛋白分子量配制相应浓度SDS-PAGE胶,进行上样、电泳、转膜、封闭,孵育一抗、二抗,ECL 显影后观察,通过条带灰度值计算目的蛋白相对表达量。②实时荧光定量PCR:采用总RNA 提取试剂盒(DP419,Tiangen 公司)提取细胞总RNA,测定浓度后取2 μg RNA 添加到反转录体系中合成样本cDNA。随后配制20 μL 的反应体系,包含cDNA 模板、目的基因特异性PCR 引物、灭菌水和TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(RR820A)。PCR反应条件:95℃ 30 s、95℃ 5 s、60℃ 10 s、72℃ 25 s,40 个循环。采用2-△△Ct法计算目的基因的相对表达量。③CCK-8、流式细胞术、TUNEL和ELISA:根据试剂盒说明书进行操作。
1.5 统计学处理
采用Graphpad 9.0 软件对数据进行统计分析,符合正态分布的计量资料以±s表示,采用 Studentt检验或单因素方差分析进行比较;以P< 0.05为差异有统计学意义。
2 结 果
2.1 低氧对正常环境下髓核细胞凋亡无显著影响
与常氧组相比,低氧组髓核细胞在干预24 ~ 72 h后活性无明显变化(图1a)。随着干预时间延长,常氧组和低氧组髓核细胞凋亡率逐渐增加,72 h 时凋亡细胞比例与24 h 相比,差异均有统计学意义(P< 0.05,图1b、c);细胞内凋亡相关蛋白Cleaved caspase-3 和BAX 表达水平逐步升高、Bcl2 表达水平逐步降低,48 h、72 h 时与24 h 相比,差异均有统计学意义(P< 0.05,图1d、e);TUNEL 染色阳性细胞占比逐渐增加,72 h 时与24 h 时相比,差异有统计学意义(P< 0.05,图1f、g)。值得注意的是,各时间点上述指标常氧组和低氧组之间相比,差异无统计学意义(P> 0.05),说明正常环境下髓核细胞凋亡与氧浓度无关,即低氧对正常髓核细胞凋亡无明显影响。
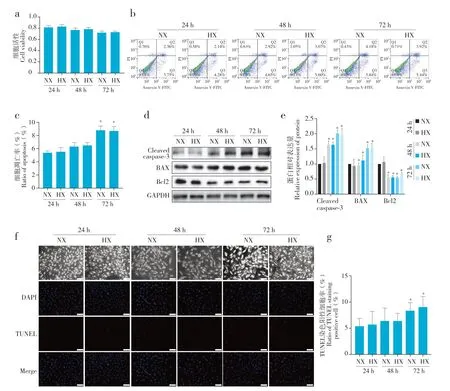
图1 低氧对正常环境中髓核细胞凋亡影响Fig. 1 Effect of hypoxia on nucleus pulposus cell apoptosis in normal condition
2.2 低氧抑制炎性环境下髓核细胞凋亡
随着炎性刺激时间延长,常氧组髓核细胞活性降低(图2a),凋亡比例增加(图2b、c),凋亡相关蛋白Cleaved caspase-3 和BAX 表达水平升高、Bcl2表达水平降低(图2d、e),TUNEL 染色阳性细胞占比增加(图2f、g),48 h、72 h 时与24 h 时相比,差异均有统计学意义(P< 0.05)。低氧组髓核细胞上述指标随炎性刺激时间变化不明显。与常氧组相比,各时间点低氧组髓核细胞活性高,凋亡比例低,凋亡相关蛋白Cleaved caspase-3 和BAX 表达水平低,Bcl2 表达水平高,TUNEL 染色阳性细胞占比少,差异均有统计学意义(P< 0.05),说明低氧对炎性环境下髓核细胞凋亡具有抑制作用。
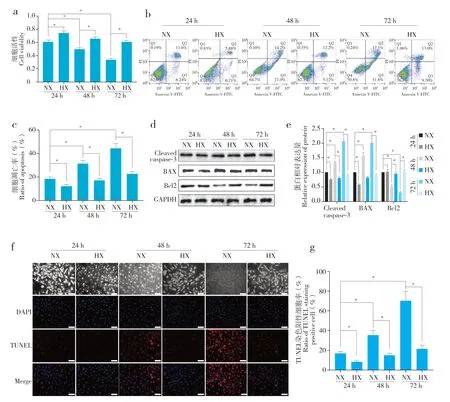
图2 低氧对TNF-α诱导的炎性环境下髓核细胞凋亡影响Fig. 2 Effect of hypoxia on nucleus pulposus cell apoptosis in inflammatory environment induced by TNF-α
2.3 低氧抑制炎性环境下髓核细胞内NLRP3 炎性小体激活
未施加炎性刺激的低氧和常氧组髓核细胞表达及分泌的炎性细胞因子均处于低水平,组间差异无统计学意义(P> 0.05);TNF-α刺激48 h 后,常氧组髓核细胞表达及分泌的IL-1β、IL-8、IL-18 均升高,而低氧组髓核细胞仍处于较低水平(图3a ~ f),说明炎性环境下髓核细胞内炎性反应激活,而低氧对该激活过程具有阻碍作用。通过蛋白质印迹法检测NLRP3 炎性小体相关蛋白NLRP3、Caspase-1、IL-1β 的表达水平,结果显示,炎性环境下髓核细胞内NLRP3、Caspase-1、IL-1β 表达增加,而低氧干预能够削弱炎性环境所诱发的NLRP3 炎性小体相关蛋白表达(图3g、h),提示低氧可抑制炎性环境下髓核细胞内NLRP3炎性小体激活。

图3 低氧对炎性环境下髓核细胞内NLRP3 炎性小体激活的影响Fig. 3 Effect of hypoxia on NLRP3 inflammasome activation of nucleus pulposus cell in inflammatory environment
2.4 低氧通过NLRP3 炎性小体抑制炎性环境下髓核细胞凋亡
在炎性环境下,使用NLRP3 炎性小体激动剂QS-21激活NLRP3炎性小体后,常氧组髓核细胞凋亡比例无明显变化,而低氧组髓核细胞细胞凋亡比例增加(P< 0.05,图4a、b);常氧组Cleaved caspase-3和BAX 蛋白表达无明显变化、Bcl2 蛋白表达降低,而低氧组Cleaved caspase-3 和BAX 蛋白表达升高、Bcl2 蛋白表达降低(图4c、d);常氧组TUNEL 染色阳性细胞占比无明显变化,而低氧组TUNEL染色阳性细胞占比增高(图4e、f)。以上结果说明NLRP3炎性小体激活能够削弱低氧对炎性环境下髓核细胞凋亡的抑制作用,提示NLRP3 炎性小体在低氧调控炎性环境下髓核细胞凋亡中发挥重要作用。
3 讨 论
氧气是真核细胞通过氧化磷酸化产生足量ATP,维持细胞活性的重要物质[10]。由于椎间盘内无血管生长,髓核细胞处于生理性低氧环境,导致其主要通过无氧糖酵解获取ATP[11]。低氧作为椎间盘内最为重要的微环境特征,对髓核细胞具有多重影响,如Kim 等[12]发现低氧可通过调控髓核细胞自噬和凋亡维持细胞活性,Silagi 等[13]证实低氧可通过低氧诱导因子调控髓核细胞能量代谢、维持髓核细胞自身稳态,Novais 等[14]发现低氧可调控内质网应激,影响髓核细胞外基质成分表达及分泌。以上研究体现低氧对髓核细胞的重要调控作用,但均是针对低氧开展的单因素研究。髓核组织微环境复杂多样,单因素体外研究无法有效模拟疾病进程,导致体外研究结果难以在体内获得进一步验证。因此,联合多个因素,分析彼此相关性及对髓核细胞的影响是提升椎间盘退行性变体外研究可靠性的重要方法。截止目前,相应研究报道较少,Wang等[15]通过低氧和血清剥夺2 种干预方式探索低氧和低营养对髓核细胞外基质代谢的影响及二者之间的关系,发现低氧显著缓解低营养导致的细胞外基质降解。低氧和低营养均是椎间盘生理环境的重要特征,故该研究初步阐明正常椎间盘微环境相互作用及对髓核细胞的影响;而发生退行性变的椎间盘微环境相互作用的研究暂未见报道。
相较于正常椎间盘,发生退行性变的椎间盘微环境突出表现为炎性反应和代谢废物的积聚,导致髓核组织中炎性细胞因子IL-1、TNF-α、IL-6、IL-8、前列腺素 E2(PGE2)等表达及分泌增加[16]。炎性反应可能是引发椎间盘退行性变患者颈腰痛症状的关键因素,Pedersen 等[17]发现,腰椎椎间盘突出症患者的腰痛症状与其血清内IL-6 及IL-8 含量密切相关;Krock 等[18]进一步研究发现,IL-8 可作为抗炎治疗靶点用于缓解椎间盘退行性变患者颈腰痛症状。以上研究均说明炎性反应对椎间盘退行性变影响重大,是椎间盘退行性变的重要病理反应,而低氧是贯穿椎间盘生理到病理状态的微环境特征。为探索低氧在发生退行性变的椎间盘内的作用,本研究针对低氧和炎性反应相互作用及对髓核细胞的影响进行研究,发现低氧对正常髓核细胞活性无明显影响,而对炎性刺激诱导发生退行性变的髓核细胞具有保护效应,突显低氧在发生退行性变的椎间盘内的重要作用。
关于低氧与炎性反应相互作用的研究在人体其他疾病中报道较多。有研究[19]发现,低氧可促进炎性反应发生,而炎性反应进一步加剧氧含量的丢失,二者呈相互促进关系。然而,近期基于基因敲除小鼠的炎性肠病相关研究结果显示,低氧有助于小鼠肠道黏膜炎性反应的恢复[20-21],提示低氧对炎性反应具有双重作用,可能受作用部位影响[22]。椎间盘发生退行性变时,低氧与炎性反应同时存在,本研究基于大鼠髓核细胞开展体外实验,发现低氧可保护炎性环境下髓核细胞免于凋亡,进一步研究发现低氧通过抑制NLRP3 炎性小体激活而抑制髓核细胞凋亡。
炎性小体是细胞启动炎性反应的发动机,炎性小体的组装或激活失调将导致人体多种疾病发生。目前研究较多的炎性小体包括NLRP1、NLRP3、NLRC4 和AIM2,其中NLRP3 研究最为广泛。NLRP3 与炎性反应、细胞外基质降解、髓核细胞凋亡等密切相关,深刻影响椎间盘退行性变进程[8]。此外,NLRP3 在其他疾病研究中被证实受低氧调控,Cosin-Roger 等[23]发现低氧通过抑制NLRP3 炎性小体及下游自噬活性缓解肠道炎性反应,Yang等[24]发现低氧可促进人牙龈成纤维细胞中NLRP3炎性小体激活,说明低氧对NLRP3 及炎性反应的调控具有多样性。本研究发现,低氧对NLRP3 炎性小体激活具有抑制效应,在调控炎性环境下髓核细胞凋亡中作用显著。值得一提的是,本研究使用QS-21激活炎性环境下低氧及常氧组髓核细胞内NLRP3炎性小体活性后,仅促进低氧组髓核细胞凋亡,而对常氧组髓核细胞凋亡无明显影响。该结果提示,在炎性环境下,常氧组髓核细胞内NLRP3 炎性小体活性足够维持炎性反应,QS-21 进一步活化NLRP3炎性小体对炎性反应影响甚微,因而髓核细胞凋亡无明显变化;而低氧组髓核细胞因NLRP3 炎性小体活性受低氧抑制,炎性反应启动受阻,QS-21 活化NLRP3 炎性小体后释放炎性反应活性,导致髓核细胞凋亡增加。
综上,本研究通过体外研究,针对髓核组织特征性低氧和椎间盘退行性变时炎性反应之间的相互作用及对髓核细胞凋亡的影响展开探索,发现低氧可通过抑制NLRP3 炎性小体激活缓解炎性环境下髓核细胞凋亡,突显低氧在椎间盘退行性变进程中的保护作用。

