基于网络和组学方法的产电微生物胞外电子传递研究进展
丁德武, 张 鵾, 何小青, 谢建明
(1. 宜春学院数学与计算机科学学院, 宜春 336000;2. 池州学院材料与环境工程学院, 池州 247000;3. 东南大学生物科学与医学工程学院, 南京 210096;4. 东南大学生物电子学国家重点实验室, 南京 210096)
厌氧条件下,某些微生物能够将它们细胞内新陈代谢过程中产生的电子传递到细胞外,还原胞外电子被称为受体并产生能量维持其自身生长。通常,这一过程被称为胞外电子传递(extracellular electron transfer,EET);这些微生物被称为产电微生物[1]。一般认为,产电微生物的EET过程对地球环境中碳、氮、硫、铁、锰等元素的循环产生重要影响[2]。EET能力也使产电微生物成为生物电化学系统的重要研究对象,在能源生产、废水处理、生物修复与化学合成等众多领域有着广泛应用[3]。例如,在能源生产方面,产电微生物可以通过与电极相互作用,把电子传递到电极上,从而产生电流输出,即微生物燃料电池(microbial fuel cells,MFC)。Logan等[4]关于同步微生物产电和污水处理的研究实现了清洁电能生产和有机废弃物处理,使MFC技术成为能源与环境领域的研究热点。在化学合成领域,Tefft等[5]构造了氢化酶缺失型希瓦氏菌ShewanellaoneidensisMR-1,并利用其天然的Mtr蛋白和外源性光驱动质子泵积累NADH(还原型辅酶I),能够由丙酮合成极具应用价值的2,3-丁二醇。
然而,产电微生物的EET效率通常较低,这已经成为限制产电微生物应用技术研究和发展的瓶颈[6-7]。当前,研究人员已经从遗传学、电化学、生理生态学和基因组学等方面深入解析了希瓦氏菌和地杆菌两个菌属的产电微生物与电子传递相关的基础理论问题[8-9]。随着越来越多的产电微生物被发现,从生物信息学角度开展产电微生物EET机制的理论研究,揭示产电微生物的EET过程及其调控机制,已经成为研究和发展产电微生物应用技术的一个关键环节[10]。
1 生物网络
一般认为,生物体内的各种生物分子(如:基因、蛋白、代谢物)通过它们之间的相互作用(如:转录调控、蛋白互作、代谢反应)完成各种生物学功能。这些相互作用的总体构成各类生物网络,如:调控网络、蛋白网络、代谢网络等[11]。目前,研究人员已经通过蛋白网络、调控网络与整合网络等多种生物网络模型对产电微生物的EET过程开展了系列研究。
1.1 多样化的电子传递分子
研究表明,多种分子参与产电微生物的EET过程。从内膜通过周质、外膜到细胞外部空间,产电微生物可以通过细胞色素c和外膜的孔蛋白等多种蛋白质形成EET途径完成EET过程[图1 (a)][12-13]。除了使用“孔蛋白-细胞色素c”形成主干EET途径,产电微生物还会使用其他细胞色素c与电子传递蛋白辅助这些EET途径。Edwards等[14]通过中子小角散射实验研究希瓦氏菌S.oneidensisMR-1中跨膜复合物MtrCAB的分子结构,发现MtrCAB与细胞周质的细胞色素cSTC之间的直接相互作用,揭示STC可以作为氧化还原伴侣来辅助MtrCAB途径的周质电子传递过程。Malvankar等[15]使用静电力显微镜观察到地杆菌导电性菌毛中的电荷传递,Wegener等[16]报道硫酸盐还原菌HotSeep-1在与厌氧甲烷氧化古菌ANME-1共培养时也会产生类似的导电性菌毛。研究人员发现多种微生物都具有这样的导电性菌毛[17]。Wang等[18]建立分辨率为0.37 nm的“纳米导线”原子模型,他们发现细胞色素c广泛分布在其中起到关键的电子传递作用[图1 (b)] 。多种电子介体均可参与介导细胞表面的电子传递过程[图1 (c)][19]。Light等[20]发现一个胞外还原酶家族蛋白,论证它能够通过一个保守的黄素化序列模体介导外膜与胞外电子介体之间的电子传递过程。
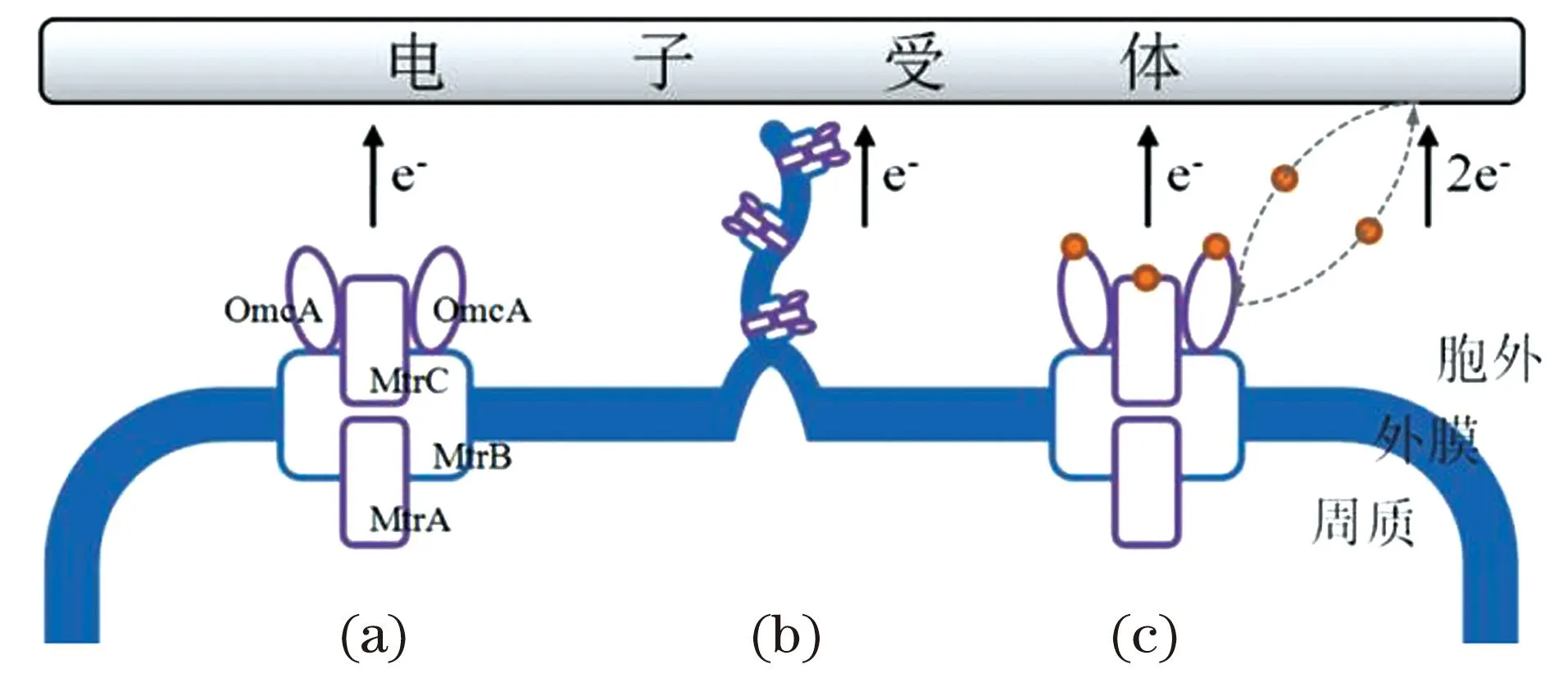
产电微生物首先通过EET途径将细胞质内产生的电子传递到细胞的外膜表面,然后电子进一步从外膜的细胞色素c传递到胞外电子受体。(a)外膜细胞色素c的直接接触[12-13];(b)细胞外膜和周质的延伸(原先的“纳米导线”)[15-18];(c)两种电子介体相关的机制:黄素-细胞色素复合物和电子穿梭体[19]。 MtrA:周质细胞色素c;MtrB:外膜孔蛋白;MtrC和OmcA:外膜细胞色素c。图1 几种典型的电子传递机制Figure 1 Several typical electron transfer mechanisms
产电微生物中的某些EET分子还具有丰富的基因多样性。例如:希瓦氏菌S.oneidensisMR-1中仅细胞色素c基因就有41个,地杆菌GeobactersulfurreducensPCA则达到110多个[21]。这意味着产电微生物可能会在不同的环境下表达不同的细胞色素c基因,构成不同的EET途径。鉴于细胞内的生物分子需要通过与分子的相互作用来执行它们的功能,分子网络研究往往有助于从整体上理解基因和蛋白的功能;此类研究可用于识别重要基因、预测蛋白功能、挖掘与特定生物学途径相关的功能模块等[22]。因而,可以通过生物网络模型的构建和分析来研究EET过程。目前国内外关于EET分子网络的研究已有一些阶段性的成果。
1.2 蛋白网络
Zhang等[23]报道了一个包含18个蛋白的小尺度网络,研究OmcA和MtrC等重要EET蛋白之间的相互作用。Sturm等[24]描绘了一个动态的周质电子传递网络,发现某些周质细胞色素c可以通过高频率的瞬时蛋白相互作用促进电子传递;他们还发现周质的电子传递过程涉及为特定的电子受体分配特异的EET蛋白。Alves等[25]通过对多种细胞色素相互作用网络的分析,发现小四倍体细胞色素STC在S.oneidensisMR-1的厌氧呼吸代谢中起核心作用,对维持S.oneidensisMR-1多功能厌氧代谢的周质氧化还原网络有较大帮助。Li等[26]研究了不同电位对地杆菌G.sulfurreducens新陈代谢和胞外呼吸的影响,发现它们也是通过多种EET蛋白的差异表达来调整不同条件下的EET过程。Ding等[27-28]构建了产电微生物希瓦氏菌S.oneidensisMR-1的基因组尺度细胞色素c相互作用网络,不仅通过网络中心化分析识别一些关键的细胞色素c,还结合网络模块分析与亚细胞定位信息推断出潜在EET途径,并使用基因表达数据进行确认。随后,进一步扩展了上述细胞色素c网络,构建了一个电子传递网络并探讨了它的形成及其中蕴含的EET机制,也从网络中识别出一些可以用来促进细胞周质电子传递过程的细胞色素c。它们大多具有较多的无序蛋白区域,容易形成高频的瞬时相互作用来促进细胞周质的电子传递过程。此外,Ding等[29]还通过对“活跃”蛋白质网络的分析,识别了产电微生物S.oneidensisMR-1中两个与电子传递相关的重要功能模块:一个多血红素细胞色素c模块和一个信号处理模块,并讨论了其中的关键蛋白以及它们在EET过程中发挥的作用。
综上,研究表明产电微生物能够通过电子传递蛋白构成的网络维持其自身的EET过程,网络的核心与外围分别负责不同的电子传递功能。
1.3 调控网络
生物体内所有转录调控关系的总体构成调控网络[11]。Leang等[30]研究了硫还原地杆菌G.sulfurreducens中RNA聚合酶σ因子RpoN在基因表达调控中的作用,建立RpoN调控模块。Luo等[31]在绿脓杆菌P.aeruginosaPAO1中引入外源性全局调控因子IrrE,发现新菌株的功率密度比对照株高出71%,论证以细胞调控网络为靶点可以有效提高产电微生物的EET效率。Li等[32]设计一个基于群感效应的种群状态决策系统,对几条EET途径分别重编程后,菌株的电流输出和污染物处理能力均有所提升;同时重编程由其中3条途径组成的“小型EET网络”则能达到更好的效果。Ding等[33]也通过对希瓦氏菌中与EET途径相关转录调控模块的构建与分析,识别出一些在EET基因的转录调控过程中发挥重要作用的信号蛋白质,并通过对这些信号蛋白以及它们作用伴侣的深入分析,研究信号蛋白在转录调控模块中发挥的作用以及它们对EET过程的影响。
1.4 整合网络
Raanan等[34]通过对氧化还原酶的结构相似性分析,确定一组基本的电子转移单元,主要包括:细菌铁氧还蛋白、细胞色素c、异丙菊酯和质体蓝蛋白型的折叠单元,构建由这些基本电子转移单元组成的空间邻接网络(SPAN),进而从SPAN的角度探讨电子传递链的拓扑结构以及它们的形成与演化;这种整合蛋白结构信息的网络模型为研究EET途径提供独特见解。Ding等[35]也通过对13种希瓦氏菌的整合转录调控和蛋白交互网络的构建与分析,识别了整合生物网络中的保守混合网络模体,发现了一种称为“共调控PPI”的高保守网络模体,建立它们和蛋白质的“提前准备”合成模式之间的关联,用于识别细胞为迅速响应环境的变化而需要提前合成的重要蛋白质。
2 组学方法
高通量技术的发展和越来越多产电微生物组学数据的出现使得人们可以从多个不同的层面来研究产电微生物的EET过程。通过对各种组学数据的分析,可以筛选在不同条件下显著差异表达的基因,进而挖掘与产电功能密切相关的EET基因。目前,研究人员已经从基因组、转录组、蛋白组等各种组学数据的角度对此类问题开展了大量研究。
2.1 基因组学
Kracher等[36]分析了97个真菌基因组,通过结合基因组数据和生物化学方法,阐明了3种与纤维素降解相关的EET系统的相对重要性以及它们与真菌生活方式之间的关系。采用比较基因组学的方法,Butler等[37]分析了Geobacter属的不同菌种在胞外电子传递过程中的差异。结果表明,KN400株中电子转移速率的增加和EET性能的改善是因为氧化途径中碳通量的变化和ATP代谢的变化,两种情况都会影响细胞色素c的折叠、定位和氧化还原电位。Leyn等[38]也通过比较基因组学方法识别了大肠杆菌和希瓦氏菌中的21个代谢相关的转录因子,根据代谢功能对它们进行了分类,并具体讨论了ArgR、TyrR、TrpR、HutC和HypR等转录因子。最近,Chadwick等[39]比较了39个厌氧甲烷氧化菌基因组,识别了保守的多血红素细胞色素c和生物能复合物,发现由MHC-A、MHC-B、MHC-C、HdrABC和MvhADG等蛋白质及其复合物参与的电子分岔途径。
2.2 转录组学
Embree等[40]利用野生型和fur突变株在不同铁浓度下的基因表达水平,研究G.sulfurreducens的转录因子Fur在协调Fe(II)氧化和Fe(III)还原过程中的调节作用,结果发现不同铁浓度下细胞色素c基因的表达水平有很大的差异。当铁浓度较高时,OmcZ这类多血红素细胞色素c发挥重要作用;而当铁浓度降低时,GSU3274等少血红素细胞色素c则变得重要起来。Barchinger等[41]使用RNA-Seq数据,分析希瓦氏菌S.oneidensisMR-1在厌氧条件下的差异表达,并从中识别促进EET过程的基因集。黄建福[42]分析不同培养环境下S.oneidensisMR-1的转录组数据,发现在铁硫环境下该菌铁还原代谢通路上的基因表达水平有所提升,得出铁硫环境能提高EET效率的结论。
2.3 蛋白组学
Yun等[43]使用凝胶分离和质谱分析等蛋白组学技术,识别了在铀生物修复过程中发挥重要作用的细胞色素c(GscA),其功能与硫还原地杆菌G.sulfurreducens中的OmcS类似,即通过与导电性菌毛协调作用促进电子的传递。Kavanagh等[44]则采用比较蛋白质组学分析了G.sulfurreducens在电子受体改变时的主要生理变化,论证几类分泌系统在长程电子传递过程中发挥的作用。Grobbler等[45]使用定量蛋白质组学对细胞变化进行分析,发现S.oneidensisMR-1电子传递蛋白的丰度随电极电位的不同而不同。在前述活跃蛋白质网络的分析中,我们也使用蛋白质组数据,分析了希瓦氏菌S.oneidensisMR-1在不同条件下的差异表达,进而从中识别一些可以促进EET过程的蛋白质[29]。
2.4 整合多组学
生命体是一个多层次、多功能的复杂结构体。多种组学数据间既相互关联又各有侧重,例如:转录组数据主要提供细胞中基因转录的情况及转录调控规律,蛋白组数据能够用于理解细胞的翻译调控策略。因而,联合多组学数据分析能够提供更全面的信息。Taylor等[46]通过组合转录组和蛋白组数据,研究了希瓦氏菌S.oneidensisMR-1在不同氧气情况下各基因的mRNA与相应蛋白质的表达水平,讨论了蛋白质翻译效率的变化情况及其对调节细菌蛋白质表达水平的影响。Qiu等[47]通过整合多组学数据构建了硫还原地杆菌的σ因子调控网络,揭示了模块化调控单元之间的多层次相互作用及其对能量代谢与EET过程的协调调控。
2.5 宏组学
通过组合EET活性微生物群落对不同电子受体和电子供体条件下的代谢和转录响应,Ishii等[48]识别了Geobacter/Pelobacter中的关键代谢基因,附属物/转运蛋白基因和多血红素的细胞色素c基因等。Ni等[49]通过宏转录组测序分析了用于硫氰酸盐降解的微生物燃料电池中阳极的微生物群落,结果表明硫氰酸盐的降解主要是通过氰酸盐降解途径完成的,为硫氰酸盐降解与EET过程的耦合提供了证据。Meier等[50]也通过宏基因组学和宏蛋白组学技术分析了微生物对金属硫化物的氧化作用,硫还原硝化螺旋菌门Nitrospirae和硫氧化的伽马变形菌纲Gammaprotebacteria等细菌分支的潜在生活方式。他们的宏蛋白组数据分析结果表明这些细菌主要是通过EET过程来促进金属硫化物的溶解。杨洋[51]结合宏基因组学、单细胞基因组学和宏蛋白组学方法,发现了在低温下生物膜的基础代谢依旧保持活跃,但在次优条件下氧化代谢反应受到抑制并会影响EET速率。
3 整合组学数据到生物网络
如前所述,国内外已有一些利用各种网络方法和组学数据研究产电微生物EET过程的工作,但大多主要关注某一类网络模型,或者一两种组学数据,很少将网络模型与组学数据结合起来。目前,生物网络和多组学数据的整合分析已在医药疾病等多个领域取得了重要进展[52-53]。受此启发,我们也初步尝试了将组学数据整合到生物网络中研究产电微生物的EET过程。
首先,通过对全基因组共适应度数据和蛋白网络的整合分析,识别了产电微生物S.oneidensisMR-1中可用于响应多种不同环境条件的一些重要EET基因,如:ScyA (SO0264)、PetC(SO0610)、CcoP (SO2361)、CcoO (SO2363)和CytcB (SO4666)等。对现有文献中较少报道的CytcB,通过对其三维结构、亚细胞定位和无序区域的分析,预测了它能够用于介导细胞周质的电子传递过程[54]。此外,确定了不同细胞色素c的高共适应基因,发现其中富集了大量的信号转导蛋白,论证了不同细胞色素c的协调利用以及信号蛋白质与细胞色素c之间的合作,并识别了一个参与对CymA调控的信号蛋白质[55]。
其次,整合了S.oneidensisMR-1的转录组、蛋白组和蛋白网络等数据,分析了EET过程激活前后蛋白质翻译效率的变化,发现差异翻译的蛋白质往往具有较高的网络连接度。进而,构建了差异翻译蛋白形成的子网络,分析了其中的功能模块和调控单元,讨论了差异翻译对EET过程的影响。还发现位于同一个操纵子上基因的翻译效率往往不会全部上调或全部下调。在此基础上,识别了参与EET过程的关键基因(如:尿卟啉原脱羧酶HemE)与基因簇(如:argBFGH、lldEFG、mtrCAB、thrABC、csgEFG等),并从蛋白翻译效率的角度探讨了EET过程相关转录调控和蛋白互作的协调作用[56]。
4 总结与展望
当前,研究人员已经通过网络方法与组学方法开展了产电微生物EET过程的系列研究,在基因功能分析、关键分子识别、网络模块挖掘与生物学途径推断等方面均取得了一定的成绩。这些理论研究也具有非常重要的实际应用价值,例如:可以通过EET机制的研究鉴定关键的EET分子,进而通过基因工程技术改造产电微生物,提高它们的电子传递效率,优化生物电化学装置(如MFC)的性能与效率。文章从生物信息学角度,系统总结使用网络方法与组学方法研究产电微生物的胞外电子传递等相关方面的工作,表1简要分类概括了本文介绍的相关工作。
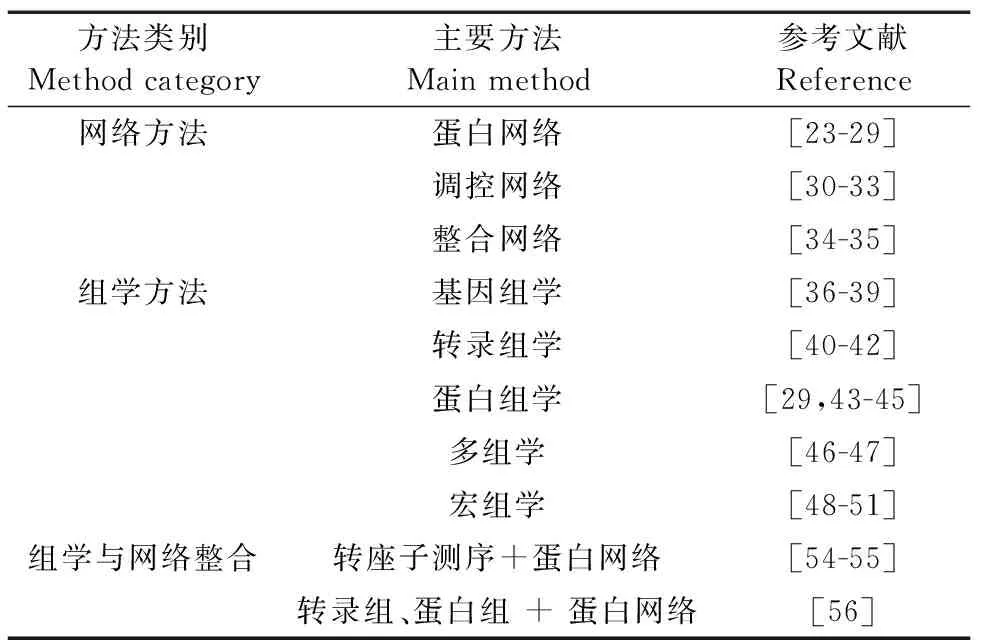
表1 产电微生物胞外电子传递研究的网络与组学研究工作Table 1 Network and omics works on studying extracellular electron transfer in electricigens
然而,当前的整合研究尚未完全建立不同类型的分子特征和网络中对应元素类型之间的直接联系。以转录网络为例,靶基因的表达(mRNA水平)会受到转录因子的调控,而转录因子活性又受到与它相互作用的蛋白质的影响;因而,网络中的转录因子及其靶基因需要分别和蛋白质丰度与mRNA水平关联起来。因此,未来需要整合多种生物网络和多种组学数据一起开展产电微生物EET过程的理论研究工作,进一步为相关的实验研究提供科学线索。

