组蛋白去乙酰化酶在孕鼠孕期免疫激活所致子代青春期感觉门控损伤中的作用
王冠玉,刘森淇,杨勇锋,李文强,吕路线,苏 玺
(1.新乡医学院第二附属医院重点实验室,河南 新乡 453002;2.河南省生物精神病学重点实验室,河南 新乡 453002)
精神分裂症(schizophrenia,SZ)是一种常见且复杂的重性神经发育障碍类疾病,其临床症状多样,主要表现为阳性症状(幻觉、妄想、思维形式障碍、行为紊乱等)、阴性症状(言语减少、情感淡漠等)以及认知障碍。虽然一代和二代抗精神病药物可以有效缓解阳性症状,但对于阴性症状和认知障碍作用微弱[1]。目前SZ发病机制不明。研究报道,感觉门控异常可能是引起SZ产生精神病理症状的重要机制之一[2-3]。感觉门控指大脑对感觉刺激的调节和适应能力,属于大脑的一项正常功能,其缺损可以导致无关感觉刺激超载,引起SZ、癫痫和阿尔茨海默病等神经系统疾病[4]。在大鼠模型中可以通过前脉冲抑制(prepulse inhibition,PPI)实验检测感觉门控功能。PPI是动物对威胁性刺激的一种保护机制,该功能减弱说明动物的感觉门控受损[5]。
组蛋白去乙酰化酶(histone deacetylase,HDAC)在进化上高度保守,可催化组蛋白N端乙酰化的赖氨酸脱去乙酰基,使组蛋白与DNA结合更加紧密、染色质更加致密卷曲、启动子区DNA序列不易与转录复合物结合,从而导致基因转录受到抑制。到目前为止,人类基因中已确定18种HDAC,根据序列和结构的同源性共分为4型[6]。神经元损伤是SZ阴性症状和认知障碍的主要病理基础。研究显示,HDAC蛋白的表达及功能异常与神经元损伤、神经退行性疾病的发生具有相关性,且广谱HDAC抑制剂具有改善认知以及缓解神经退行性疾病病理状态的作用[7-8],但由于HDAC家族酶系众多且功能各异,广谱类抑制剂不可避免地会导致大量不良反应,而HDAC特异性抑制剂可能会达到更好的治疗效果。
母孕期免疫激活(maternal immune activation,MIA)子代SZ大鼠模型是在流行病学研究的基础上发展起来的神经发育缺陷动物模型。研究表明,母孕期病毒等感染或免疫激活与子代发生SZ等神经发育障碍的风险增加有关[9]。在MIA模型中,母鼠在孕期接受病毒模拟物聚肌胞苷酸(polyinosinic-polycytidylic acid,Poly I:C)、细胞因子或其他免疫刺激剂等免疫激活处理后可以激活母体免疫系统反应,进而影响胎儿的神经发育[10]。母孕期注射Poly I:C的子代在脑形态学、电生理学、神经化学以及行为学等方面能很好地模拟SZ的许多病理特征[11],适用于疾病的病理机制研究。青春期是神经发育的关键时期,有研究显示, SZ患者的临床症状多起病于青春期[12]。本研究拟分析MIA子代青春期大鼠HDAC基因表达水平,以期为SZ的病理机制研究提供新的线索,为评估HDAC是否可以作为潜在的改善SZ症状的药物靶点提供实验依据。
1 材料与方法
1.1 实验动物
20只无特定病原级8周龄Sprague-Dawley(SD)大鼠购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006],雌、雄各半,体质量约250 g。大鼠饲养条件:光/暗周期为12 h12 h,相对湿度为(57±2)%,温度为(22±2)℃,保证随机饮水和充足的食物供应。
1.2 主要试剂与仪器
Poly I:C购自美国Sigma-Aldrich公司,白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫反应检测试剂盒购自北京四正柏生物科技有限公司,TRIzol试剂购自美国Invitrogen公司,实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qPCR)试剂盒购自美国赛默飞公司;qPCR仪购自美国Applied Biosystems公司,SM-1000-Ⅱ型PPI检测设备购自美国Lafayette公司。
1.3 MIA大鼠模型制备
本研究通过河南省生物精神病学重点实验室伦理委员会批准。参考MUELLER等[13]的研究方法,在大鼠适应性饲养2周后开始育种,将雌鼠出现阴道栓作为妊娠期第1天的标志,将受孕成功的10只雌鼠随机分为模型组(n=5)和对照组(n=5)。在妊娠期第9天(G9),模型组孕鼠经尾静脉注射10 mg·kg-1Poly I:C,对照组孕鼠给予等体积无菌生理盐水。3 h后,尾静脉取血,采用酶联免疫吸附法检测2组孕鼠血浆中IL-1β、IL-6和TNF-α水平,评估孕鼠免疫激活状态。
1.4 2组子代大鼠PPI检测
将2组孕鼠饲养至自然生产。子鼠在出生后第21天断乳,选取雄性后代继续饲养。在子鼠青春期(即出生后第40天)时进行PPI测试。首先将实验大鼠置于限制器内,适应5 min后开始实验。背景噪音为70 dB,惊吓反射刺激强度为40 ms 120 dB白噪音,前脉冲刺激强度分别为20 ms 75、80、85 dB白噪声;在惊吓刺激前100 ms给予前脉冲刺激,形成5种惊吓反应模式(即70 dB,120 dB,75 dB+120 dB,80 dB+120 dB,85 dB+120 dB),每种惊吓反应有10个。这50个惊吓反应随机排布,每个反应之间平均间隔15 s(7~23 s随机间隔),记录每个惊吓反应的最大反应数值。具体操作参考文献[14]。PPI检测结果通过前脉冲抑制效率(PPI%)表示。PPI%=[1-(预脉冲试验的起始振幅/单独脉冲的起始振幅)]×100%[15]。
1.5 qPCR检测子代雄性大鼠海马、额叶及肝脏组织中HDAC家族的基因表达
2组子代大鼠的PPI检测完毕后,继续正常饲养2 d,然后用20 g·L-1的戊巴比妥钠(60 mg·kg-1)腹腔注射麻醉大鼠,断头取脑并用生理盐水冲洗,剥离海马及额叶,同时取新鲜肝脏即刻置于-80 ℃的冰箱保存备用。
分别取50 mg子代大鼠额叶、海马和肝脏组织,加入1 mL TRIzol后迅速研磨成匀浆,提取总RNA,使用 Thermo Fisher Scientific Power UpTMSYBRTMGreen Master Mix(A25742)对HDAC基因进行qPCR。采用2-ΔΔCt法计算目的基因的相对表达量。引物由南京诺尔曼生物技术有限公司合成。HDAC1基因上游引物序列为5′-ATAATGTCGCTCGGTGCT-3′,下游引物序列为5′-ATTGGAAGGGCTGATGTGAA-3′;HDAC2基因上游引物序列为5′-ATCCGCCAGACCATCTTTG-3′,下游引物序列为5′-TCAATCCTGGCTTTTTTGGC-3′;HDAC3基因上游引物序列为5′-ATCCGCCAGACCATCTTTG-3′,下游引物序列为5′-TCTCCACATCGCTTTCCTTG-3′;HDAC4基因上游引物序列为5′-TCGGTGTTTGTCAGGCTTCC-3′,下游引物序列为5′-TCCACTACACAGCCTACAGCCA-3′;HDAC5基因上游引物序列为5′-GTCGAAAGGATGGCACTGTT-3′,下游引物序列为5′-AGCCAGTAAAGCCGTTCTCA-3′;HDAC6基因上游引物序列为5′-CAGCGCAGTCTTATGGATGG-3′,下游引物序列为5′-AGCGGTGGATGGAGAAATAG-3′;HDAC7基因上游引物序列为5′-TAGCCAGCAGTGTGGTCAAG-3′;下游引物序列为5′-CAGGGATTTCTTGGGTTTGTAG-3′;HDAC8基因上游引物序列为5′-CTCAGGCTGAGTCTGAAA-3′,下游引物序列为5′-CTTCACAAGGGAATCGCA-3′;HDAC9基因上游引物序列为5′-GCAGAGGCAAGAACAGGAAG-3′,下游引物序列为5′-TGATCCAGTGATGTGTGGTG-3′;HDAC10基因上游引物序列为5′-GTGCCCTGGAGTCTATC-3′,下游引物序列为5′-CCAAGGCAACAGCTATG-3′;HDAC11基因上游引物序列为5′-TCACACTGGCTATCAAGTT-3′,下游引物序列为5′-GTAGATGTGGCGGTTGTAAA-3′; 沉默信息调节因子(Sirtuin,Sirt)基因上游引物序列为5′-CCAGATCCTCAAGCCATGTT-3′,下游引物序列为5′-CCAAAATTGCTTTCCTTCCA-3′; 内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-GGAGC-GAGATCCCGTCAAGA-3′,下游引物序列为5′-CACAAACATGGGGGCATCAG-3′。
1.6 统计学处理

2 结果
2.1 2组孕鼠血浆中IL-6、IL-1β、TNF-α水平比较
模型组孕鼠血浆中IL-6、IL-1β、TNF-α水平分别为(55.49±11.86)、(128.90±3.29)、(299 496±9 851) ng·L-1,对照组孕鼠血浆中IL-6、IL-1β、TNF-α水平分别为(23.42±9.02)、(35.92±6.37)、(106 301±22 137) ng·L-1;模型组孕鼠血浆中IL-6、IL-1β、TNF-α水平显著高于对照组,差异有统计学意义(t=3.730、22.481、13.814,P<0.05)。提示孕鼠孕期免疫激活成功。
2.2 2组子代大鼠PPI检测结果比较
模型组子代青春期大鼠在前脉冲刺激为75、80、85 dB时PPI%分别为(47.96±9.90)%、(57.11±10.43)%、(61.16±8.87)%;对照组子代青春期大鼠在前脉冲刺激为75、80、85 dB时PPI%分别为(63.57±12.46)%、(64.60±20.16)%、(69.56±14.67)%。在前脉冲刺激为75 dB时,模型组子代青春期大鼠的PPI%显著低于对照组,差异有统计学意义(t=3.102,P<0.05);前脉冲刺激为80、85 dB时,模型组与对照组子代青春期大鼠的PPI%比较差异无统计学意义(t=1.044、1.550,P>0.05)。
2.3 2组子代大鼠额叶、海马及肝脏组织中HDAC家族mRNA表达水平比较
2.3.1 2组子代大鼠额叶、海马及肝脏组织中Ⅰ类HDAC mRNA表达水平比较
模型组子代大鼠额叶组织中HDAC3、HDAC8 mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠额叶组织中HDAC1、HDAC2 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组子代大鼠海马组织中HDAC1、HDAC8 mRNA表达水平显著低于对照组,HDAC2 mRNA表达水平显著高于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠海马组织中HDAC3 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组与对照组子代大鼠肝脏组织中HDAC1、HDAC2、HDAC3、HDAC8 mRNA表达水平比较差异均无统计学意义(P>0.05)。结果见表1。
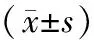
表1 模型组与对照组子代大鼠额叶、海马及肝脏组织中Ⅰ类HDAC mRNA表达水平比较Tab.1 Comparison of the expression levels of class Ⅰ HDAC mRNA in the frontal lobe,hippocampus,and liver tissues of the offspring rats between the model group and the control group
2.3.2 2组子代大鼠额叶、海马及肝脏组织中ⅡA类HDAC mRNA表达水平比较
模型组子代大鼠额叶组织中HDAC4、HDAC9 mRNA表达水平显著低于对照组,HDAC5 mRNA表达水平显著高于对照组,差异均有统计学意义(P<0.05);模型组与对照组子代大鼠额叶组织中HDAC7 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组子代大鼠海马组织中HDAC5 mRNA表达水平显著高于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠海马组织中HDAC4、HDAC7、HDAC9 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组与对照组子代大鼠肝脏组织中HDAC4、HDAC5、HDAC7、HDAC9 mRNA表达水平比较差异均无统计学意义(P>0.05)。结果见表2。
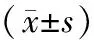
表2 模型组与对照组子代大鼠额叶、海马及肝脏组织中ⅡA类HDAC的mRNA表达水平比较Tab.2 Comparison of the expression levels of class ⅡA HDAC mRNA in the frontal lobe,hippocampus,and liver tissues of the offspring rats between the model group and the control group
2.3.3 2组子代大鼠额叶、海马及肝脏组织中ⅡB类HDAC mRNA表达水平比较
模型组子代大鼠额叶组织中HDAC10 mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠额叶组织中HDAC6 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组子代大鼠海马组织中HDAC10 mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠海马组织中HDAC6 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组子代大鼠肝脏组织中HDAC6、HDAC10 mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05)。结果见表3。
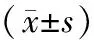
表3 模型组与对照组子代大鼠额叶、海马及肝脏组织中ⅡB类HDAC mRNA表达水平比较Tab.3 Comparison of the expression levels of class ⅡB HDAC mRNA in the frontal lobe,hippocampus,and liver tissues of the offspring rats between the model group and the control group
2.3.4 2组子代大鼠额叶、海马及肝脏组织中Ⅲ类和Ⅳ类HDAC mRNA表达水平比较
模型组子代大鼠额叶组织中Sirt mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05);模型组与对照组子代大鼠额叶组组织中HDAC11 mRNA表达水平比较差异无统计学意义(P>0.05)。模型组与对照组子代大鼠海马和肝脏组织中Sirt、HDAC11 mRNA表达水平子比较差异均无统计学意义(P>0.05)。结果见表4。
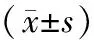
表4 模型组与对照组子代大鼠额叶、海马及肝脏组织中Ⅲ类和Ⅳ类HDAC mRNA表达水平比较 Tab.4 Comparison of the expression levels of class Ⅲand Ⅳ HDAC mRNA in the frontal lobe,hippocampus,and liver tissues of the offspring rats between the model group and the control group
2.4 2组子代大鼠HDAC2、HDAC10、Sirt mRNA表达水平与PPI%(75 dB)的相关性
2组子代大鼠海马组织中HDAC2 mRNA表达水平与75 dB时的PPI%呈负相关(r=-0.965,P<0.05);额叶组织中HDAC10、Sirt mRNA表达水平与75 dB时的PPI%呈正相关(r=0.946、0.925,P<0.05)。结果见图1。
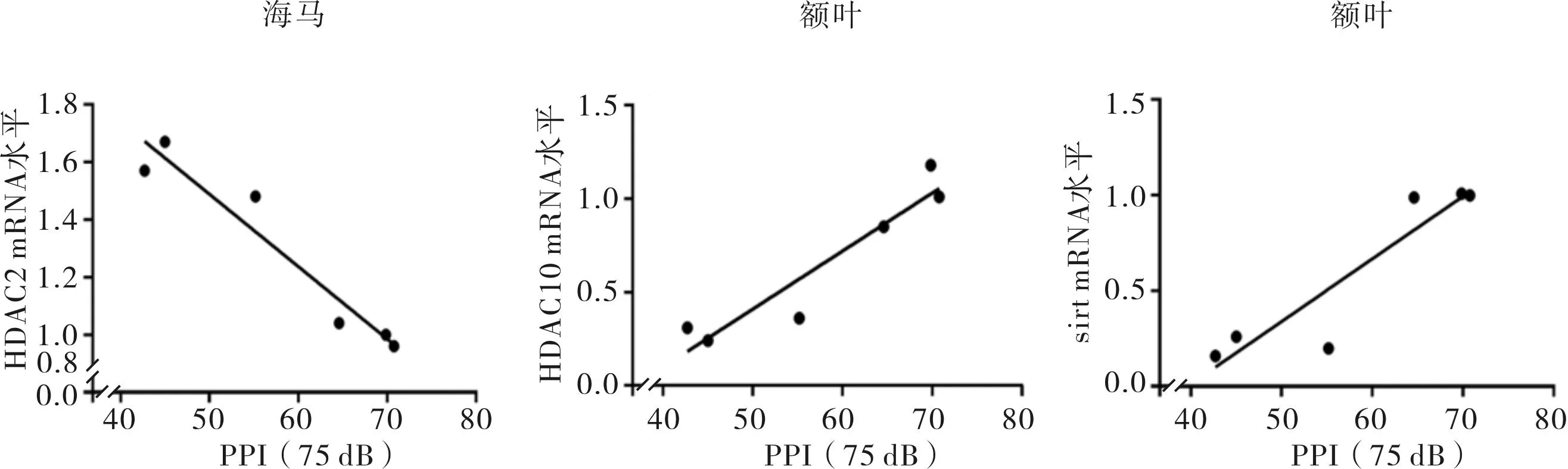
图1 2组子代大鼠HDAC2、HDAC10、Sirt mRNA表达水平与PPI%(75 dB)的相关性 Fig.1 Correlation between the expressions of HDAC2,HDAC10,Sirt mRNA and PPI% (75 dB) of the offspring rats in the two groups
3 讨论
产前阶段对子代大脑发育至关重要,在这个过程中大脑将完成神经元形成、神经发生和神经元迁移;此外,突触发生、神经胶质发生和髓鞘形成等过程也始于母孕期[16]。母孕期病毒感染可导致子代神经发育障碍,出现SZ、自闭症等精神疾病[17]。动物模型研究表明,甲型流感病毒可能通过嗅觉途径进入中枢神经系统,导致子代海马神经元形态的改变以及海马组织中参与抗原处理和呈递的基因显著上调,从而导致子代认知功能障碍[18]。BURMEISTER等[19]研究发现,小鼠母体感染疱疹病毒后可能通过影响成年子代多巴胺能神经元相关基因和蛋白的表达,导致子代神经发育障碍。此外,母孕期病毒感染可通过异常激活母体免疫系统,直接损害后代神经元,从而导致后代神经发育障碍[20]。AMODEO等[21]在动物研究中发现,母鼠妊娠期感染Poly I:C会损害子代的学习能力和社会交往能力,同时发现MIA会对子代谷氨酸能神经传递、哺乳动物雷帕霉素靶蛋白信号通路和钾离子通道活性等产生持续性影响。本团队前期研究发现,MIA子代的行为异常是进行性的,即只有成年期子代大鼠表现出自主运动增加、焦虑样行为和PPI缺陷,而青春期子代大鼠仅表现出PPI缺陷[22]。因此,本研究在MIA大鼠子代青春期时进行PPI检测,结果与既往研究类似,青春期子代大鼠存在感觉门控受损。SZ患者的感觉门控缺陷与认知功能损伤存在关联,在一项用PPI试验评估SZ患者感觉运动门控缺陷的荟萃分析中发现,SZ患者普遍存在感觉门控受损[23]。DING等[3]在一项纳入了54例未服药的首发SZ患者和53例健康对照者的研究中,通过PPI评估感觉门控缺陷,并使用中文版的改善精神分裂症认知的评估和治疗研究(Measurement and Treatment Research to Improve Cognition In Schizophrenia,MATRICS)共识认知成套测验(MATRICS Consensus Cognitive Battery,MCCB)评估所有受试者的认知功能,结果发现,SZ患者存在严重的感觉门控缺陷和认知障碍,且PPI%与认知损害程度呈显著正相关,这表明PPI可反映SZ患者的认知功能缺陷。
HDAC 作为表观遗传学中一种重要的翻译后修饰酶,正电子发射断层技术能测得其在患者脑内表达失调。GILBERT等[24]研究发现,与健康对照组相比,SZ患者的前额叶背外侧皮层中HDAC2的表达水平相对较低,且HDAC2表达水平与患者认知能力评分呈正相关。HDAC在染色体的结构修饰和基因表达调控中发挥重要作用,其不同亚型的异常表达水平与SZ、阿尔兹海默症等神经退行性疾病密切相关[25-26]。大部分HDAC抑制剂都是非特异性的,这主要是由于目前对于不同亚型HDAC在SZ发生发展中作用机制不明。因此,鉴别HDAC亚型与SZ病理学变化的相关性,尤其是与SZ患者感觉门控受损的相关性,对于特异性HDAC抑制剂的研发以及SZ的治疗意义重大。
ⅡA类HDAC主要包括HDAC4、5、9等多种亚型。其中,HDAC4穿梭于细胞核和细胞质之间,控制着突触可塑性和记忆形成所必需的转录过程[32]。KIM等[33]对278例SZ患者和234名正常对照人群的HDAC基因多态性进行评估,结果发现,HDAC4的rs1063639单核苷酸多态性位点与SZ具有明显的相关性。本研究结果显示,与对照组子代大鼠相比,MIA子代大鼠额叶组织中HDAC4的表达水平显著下降,提示HDAC4可能参与SZ的病理发生过程。HDAC9在大脑组织内广泛表达,对神经系统的发育及其正常功能的维持发挥重要作用,该基因表达水平下降可促进神经元凋亡[34-35]。TAM等[36]通过检测91例SZ患者和92名正常对照人群的全基因组DNA拷贝数并结合国际精神分裂症联盟数据库分析发现,SZ患者存在HDAC9基因特异性缺失。本研究结果显示,与对照组子代大鼠相比,MIA子代大鼠额叶组织中HDAC9表达水平显著下降,提示MIA子代大鼠HDAC9表达水平减少可能与HDAC9基因特异性缺失直接相关,可促进SZ的发生发展。HDAC5参与炎症调节,PAN等[37]通过建立小鼠癫痫模型发现,与正常对照组相比,模型鼠存在促炎细胞因子IL-1β、TNF-α和IL-6水平升高以及HDAC5表达水平升高;而当抑制HDAC5表达后这些炎症因子生成减少。此外,KOSEKI等[38]通过苯环利定建立SZ小鼠模型发现,减少HDAC5的表达可改善SZ小鼠精神分裂症样症状。本研究发现,与对照组子代大鼠相比,MIA模型子代大鼠血浆中IL-6、IL-1β和TNF-α水平及额叶和海马组织中HDAC5显著升高;提示,HDAC5可能通过促进MIA子代大鼠体内炎症因子表达从而参与SZ发生。
ⅡB类HDAC包括HDAC6和HDAC10。HDAC6涉及去乙酰化酶结构域和泛素结合锌指结构域,参与调控自噬和NOD样受体热蛋白结构域蛋白3炎症小体的激活等生理过程,并可能在自噬和炎症之间发挥关联作用[39]。HDAC10位于细胞质和细胞核中,同样与自噬和炎症有关[40]。有研究发现,巨噬细胞感染病毒后细胞中HDAC10蛋白水平下降;而加入自噬抑制剂后HDAC10蛋白降解速度减慢。此外,还有研究发现,HDAC10敲除小鼠病毒感染后血清中干扰素β和IL-6水平高于野生型小鼠[41-42]。自噬和炎症在SZ病理生理过程中起着关键作用[43-44]。本研究结果显示,MIA子代大鼠额叶、海马组织中HDAC10呈显著低表达,且额叶组织中HDAC10的表达水平与感觉门控受损程度呈显著正相关;这提示,MIA诱导的HDAC10低表达可能参与了SZ的发生和发展,且HDAC10表达程度越低,MIA子代大鼠感觉门控功能受损可能越严重。ⅡB类HDAC可调节细胞内代谢,ÇAKIR等[45]研究发现,在饮食诱导的肥胖小鼠中,HDAC6抑制剂可作为瘦素增敏剂和抗肥胖剂。而SZ患者并发代谢综合征的概率高于健康人群[46]。本研究通过检测肝脏组织中HDAC的表达水平发现,MIA可导致青春期子代大鼠ⅡB类HDAC水平的降低;提示,MIA子代大鼠中ⅡB类HDAC的表达水平紊乱可能参与了SZ患者并发代谢综合征的病理生理过程。
Ⅲ类HDAC即Sirt是NAD+依赖性脱乙酰酶,参与DNA修复,Sirt缺失会导致神经元凋亡,使个体出现学习记忆能力下降等一系列类精神病症状[47]。本研究发现,MIA子代大鼠的额叶组织中Sirt表达水平显著下降,且其表达量与MIA子代大鼠的感觉门控受损程度呈显著负相关;提示,Sirt缺失不仅参与了SZ认知受损等症状的病理过程,且其表达水平降低提示MIA子代大鼠感觉门控受损严重,可能伴随着更差的认知功能。
Ⅳ类HDAC即HDAC11在脑内表达丰富,其在多种生物学过程中起重要调控作用,包括神经系统发育、炎症反应等[48]。VILLAGRA等[49]研究发现,在脂多糖刺激下,小鼠巨噬细胞中IL-10的表达水平升高,这是因为脂多糖作为一种细菌成分,能够触发炎症反应,促使巨噬细胞分泌IL-10等炎症因子。然而当小鼠巨噬细胞感染了编码HDAC11的腺病毒后,再经脂多糖刺激时小鼠巨噬细胞中的IL-10的表达水平并未显著增加。这可能是因为HDAC11发挥了抗炎作用,对IL-10的表达产生了抑制作用。本研究结果显示,与对照组子代大鼠相比,MIA子代大鼠额叶、海马和肝脏组织中的HDAC11表达水平均无明显变化;提示,母孕期病毒感染激活免疫炎症反应所产生的IL-6、IL-1β、TNF-α等免疫炎症因子不会引起MIA子代大鼠HDAC11的保护性升高,从而不能有效发挥抗炎作用,这可能是造成MIA子代大鼠神经发育障碍的原因之一。
选择性HDAC亚型抑制剂可能为治疗SZ的许多症状(特别是认知缺陷)提供替代疗法[50]。PULYA等[51]给予记忆功能受损的小鼠HDAC抑制剂PT3进行干预后发现,PT3具有良好的血脑屏障渗透性,能够增强小鼠的长期记忆功能。DE LA FUENTE REVENGA等[52]研究发现,Ⅰ类和Ⅱ类HDAC抑制剂伏立诺他可以有效改善HDAC2敲除小鼠的突触可塑性和认知功能。
4 结论
母孕期感染Poly I:C可导致子代大鼠在青春期时出现感觉门控受损,且这种损害伴随着HDAC基因转录的异常改变,这不仅为青春期作为SZ的高发年龄节点提供进一步的证据支持,还为SZ的分子病理学机制研究提供了新的线索。HDAC异常表达多与神经发育障碍相关,而不同亚型HDAC的表达可能参与了不同的病理生理机制;因此,未来可以将HDAC作为SZ的潜在药物治疗靶点,针对不同类型的HDAC来研制特异性抑制剂,避免广谱类抑制剂带来的诸多毒副作用,从而为SZ的治疗带来更加理想的效果。

