九味生化颗粒制剂的稳定性试验研究
赵丽萍 任建花
(酒钢医院药学部,甘肃 嘉峪关 735100)
九味生化颗粒是酒钢医院根据临床需要而创新研发的纯中药制剂,前期已对其主要成分川芎、益母草、山楂、红花、桃仁、甘草进行了薄层色谱法鉴别,对其主要成分阿魏酸采用高效液相色谱(HPLC)法进行含量测定。本次研究主要为保证九味生化颗粒成品质量,对本品的吸湿性、高温、强光照射、加速及长期稳定性开展试验研究,考察不同批次的样品外观、性状、鉴别、水分、含量的变化,分析药品稳定性试验数据。
1 仪器与试剂
1.1 仪器AUW220D 型电子分析天平(十万分之一);ZF-20A 型暗箱四用紫外分析仪;LC-2010AHT 型高效液相色谱仪。
1.2 试剂与药品对照品:阿魏酸,批号:110773-201614;对照药材:川芎、益母草、红花、桃仁、山楂,批号依次为:120918-201612、120912-201209、120907-201713、120953-201407、编号YJ-121626,均购自中国食品药品检定研究院。试剂:乙腈为色谱纯,磷酸,超纯水。3 批样品批号分别为:20180325、20180326、20180327。
2 方法与结果
2.1 含量测定
2.1.1 试验色谱条件色谱柱:Inertsil ODS-SP,规格:150 mm×4.6 mm、5 μm;流动相:0.085%磷酸水溶液-乙腈(83∶17),流速:1.0 mL/min;进样量:10 μL;柱温:35 ℃;检测波长:316 nm。
2.1.2 对照品、供试品、阴性溶液的制备
2.1.2.1 阿魏酸对照品溶液的制备 精密称取适量阿魏酸对照品,加70%甲醇溶解成8 μg/mL的溶液,即得阿魏酸对照品溶液。
2.1.2.2 供试品溶液的制备 精密称取本品粉末10.0 g(过80 目筛),置于锥形瓶(250 mL)中,加入100 mL甲醇溶液,称定重量;水浴回流提取(60 min),放冷至室温;用甲醇补足回流损失,震荡均匀;用0.45 μm 的微孔滤膜滤过,收集续滤液。
2.1.2.3 阴性对照品溶液的制备 取阴性对照样品粉末(不含当归)10.0 g,制备方法参考“2.1.2.2”。
2.1.3 线性关系考察采用高效液相自动进样器分别吸取上述对照品溶液10 μL 注入液相色谱仪。以峰面积(Y)对浓度(X)进行线性回归,阿魏酸在进样量0.081~1.620 μg线性关系良好,回归方程为Y=58 429X-0.2199,r=0.996。
2.1.4 稳定性试验取同一供试品溶液,每隔1 h 进样10 μL,测定峰面积并计算阿魏酸的相对标准偏差(RSD)。阿魏酸RSD 值为1.48%,供试品溶液12 h 内稳定。
2.1.5 回收率试验称取6 份已知含量的样品约10 g,分别精密加入阿魏酸对照品溶液,制备方法参考“2.1.2.2”,计算出回收率平均值为97.9%。
2.2 定性鉴别方法与结果
2.2.1 川芎鉴别称取样品15 g 置于圆底烧瓶,加入40 mL 乙醚溶解;回流60 min,滤纸滤过;滤液挥干成残渣,再加入2 mL乙酸乙酯溶解,作供试品溶液。取阴性样品(缺川芎)15 g,取1 g 川芎对照药材,同法制成对照溶液(阴性对照、川芎对照)。
照薄层色谱法(TLC)(《中华人民共和国药典》2015 年版四部通则0502)试验,取10 μL 点样管吸取上述3种溶液,分别点在同一硅胶G薄层板(GF254),展开剂为正己烷-乙酸乙酯(3∶1);展开距边缘线1 cm 时取出,晾干,置ZF-20A型暗箱四用紫外分析仪中检视(波长254 nm)。见图1。3批样品与川芎对照药材的色谱位置上,显相同颜色的暗色斑点,而阴性相应位置无斑点[1]。
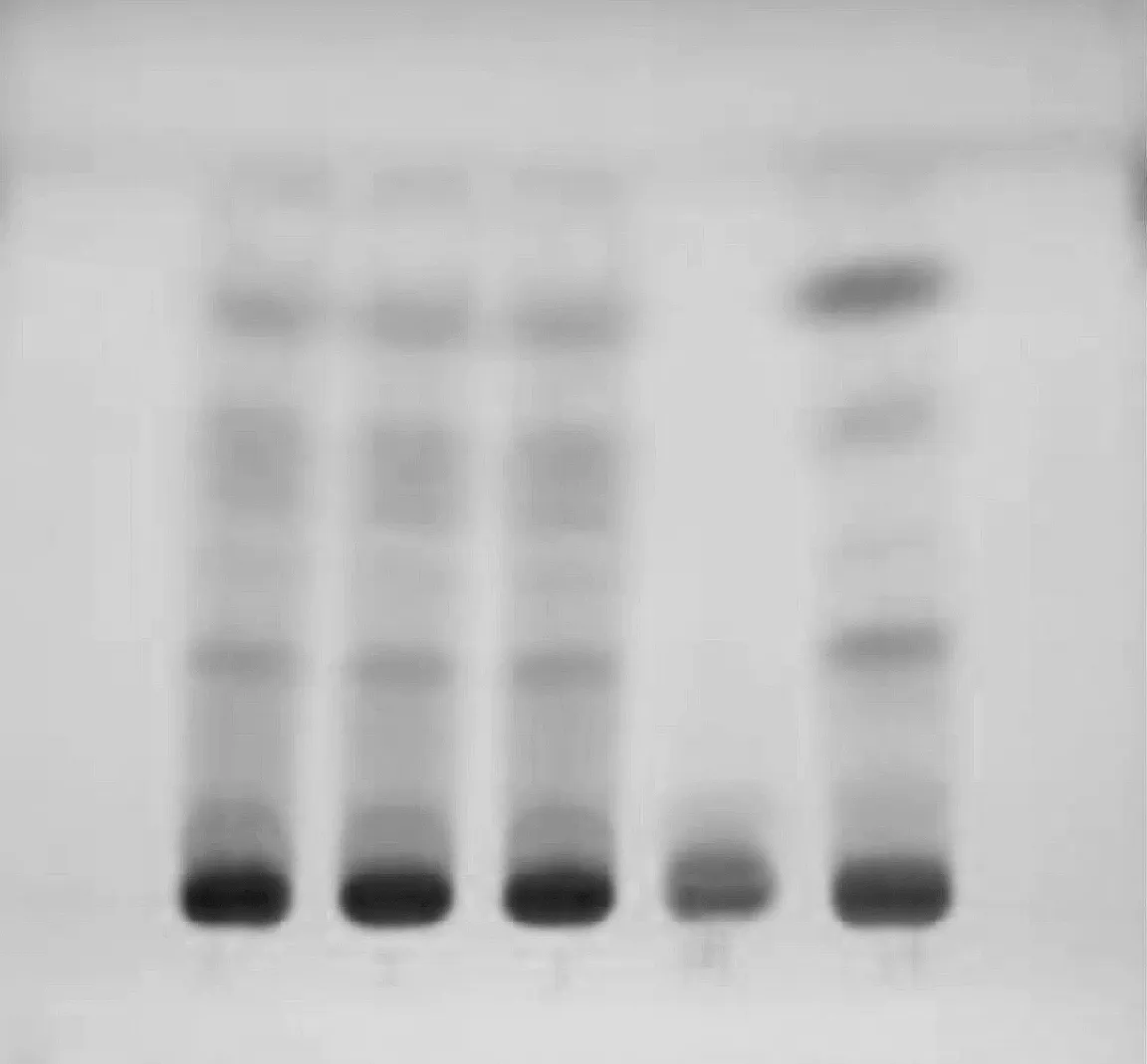
图1 川芎的薄层色谱图
2.2.2 益母草鉴别称取样品20 g 研磨成粉末后,加入50 mL 乙醚,振摇提取10 min,提取液用滤纸滤过;挥干至残渣,再加入1 mL甲醇溶解,作供试品溶液。取益母草对照药材1 g,取阴性样品(缺益母草)20 g,同上法制成对照溶液(阴性对照、益母草对照)。
取5 μL 点样管吸取上述3 种溶液,分别点在同一硅胶G 薄层板上,展开剂为正己烷-乙酸乙酯(4∶1);展开距边缘线0.5 cm 时取出,晾干,置ZF-20A 型暗箱四用紫外分析仪中检视(波长365 nm)。见图2。3 批样品与益母草对照药材的色谱位置上,显相同颜色的淡蓝色荧光斑点,而阴性相应位置无斑点[1]。
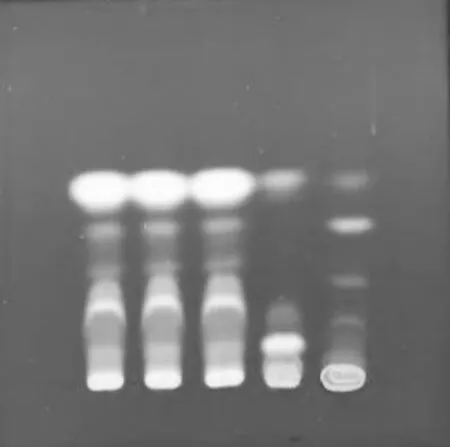
图2 益母草的薄层色谱图
2.2.3 山楂鉴别称取样品20 g 研磨成粉末后,加入50 mL 乙醚,浸泡30 min,超声处理5 min,滤纸滤过;滤液浓缩至残渣,再加入1 mL甲醇溶解。取山楂对照药材1 g,阴性样品(缺山楂)20 g,同上法制成对照溶液(阴性对照、山楂对照)。
取5 μL 点样管吸取上述3 种溶液,分别点于同一硅胶G 薄层板上,展开剂为甲苯-乙酸乙酯-甲酸(10∶2∶0.5);展开距边缘线1.5 cm 时取出,晾干,置ZF-20A 型暗箱四用紫外分析仪中检视(波长365 nm)。见图3。3批样品与山楂对照药材的相同色谱位置上,显相同颜色的淡蓝色荧光斑点,而阴性对照相应位置无斑点[1]。

图3 山楂的薄层色谱图
2.2.4 红花鉴别称取样品25 g 研磨成粉末后,加入50 mL的80%丙酮溶液,振摇提取(10 min);室温0 ℃以下(室内温度为零下)放置约20 min,滤纸滤过,收集初滤液作为供试品溶液。取红花对照药材0.5 g,取阴性样品25 g(缺红花),同上法制成对照溶液(阴性对照、红花对照)。
按照TLC《中华人民共和国药典》2015 年版一部附录Ⅵ B 试验,取5 μL 点样管吸取上述3 种溶液,分别点在同一硅胶G 薄层板(GF254),展开剂为正己烷-乙酸乙酯(3∶1);展开距边缘线2 cm 时,取出晾干,置于ZF-20A 型暗箱四用紫外分析仪中检视(波长254 nm)。见图4。3批样品与红花对照药材的相同色谱位置上,显相同颜色的暗色斑点,而阴性对照相应位置无斑点[1]。
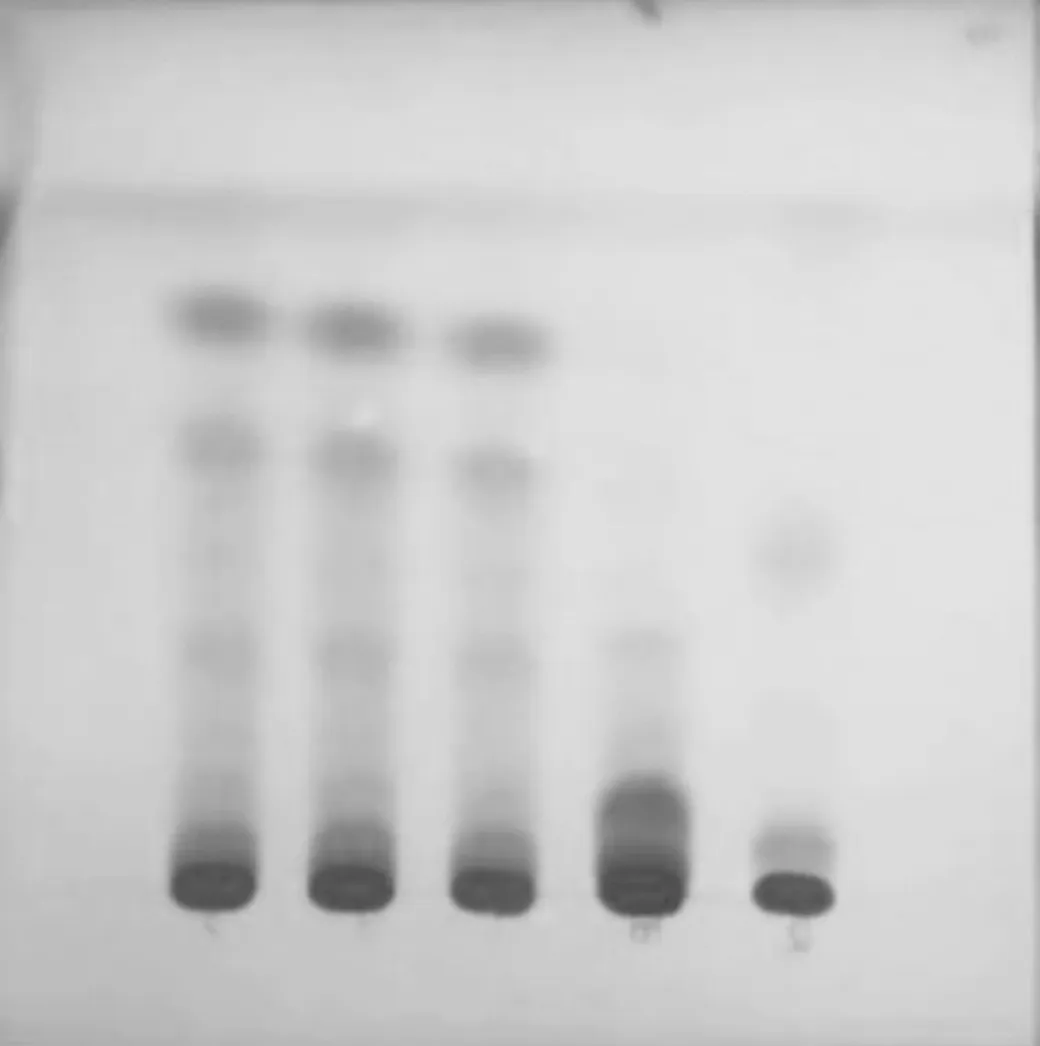
图4 红花的薄层色谱图
2.2.5 桃仁鉴别圆底烧瓶中称取样品10 g,加入50 mL 石油醚(60~90 ℃),回流60 min;滤过,留取药渣,再加入25 mL 石油醚洗涤;弃去石油醚,药渣挥干后加入30 mL 甲醇溶解,水浴加热回流60 min;放冷至室温后滤过,收集滤液作为供试品溶液。另取桃仁对照药材2 g 和阴性样品(缺桃仁)20 g,同上法制成作为对照溶液(阴性对照、桃仁对照)。
参照TLC((《中华人民共和国药典》2015年版四部通则0502)试验,取5 μL 点样管吸取上述3 种溶液,分别在同一硅胶G薄层板上条带状点样,将三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶22∶10)配好后置于5~10 ℃冰箱12 h,待分层后分取下层溶液作为展开剂;展开距边缘线2 cm时取出,立即喷以磷钼酸硫酸溶液(磷钼酸2 g,加水20 mL 溶解,再缓缓加入30 mL 硫酸,混合均匀),将薄层板放置在105 ℃的加热板上直至斑点显色清晰。见图5。3批样品与桃仁对照药材在相同色谱位置上,显相同的条状蓝色斑点,而阴性对照相应位置无斑点[1]。
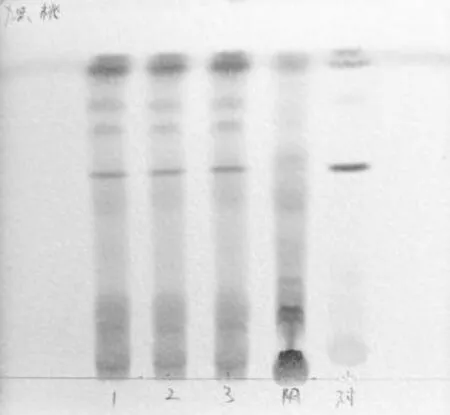
图5 桃仁的薄层色谱图
2.3 制剂稳定性考察
2.3.1 颗粒剂检验项目分类参照制剂通则,颗粒剂检验项目如下:外观性状、薄层鉴别、装量差异、水分(第二法)、粒度、阿魏酸含量测定、溶化性(该中药制剂含药材原粉,不检查溶化性)。
2.3.2 高湿对九味生化颗粒质量稳定性影响取适量颗粒精称,置于相对湿度为92.5%的容器中(其底部存放适量硝酸钾饱和溶液)。分别在第5 天和第10 天进行称重。由于在相对湿度92.5%放置时,称重结果表明质量增加大于5%,所以需同法取样,在相对湿度为75%(其底部存放适量氯化钠饱和溶液)的环境下考察,称重结果见表1。吸湿增重数值表明,在高湿环境时,九味生化颗粒因含有大量蔗糖而表现出较强的吸湿性,且易潮解霉变,因此保存需干燥密封[2]。

表1 湿度对九味生化颗粒质量稳定性的影响
2.3.3 高温对九味生化颗粒质量稳定性影响取适量颗粒置于敞口的干燥玻璃器皿中(厚度不超过2 mm),放置于恒温箱中(60 ℃),分别在第5 天和第10 天称取适量样品,并肉眼观察外观性状,以及进行TLC、水分测定、含量测定等,考察其稳定性。与第0 天数据对比,九味生化颗粒的外观性状没有明显变色、无分化、无结块、无色斑形成等,TLC、水分、含量测定均在合格范围内,说明本品在高温环境下质量较为稳定[3]。见表2。

表2 九味生化颗粒高温试验结果
2.3.4 强光照射对九味生化颗粒质量稳定性影响取适量颗粒置于敞口的干燥玻璃器皿中(厚度不超过2 mm),放置于强光照射试验箱中,控制光照强度为(4500±500)Lx,紫外强度为83~100 μW/cm2,温度为室温25 ℃。分别在第5 天和第10 天秤取适量颗粒,与第0 天数据进行对比。九味生化颗粒的外观性状没有明显变色、无分化、无结块、无色斑形成等,TLC、水分、含量测定均在合格范围内,说明本品在强光照设备环境下质量较为稳定[4]。见表3。
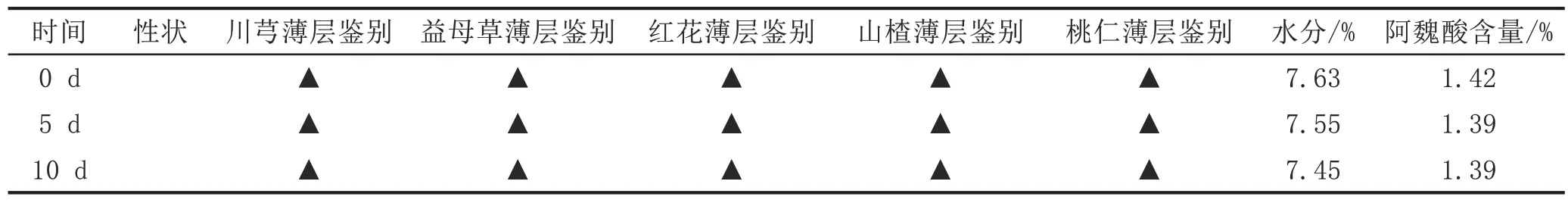
表3 九味生化颗粒强光照射试验结果
2.3.5 加速试验对九味生化颗粒质量稳定性影响同时将3 批九味生化颗粒选用铝塑复合膜包装后,存放于温度控制在(40±2)℃、相对湿度为(75±5)%的环境中6个月,分别在第1、2、3、6 个月底称取适量样品颗粒,与第0天数据进行对比。颗粒的外观性状没有明显变色、无分化、无结块、无色斑形成等,薄层鉴别符合规定,水分和含量略有降低但均未超出标准规定范围[5]。
2.3.6 长期试验对九味生化颗粒质量稳定性影响同时将3 批九味生化颗粒选用铝塑复合膜包装后,存放于温度控制在(25±2)℃、相对湿度为(60±10)%的环境中考察24 个月,分别在第0、3、6、12、18、24 个月底称取适量样品颗粒,同加速试验检测各项目。3 批样品虽然在保留过程中含量均略有降低,但直至保存到24个月时,其含量的保留率仍然保持在80%以上,各项指标均符合标准规定范围,说明本品在常温下质量稳定[6]。
3 讨论
九味生化颗粒为酒钢医院生产的纯中药颗粒剂,优点是便于携带、运输、贮藏及服用。但是中药制剂的成分复杂,大多数为亲水成分,因此稳定性研究是颗粒剂研发与生产中的关键部分。中药制剂颗粒剂如果贮藏不当,会发生吸潮、沉淀、变质等现象,对药物的有效成分及含量造成不良的影响,导致药物极易失效,从而产生毒副作用,影响临床效果[7]。
此次试验设计项目均为考察九味生化颗粒的质量稳定性而定。选定薄层鉴别药物时,由于处方中多种成分相互干扰,如川芎和当归都含有阿魏酸,泽兰和焦山楂都含有熊果酸,炮姜处方比例含量较低不适宜作为指标性成分进行鉴别,桃仁和红花使用《中华人民共和国药典》中收载的药材鉴别方法后,阴性有干扰等,重新摸索出了新的试验方法,选定川芎、益母草、红花、山楂、桃仁作为薄层鉴别的几味药[8]。
铝塑复合膜包装后的九味生化颗粒成品分别经高温、光照强度、6 个月的加速试验、24 个月的稳定性试验,结果表明,成品包装的九味生化颗粒含量下降不超过80%,其他各项考察指标均在质量标准控制范围内。参照中药制剂相关要求及稳定性试验结果分析,将九味生化颗粒的有效期暂定为24个月[4]。本次高湿试验研究表明,九味生化颗粒在室温(25±2)℃、相对湿度分别为(92.5±5)%和(75±5%)%的条件下存放10 d,出现部分结块及霉变现象,表明其有吸湿性,与本品含有大量蔗糖相关。虽然试验表明,高湿环境对九味生化颗粒的质量稳定性有一定的影响,但由于酒钢医院制剂生产环境所处的地理环境较为干燥,故只需在九味生化颗粒制备、分装与贮存时注意密封保存,环境对其质量稳定性影响不大[9]。

