京津冀地区猪繁殖与呼吸综合征流行特点及防控建议
杨丽景 ,鄢明华 ,王建军 ,任卫科 ,钱建旺 ,李富强 ,田向学 ,石俊鹏
(1.天津市宁河原种猪场有限责任公司,天津 301504;2.天津市农业科学院畜牧兽医研究所/天津市畜禽分子育种与生物技术重点实验室/国家动物疫病数据中心天津实验站,天津 300381)
猪繁殖与呼吸综合征(Porcine respiratory and reproductive syndrome,PRRS)俗称 “猪蓝耳病”,临床以母猪繁殖障碍和仔猪及生长猪群呼吸道症状为主要特征。该病1987年在美国东南部首次报道,之后迅速扩散至美国主要养猪地区和加拿大。1990年和1991年该病相继在欧洲和亚洲暴发和流行。PRRS于1995年传入我国大陆地区,随后陆续在其他省市报道。该病进入我国大陆地区以来,给养猪业造成了极其严重的经济损失,被许多猪场技术人员评价为最为难缠的疾病之一。
猪繁殖与呼吸综合征病毒(Porcine respiratory and reproductive syndrome virus ,PRRSV)是PRRS的病原,根据抗原性的不同,该病毒分为欧洲型(PRRSV-1)和美洲型(PRRSV-2)2个血清型。我国目前的流行毒株以PRRSV-2为主。2018年我国发生非洲猪瘟疫情以后,国内养猪企业普遍加强了疫病防控力度,猪场生物安全管理和疫病综合防控水平均得到显著提升,PRRS的流行也得到了一定的遏制。京津冀地处华北地区地处中部,夏季高温多雨,冬季寒冷干燥,是华北地区养猪最为集中的区域。据笔者调查,近年来该地区PRRSV的检出率在所有猪病病原之中位居前列,仍然需要加强对该病的防控。
1 京津冀地区PRRS的流行特点
1.1 临床发病率呈下降趋势
对2015—2023年临床送检病例的统计结果显示,2015—2018年PRRSV的检出率较高,但2019年以后PRRSV的检出率显著降低。表明在2018年我国非洲猪瘟暴发以后,随着规模猪场生物安全防控体系的不断完善和大量中小型养殖户的退出,该地区PRRSV的流行强度呈现明显下降的趋势,见图1。
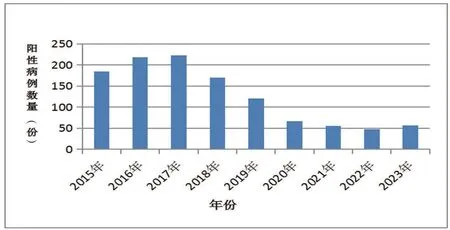
图1 不同年份临床送检PRRSV阳性病例统计
1.2 混合感染严重
混合感染增多是PRRSV感染猪群的一个重要发病特征。统计数据显示,2015—2023年京津冀地区临床送检的PRRSV阳性病例中,该病毒和其他病原发生混合感染的比例为52.04%,PRRSV和2种以上病原发生多重感染的比例为12.76%。对比非洲猪瘟疫情发生前后PRRSV混合感染的病原种类发现,疫情发生以前(2015—2018年)混合感染病原中,猪2型圆环病毒(Porcine circovirus 2,PCV2)最高,占24.12%;其后依次为猪链球菌(Streptococcus suis,SS)、猪 瘟 病毒(Swine fever virus,CSFV)、副猪嗜血杆菌(Haemophilus parasuis,HPS)、猪伪狂犬病毒(Pseudorabies virus ,PRV)和胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae ,APP)等病原,占比分别为14.12%、11.76%、8.24%、3.53%、2.35%。疫情发生以后(2019—2023年),混合感染病原占比较高的病原依次为PCV2(28.38%)、SS(8.56%)、APP(6.31%)、HPS(4.95%)、CSFV(3.60%)和PRV(1.35%),其中PCV2和APP感染率上升,CSFV、SS、HPS和PRV的占比下降,尤其是CSFV和PRV 2种病原,该地区2021—2023年的PRRSV阳性病料中均未检出,见图2。

图2 PRRSV主要混合感染病原占比统计*
1.3 阳性猪场中不同阶段猪群PRRSV的分布
对46例PRRS阳性猪场的调查结果显示,保育猪群PRRSV检出率最高,占42.11%,其次为生长育肥猪群和母猪群,分别为28.07%和24.56%;哺乳仔猪群PRRSV检出率最低,占5.26%。以上结果表明本地区不同阶段猪群均存在感染发病,其中保育猪群PRRSV感染最为严重。
1.4 不同季节PRRS流行情况
统计结果表明,京津冀地区一年四季都可发生PRRS,但相对而言,冬春季节PRRS发病率较高,流行较为严重,夏秋季节发病率较低。因此,应注意加强寒冷气候条件下的PRRS防控,见图3。

图3 不同季节PRRSV检出率分布
2 PRRS防控难点
2.1 病原变化速度快,流行毒株复杂多样
在我国大陆地区,PRRSV-2一直是优势流行毒株。1995年,郭宝清等在北京、辽宁、黑龙江等省市的部分猪场监测到了PRRS抗体,并从北京某发病猪场分离出我国第一 株PRRSV,CH-1a株。1997年杨汉春等分离到BJ-4株,以上2株病毒均属于PRRSV-2,这些毒株的NSP2基因均与PRRSV美国标准株VR2332具备相同的特征,统称为经典PRRSV (Classical porcine reproductive and respiratory syndrome virus,C-PRRSV),代 表 毒 株 为PRRSV Ch1a株、BJ-4和R98株等。2006年,我国爆发高致病性猪蓝耳病,其病原在NSP2基因aa481和aa531-561位置出现2处不连续的氨基酸缺失,命名为高致病性猪繁殖与呼吸综合征病毒(High pathogenic porcine respiratory and reproductive syndrome virus,HP-PRRSV)。此后的较长一段时间内,以HP-PRRSV江西株和湖南株等为代表的毒株成为我国的主要流行毒株。2014年前后,随着PRRSV类NADC30株在我国大陆地区出现,其后该毒株及其重组病毒逐渐成为新的优势流行株。2017年,PRRSV类NADC34株出现,近年来已经在包括京津冀在内的多个省份传播,且流行率呈逐年上升的趋势。
此外,我国自1997年就有发现PRRSV-1的报道,但一直未引起业内的关注。近年来,关于在我国检出PRRSV-1报道呈上升趋势,迄今已有包括京津冀在内的23个省市报道检测到PRRSV-1,这些省市广泛分布在中国的中部、北部、南部、东部、东北部和西南部。据Chao Li等(2022)报道,在河南省某农场发现PRRSV-1和PRRSV-2 HP-PRRSV、NADC30 like、VR2332like等毒株的混合感染。众多PRRSV毒株的出现,导致PRRS的流行情况日益复杂。由于不同毒株之间致病性和抗原性存在较大差异,给猪蓝耳病的防控带来了极大的挑战。
2.2 PRRSV感染持续时间长,难以清除
持续性感染是PRRSV最重要的流行病学特征之一。根据病毒感染后在猪体内的复制和排毒的情况,可将PRRS分为急性感染期(病毒血症期)、感染持续期(病毒血症结束至排毒结束)、病毒清除期(排毒结束至病毒被完全清除)三个阶段。Wills(1997)和Allende(2000)等的研究表明,PRRSV感染猪群后100~165 d,可以从感染猪的扁桃体和淋巴结检测到感染性的PRRSV。据Robert W.Wills等(2003)报 道,PRSSV感染后28 d和56 d分别可以从血清样品和扁桃体活组织检查样品中分离出病毒;采集感染后84 d的扁桃体样品进行病毒分 离,71.43%(20/28)样 品 的病毒分离培养物PRRSV RT-PCR检测结果为阳性,且可从感染后251 d采集的血清和扁桃体样品病毒分离培养物中检出PRRSV。2023年,本实验室对2个PRRS临床发病猪群进行跟踪监测,发现猪群发病以后3~4个月仍然可以从康复猪群中的病弱猪体内检测到PRRSV。这种持续性感染和排毒特性,是造成猪群中PRRSV长期存在和循环传播,难以防控和清除的重要原因。
2.3 PRRSV可侵害免疫系统,引起免疫抑制
PRRSV进入机体后主要在单核巨噬细胞系统内复制,并扩散到全身多处组织的巨噬细胞和单核细胞中,造成免疫细胞尤其是肺泡巨噬细胞的损伤。因此,PRRSV感染以后,一方面造成先天性免疫功能受损,导致混合感染和继发感染几率上升。据报道,PRRSV可与猪2型圆环病毒、猪流感病毒、猪伪狂犬病病毒、猪瘟病毒、非洲猪瘟病毒、猪肺炎支原体、副猪嗜血杆菌、猪链球菌、传染性胸膜肺炎放线杆菌、猪巴氏杆菌等多种病原发生混合感染或者继发感染,加重疫情和增加损失。
另一方面,PRRSV感染会引起获得性免疫功能下调和延迟,导致猪瘟、口蹄疫等其他疫苗诱导的免疫反应降低,免疫效果打折扣甚至发生免疫失败。李华等(2001)用PRRSV BJ-4分离株经鼻内途径人工感染20日龄SPF猪和20日龄PRRS血清抗体阳性猪后48 h接种猪瘟疫苗,结果显示不论是SPF仔猪还是PRRSV抗体阳性仔猪,其对猪瘟疫苗的抗体反应均显著低于对照组,表明仔猪在感染 PRRSV后,对猪瘟疫苗的体液免疫应答受到明显抑制。杨苗等(2016)对四川省某发生PRRS与圆环病毒2型(PCV2)混合感染的猪群的猪瘟抗体进行了比较,结果显示发病猪群的猪瘟抗体合格率为 33%,显著低于健康对照组的合格率83.3%。
2.4 隐性感染和亚临床感染普遍
大量的研究表明,我国猪群中PRRSV隐性感染非常普遍,很多猪群携带PRRSV但不表现明显的临床症状。韩庆安等采用RT-PCR方法对2006—2009年采自河北省11个地市228个县级屠宰场1 565份商品猪的肺或肺门淋巴结样品进行了PRRSV检测,结果被检测样品的总体阳性率为45.18%。高许雷等对2008—2009年我国五省区屠宰场的218份样品进行了HP-PRRSV的RT-PCR检测,结果检出阳性率为44%。本实验室2023年从京津冀地区14个外观无临床症状、未接种PRRS疫苗的猪场采集518份保育猪血清样品,应用IDEXX公司的PRRS抗体ELISA检测试剂盒进行检测,结果显示PRRSV抗体阳性猪场占抗体监测猪场总数的85.71%(12/14), PRRSV-N抗体阴性场占14.28%(2/14);总样品阳性率为58.49%(303/518),表明被调查的未免疫猪场保育猪群PRRSV感染率超过了50%。由于无症状的隐性或亚临床感染猪也可能携带大量病毒,因此这些猪群也可能成为PRRSV的重要传染源,但因其隐匿而容易被忽视。此外,这些隐性的亚临床感染猪群,虽然通常感染猪的免疫系统和病毒处于一种平衡状态,不表现临床症状,但在出现较大的生产应激或者猪群因其他疾病等原因导致抵抗力下降时,可能诱发PRRS而造成损失。
2.5 疫苗本身存在不足
疫苗在我国PRRS防控过程中发挥了重要作用。迄今国内外均已研制出PRRS弱毒活疫苗和灭活疫苗用于该病的预防。然而,和猪瘟疫苗等免疫效果比较理想的疫苗相比,目前市场销售的PRRS疫苗还存在一些不足,比如没有任何一种疫苗可以对不同PRRSV毒株的攻击提供100%保护,接种疫苗以后虽然可以降低PRRS发病率,但不能完全阻止PRRSV野毒的感染等。
此外,抗体依赖性增强作用(Antibody dependent enhancement,ADE)是PRRSV一个重要免疫学特征。在ADE作用下猪体产生的抗体不仅不能提供免疫保护反而有助于病毒的复制。特别是妊娠后期可能由于ADE效应而造成母猪流产、产死胎和木乃伊胎;仔猪也可能因低水平母源抗体的存在对PRRSV更易感。同时,PRRSV的另一个免疫学特征是中和抗体产生延迟,由于PRRS疫苗免疫或者野毒感染以后诱导机体产生的中和抗体水平较低,且中和抗体产生的时间较晚,而先于中和抗体产生的非中和抗体和产生的低水平中和抗体因ADE作用促进病毒进行大量复制,从而加重感染猪的临床症状。
3 PRRS防控建议
3.1 加强生物安全防控措施
良好的生物安全措施是猪场有效防控PRRS的基础。猪场的生物安全措施包括场外生物安全措施和场内生物安全措施2个部分。
场外生物安全措施的核心是构建猪场防火墙,防止病毒进入猪场,主要包括以下4个方面:(1)科学的选址和合理布局。猪场选址应尽量远离养殖场、屠宰场、无害化处理厂、贸易市场、主干道和人口聚集的居民区、学校等,科学的地理位置会降低猪场受周边其他猪场影响而感染PRRSV的概率。猪场建设的合理布局也有利于PRRS的防控,比如两点式和三点式布局优于单点式饲养模式,种猪和产房一般处于猪场的上风向和比较安全的区域,生长育肥猪处于下风向和接近装猪台。(2)加强车辆管理和消毒。猪场应配备专用场外拉猪车,用于将售卖的猪只运输到距离猪场300 m以上的区域,转移到场外拉猪车上进行销售。卖猪过程中要注意本场转猪车不能和场外拉猪车接触,行驶轨迹不要和场外拉猪车交叉。本场拉猪车每次使用后必须进行彻底清洗和消毒,每次卖猪,同一辆车只往返一次。没有拉猪车或者车辆不能满足卖猪需要的猪场,建议租借农用车卖猪,每辆车每次销售只允许拉猪1次,避免交叉污染。严禁场外车辆进入场内尤其是生产区。(3)加强人员隔离和消毒。谢绝场外人员进入猪场参观,尽量减少场外人员非必要入场次数。所有人员进入猪场前都要更换场内专用的衣物和鞋袜,经淋浴、消毒以后方可进入。售猪人员严禁和拉猪人员直接接触,售猪以后当天不得直接返回生产区。(4)建议设置场外装猪台或单独的销售区,粪场距离猪舍最近距离50 m以上,尽量减少拉猪车、拉粪车等场外高风险车辆近距离靠近猪场,通过合理的空间距离最大限度降低PRRSV通过气溶胶和空气传入的概率。
猪场内部生物安全措施主要包括净道污道完全分离、同一生产阶段或同一栋舍猪群全进全出、带猪栋舍日常卫生消毒、空舍终末消毒、禁止不同生产岗位人员串岗和交叉使用工具等。主要目的是减少PRRSV在猪场内不同阶段和不同栋舍猪群之间的交叉感染和循环传播,发生疫情时及时进行隔离和消毒,切断PPRS由发病猪群向其他栋舍传播的途径,阻止和延缓疫情扩散,为采集应急措施赢得时间,降低疫情带来的损失。
3.2 做好引种和外购猪的检疫和隔离
引种是造成猪场PRRS不稳定或者发病最为常见的因素之一。由于我国猪群PRRSV感染率非常高,发病猪群临床症状消失以后可以长期带毒、排毒,一旦引入带毒的种猪,发生PRRS的风险极高。因此,严格执行引种和外购猪群检疫及隔离是猪场防控PRRS非常必要和有效的措施。推荐选择PRRS抗原抗体双阴的种猪场作为种猪供应场,或者抗原阴性抗体S/P值均低于2.0且无疑似PRRS临床表现的猪群。后备猪群到场后,需隔离饲养45 d,期间按照免疫程序进行配种前相关疫苗免疫、PRRS抗原抗体监测和临床观察。对于PRRS阳性场和免疫场,应在隔离期间对引进的后备猪进行PRRS疫苗免疫或者使用本猪场PRRSV流行株进行驯化。临床实践证明,相对闭群对于PRRS的防控具有较好的效果,因此,猪场应适当控制引种频率。此外,感染PRRSV的公猪可以通过精液大量排毒,外购精液的猪场,应注意加强精液中PRRSV监测,避免因精液带毒造成损失。
3.3 加强饲养管理,提高猪群抗病力
对于隐性感染和亚临床感染的猪群而言,强烈的生产应激和发生其他呼吸道疾病往往是猪群发生PRRS的导火索。在寒冬季节,京津冀地区因贼风受凉引发猪流感,继而引起PRRS暴发的案例屡见不鲜,因此,良好的饲养管理是确保猪群稳定生产的重要保障。猪场应通过提供全面丰富的营养增强体质,提高猪群抗病力;维持良好的空气环境,减少呼吸道应激;冬季应做好猪舍防寒保暖,预防因冷应激导致猪群抵抗力下降而诱发PRRS的风险。此外,要做好其他疾病尤其是猪流感、猪肺炎支原体病、猪2型圆环病毒感染等猪呼吸道综合征相关疾病的防控,这些疾病的发生,均会降低猪群抵抗力,促进PRRSV的感染或增强其在猪体内的复制,诱发疾病和加重PRRS病情。
3.4 科学实施疫苗免疫
目前我国上市的PRRS疫苗包括减毒活疫苗和灭活疫苗两大类,按照疫苗使用毒株的不同进行分类,已经上市的商品化疫苗有11个品种,包括7种减毒活疫苗(3种经典株疫苗和4种高致病性毒株疫苗)和4种灭活疫苗(3种经典株灭活疫苗和1种高致病性毒株灭活疫苗)。由于不同品种的疫苗使用的PRRSV毒株不同,免疫后诱导产生的细胞免疫和体液免疫规律也不尽相同。养猪企业使用PRRS疫苗应注意以下几点:(1)应根据PRRS在猪场的感染和发病情况(发病场、阳性不稳定场、阳性稳定场和阴性场)以及猪场的周边环境、经营管理目标确定是否使用疫苗和选择合适的疫苗品种;(2)根据不同疫苗毒株的自身免疫学特性和疫苗有效抗原含量科学合理的制定免疫程序,建议同一个猪场不要同时使用2种及以上活毒疫苗;(3)避免ADE效应对PRRSV的毒力增强作用,推荐仔猪和生长猪首次免疫使用弱毒疫苗,种猪尤其是种公猪和基础母猪使用灭活疫苗;(4)注意监测种公猪免疫后是否存在精液带毒现象,必要时实施分批次免疫;(5)后备母猪使用弱毒疫苗或者猪场流行株进行驯化,应考虑疫苗毒和流行株在后备猪群中的持续性感染时间,推荐驯化时间选择80-100日龄;(6)首次使用PRRS疫苗的猪群,应先对猪群的PRRSV感染状况进行摸底调查,确定没有风险之后再实施免疫。
3.5 做好PRRS抗原抗体监测
PRRS抗原抗体监测是猪场了解本场猪群蓝耳病病毒感染状态、制定和优化免疫程序的重要依据,也是实施猪场PRRS精确诊断的重要手段。养猪企业应定期对不同阶段猪群的PRRSV抗原抗体进行监测,掌握猪群PRRSV感染的动态和抗体变化规律,在此基础上制定疫苗免疫程序和药物保健方案。由于PRRSV存在中和抗体延迟效应和ADE效应,实施疫苗接种应综合考虑猪群PRRSV感染状况和抗体水平。据曲向阳(2018)报道,断奶仔猪PRRSV野毒感染比例较低时,接种PRRSVMLV活疫苗有助于降低死淘率,但PRRSV野毒感染比例较高时,应用MLV疫苗免疫反而会增加死淘率与动保费用,提示已感染PRRSV仔猪群不适宜免疫PRRSV MLV。因此,养猪企业应及时监测猪群带毒情况和抗体变化规律,根据猪群的PRRSV实际感染状态制定免疫方案和确定接种时间,避免造成不必要的的损失。对于暴发PRRS的猪群,应根据猪群的PRRSV感染严重程度,慎重选择合适的疫苗进行紧急免疫接种。
3.6 控制继发感染
在大多数情况下,PRRSV单独感染造成的损失较小,死淘率较低。然而,猪2型圆环病毒感染、喘气病、猪链球菌病、副猪嗜血杆菌病、猪传染性胸膜肺炎和其他疾病的继发感染,会造成病情加重,死淘率上升。因此,猪场平时应做好猪瘟、猪圆环病毒2型、喘气病、副猪嗜血杆菌病等相关疾病的疫苗免疫接种。同时,可选择泰万菌素、替米考星、板青颗粒、黄芪多糖等药物进行保健。必要时可以采集样品分离细菌,通过药敏试验选择高敏药物用于防治继发感染。
4 结语
在非洲猪瘟疫情防控大背景下,PRRS仍然是当前严重威胁我国养猪安全生产一种重要传染病。2021年5月1日修订施行的《动物防疫法》明确将“净化消灭”纳入动物防疫的方针和要求。同年农业农村部印发的《关于推进动物疫病净化工作的意见》明确提出,计划通过5年时间,建成一批高水平的动物疫病净化场,至少80%的国家畜禽核心育种场通过省级或国家级动物疫病净化场评估,PRRS也被列入净化目标。实施动物疫病净化,是动物疫病防控的重要路径,也是动物疫病防控的最终目标。目前,我国PRRS净化技术手段已经非常成熟,部分国家核心种猪场已经实施并完成该病的净化。但由于猪群带毒率高,且环境PRRSV污染比较严重,猪场长期维持PRRS净化状态面临巨大的挑战,一些猪场往往完成净化以后不久又重新转阳。因此,猪场应根据自身的环境设施条件、生产管理水平、人员素质、经营定位规划和经济效益等综合考虑,确定PRRS的防控目标,在适当的时机实施净化策略。

