KIF26B在膀胱癌组织中的表达及对膀胱癌细胞增殖、侵袭、迁移的影响
卢保德 龙 贤 黄勇平
膀胱癌是泌尿系统常见的恶性肿瘤,复发率高[1]。手术切除是膀胱癌治疗的主要手段,但大部分患者5年内会复发和进一步发展,最终发生转移,发生转移患者大部分在2年内死亡,病死率高[2,3]。因此,研究膀胱癌复发、转移的原因及机制对膀胱癌防治有重要意义。驱动蛋白家族成员26B(kinesin family member 26B, KIF26B)是驱动蛋白超家族成员之一,在细胞运输和有丝分裂中有重要作用。驱动蛋白一类可沿微管轨道运动的分子马达蛋白,在纺锤体形成、染色体凝聚分离、细胞分裂等方面具有重要作用,目前在人类中发现有45个功能不同的成员[4]。
近年来,越来越多的驱动蛋白成员被报道与癌症的发生、发展有关,如KIF4A在肝癌中高表达,高表达KIF4A可促进肝癌细胞的增殖[5]。KIFC1与前列腺癌预后不良有关[6]。KIF2A与骨肉瘤分期和预后相关,敲除KIF2A可抑制骨肉瘤细胞生长和转移[7]。KIF23可通过Wnt/β-catenin信号通路调控结直肠癌细胞的增殖和侵袭[8]。KIF26B在多种恶性肿瘤中异常表达,参与癌症的增殖和转移过程,高表达KIF26B可通过激活FGF2/ERK信号通路促进乳腺癌细胞增殖和迁移,KIF26B表达水平与乳腺癌肿瘤直径、TNM分期、分化有关[9]。但KIF26B在膀胱癌中的作用尚未明确。本研究将利用公共数据库分析KIF26B在膀胱癌组织中的表达及与患者生存预后的关系,同时沉默KIF26B后,观察膀胱癌T24细胞增殖、侵袭、迁移能力的变化,并初步探讨其分子机制。
材料与方法
1.主要材料:膀胱癌细胞系(T24、J82)和膀胱正常细胞SV-HUV-1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;Trizol购自天根生化科技(北京)有限公司;胎牛血清购自美国Gibco公司;1640培养基购自美国Hyclone公司;MTT试剂盒购自生工生物工程(上海)股份有限公司;转染试剂购自美国Invitrogen公司;KIF26B siRNA由湖州河马生物科技有限公司设计与合成;p-MEK、MEK、ERK、p-ERK抗体购自安诺伦(北京)生物科技有限公司。
2.生物信息学分析KIF26B在膀胱癌组织中的表达及预后:在GEO数据库中下载数据集GSE13507“Series Matrix file”文件,数据集中含有膀胱癌组织165例,癌旁正常组织68例,数据集内容包含患者性别、年龄、基因表达量等信息,KIF26B对应的探针为ILMN_1673620。以KIF26B表达中位数为界,分为KIF26B高表达组和KIF26B低表达组,用UaLcan数据库在线分析KIF26B表达与膀胱癌患者预后的关系[10]。
3.细胞培养:T24、J82和SV-HUV-1细胞用含10%胎牛血清、1%双抗的1640培养基,在37℃饱和湿度、含5%CO2的培养箱中培养。
4.实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测细胞KIF26B mRNA表达:Trizol法提取细胞中的总RNA,反转录合成cDNA,用primer6进行引物设计,合成由生工生物工程(上海)股份有限公司完成。引物序列如下:KIF26B上游引物:5′-GCTTCTCAGGCTGAAGTGTG-3′,下游引物:5′-GTAGGATTTTCCAGTTTGGCGTGG-3′;GAPDH上游引物:5′-CCAGGTGGTCTCCTCTGA-3′,下游引物:5′-GCTGTAGCCAAATTCGTTGT-3′。反应条件:94℃预变性10min,95℃变性5s,60℃退火15s,72℃延伸10s,40个循环。记录CT值,计算基因相对表达量。采用ImageJ软件进行分析,以GAPDH为内参,观察结果。
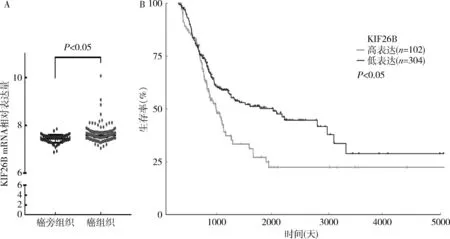
图1 KIF26B在膀胱癌组织中的表达及生存分析
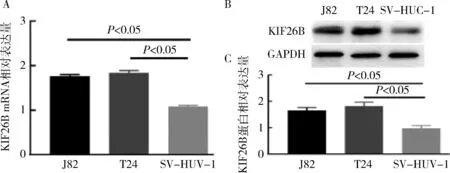
图2 KIF26B在膀胱癌细胞T24、J82、SV-HUV-1中的表达量
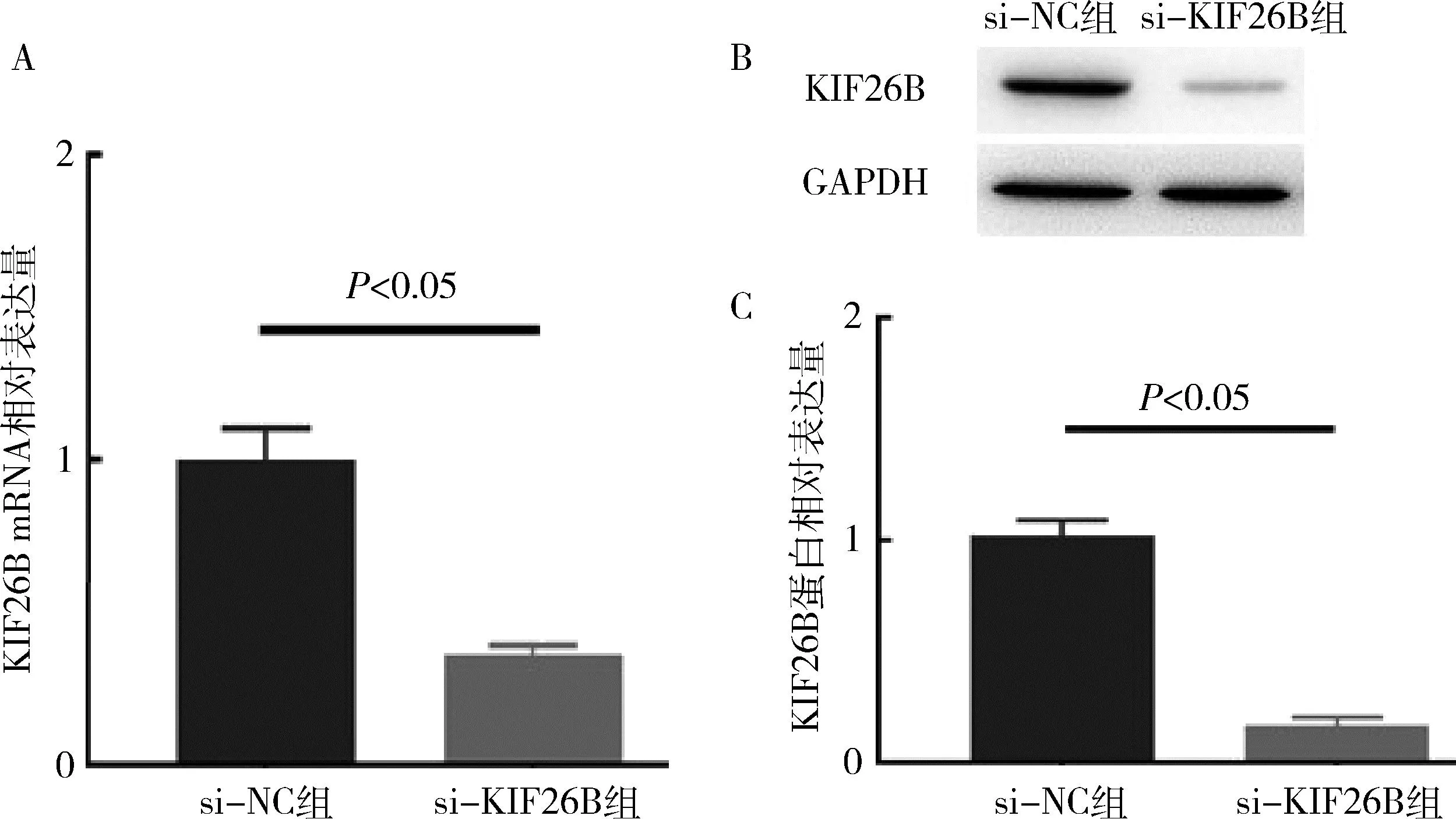
图3 转染后T24细胞中KIF26B的表达量
5.Western blot法检测KIF26B蛋白表达水平:收集对数生长期的各组细胞(T24、BIU-87、SV-HUV-1),用放射免疫沉淀缓冲液(radioimmunoprecipitation assay buffer,RIPA)裂解细胞,提取KIF26B蛋白,用BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)测定蛋白浓度。取各组蛋白样品40μg,经凝胶电泳分离后转至聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜上,用浓度为5%的脱脂奶粉封闭2h,加入抗KIF26B抗体孵育,4℃过夜。洗膜3次,加入二抗,室温孵育2h后,化学发光法检测蛋白表达水平。
6.细胞转染:将T24细胞分为对照组(si-NC组)和沉默组(si-KIF26B组),转染前1天,在无抗培养基中接种(0.5~2.0)×105个细胞,转染时细胞融合度为50%,分别稀释siRNA和转染试剂并混匀后加入到24孔板中,轻摇细胞板混合均匀,置于37℃、5%CO2培养箱中培养24~48h。用RT-qPCR和Western blot法检测转染效率。
7.噻唑蓝(methyl thiazolyl tetrazolium, MTT)法检测:细胞转染48h后,将细胞接种到96孔板中,待细胞贴壁后,按实验要求进行药物处理,于0、24、48、72h后进行MTT法检测。各组细胞在检测时间点时,每孔加1/10体积MTT溶液,在37℃、5%CO2培养箱中培养4h。在酶标仪上波长为490nm处测定各孔吸光度(A)值,以时间为横坐标,A490nm为纵坐标,绘制细胞生长曲线。
8.Transwell实验:将Matrigel基质胶稀释,小室各加100μl(20~30微克/孔),放入培养箱中待其凝固,出现“白色层”取出小室;取出小室后,加入无血清培养基,放入培养箱水化30min;吸掉培养基后用胰酶消化收集状态良好的目的细胞,制成单细胞悬液(无血清培养基配置);上室加300μl调好密度的细胞悬液(3×104个);下室加500μl全培养基(侵袭小室外);于37℃、5% CO2培养箱中培养相应时间;用4%多聚甲醛室温固定20min,用棉签擦拭去除侵袭小室内未穿过基底层膜的细胞,新24孔板中加入结晶紫染色,将侵袭小室浸入染色10min后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗去多余的染料,置于空气中晾干;显微镜拍照,计算各孔穿过膜的细胞数量。
9.划痕实验:将已转染的T24细胞用胰酶消化后,将细胞接种到6孔板中,待细胞铺满单层后用移液器枪头比着直尺,尽量垂至于背后的横线划痕;PBS清洗细胞,去除划下的细胞;加入含2%胎牛血清的培养基继续培养,于相应时间在100倍镜下进行拍照。
10.Western blot法检测沉默KIF26B表达对T24细胞MEK、p-MEK、ERK、p-ERK蛋白表达的影响:将KIF26B 对照组细胞株(si-NC)和KIF26B沉默细胞株(si-KIF26B)进行扩大培养,以抗p-MEK、抗MEK、抗ERK、抗p-ERK为一抗,其余方法同材料与方法5。
结 果
1.生物信息学分析KIF26B在膀胱癌组织中的表达及预后:GEO数据库分析结果显示,KIF26B在膀胱癌组织中相对表达水平显著高于癌旁组织(P<0.05),详见图1A。Kaplan-Meier生存分析显示,KIF26B高表达组的膀胱癌患者总体生存期明显低于低表达组(P<0.05),详见图1B。
2.KIF26B在膀胱癌细胞中的表达:RT-qPCR检测结果显示,KIF26B mRNA在J82、T24、SV-HUV-1中的表达量分别为1.76±0.02、1.83±0.03、1.08±0.04,与SV-HUV-1比较,膀胱癌细胞系J82及T24中KIF26B mRNA的相对表达量明显升高(P<0.05,图2A)。Western blot法检测结果显示,KIF26B蛋白在膀胱癌细胞T24、J82中的相对表达量均高于正常膀胱上皮细胞SV-HUV-1,(P<0.05,图2中B、C)。因KIF26B在T24细胞中表达最高,选择T24细胞进行下一步实验。
3.转染后T24细胞中KIF26B mRNA和蛋白的表达情况:RT-qPCR检测结果显示,si-KIF26B组中KIF26B mRNA的表达水平显著低si-NC组(P<0.05,图3A)。Western blot法检测结果显示,si-KIF26B组中KIF26B蛋白的表达水平低于si-NC组(P<0.05,图3中B、C)。表明T24细胞中KIF26B表达被有效抑制,可用于下一步功能研究。
4.沉默KIF26B对膀胱癌细胞增殖的影响:采用MTT法检测沉默KIF26B表达对T24细胞增殖的影响,结果显示,si-NC组在48h的A值为0.788±0.003,si-KIF26B组为0.596±0.003,两组比较,差异有统计学意义(t=40.29,P<0.05)。si-KIF26B组在72h的A值为1.274±0.139,si-NC组为0.891±0.033,差异有统计学意义(t=10.81,P<0.05),详见图4。表明沉默KIF26B后,膀胱癌T24细胞的增殖能力明显下降。

图4 两组细胞MTT增殖曲线图
5.沉默KIF26B后对膀胱癌细胞侵袭的影响:通过Transwell实验检测细胞侵袭能力的变化,结果显示,si-KIF26B组穿过小室膜的细胞数为90.67±6.33,si-NC组为201.71±7.69,差异有统计学意义(t=11.14,P<0.05),详见图5。表明沉默KIF26B后细胞侵袭能力减弱。
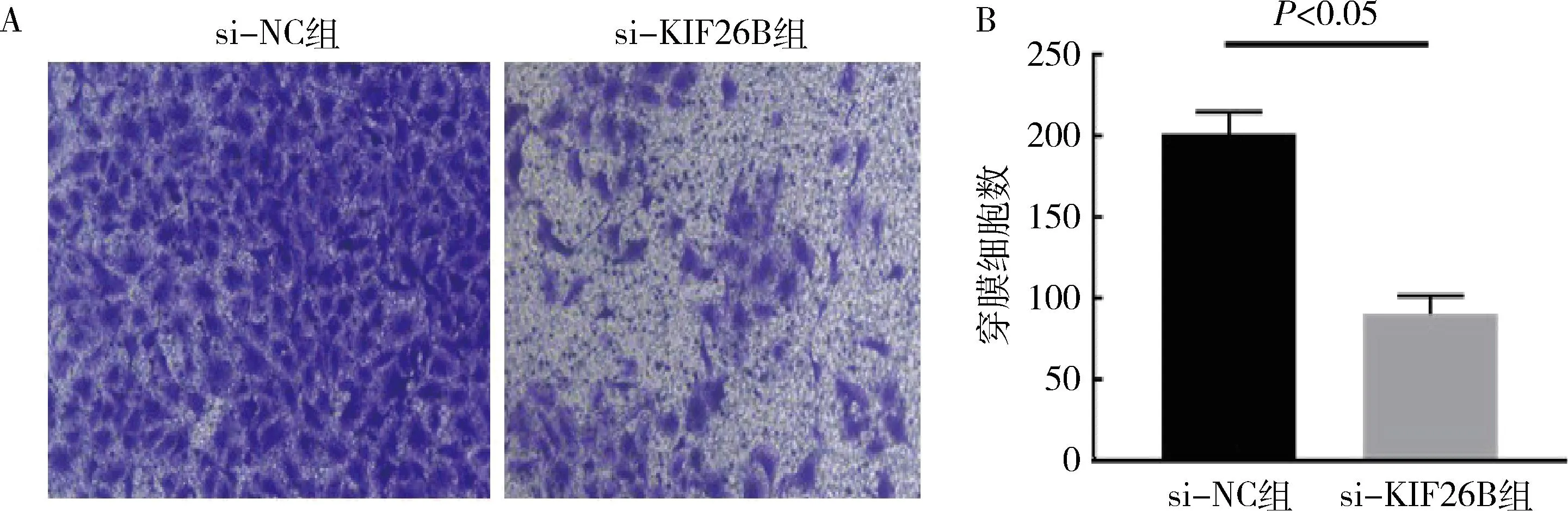
图5 KIF26B基因沉默对膀胱癌T24细胞侵袭能力的影响
6.沉默KIF26B后对膀胱癌细胞迁移的影响:划痕实验检测T24细胞转染KIF26B siRNA后细胞迁移的变化,结果显示,si-KIF26B细胞24h的愈合率为60.19%±2.43%,si-NC组为96.67%±3.33%,差异有统计学意义(t=8.85,P<0.05),详见图6。表明沉默KIF26B后,T24细胞迁移能力下降。

图6 沉默KIF26B对膀胱癌T24细胞迁移的影响
7.沉默KIF26B对MEK/ERK信号通路蛋白表达的影响:沉默KIF26B表达后,si-NC组和si-KIF26B组中MEK、ERK蛋白的相对表达量未见明显差异;而在si-KIF26B组中,p-ERK、p-MEK蛋白的相对表达量明显低于si-NC组(P<0.05),详见图7。
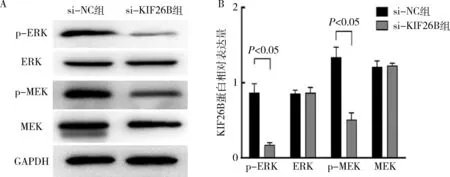
图7 沉默KIF26B后p-ERK、ERK、p-MEK、MEK蛋白表达变化
讨 论
膀胱癌病因未明,其发生率高,易复发。世界范围内膀胱癌的发生率在男性恶性肿瘤中排第7位[11]。我国膀胱癌发生率为5.8/10万,病死率为1.31/10万,城市发生率高于农村[12]。膀胱癌病理类型以尿路上皮癌最常见,大约占90%,手术为主要治疗方式,但复发率和进展率高,在5年内复发的患者比例占到70%,有10%~30%的患者进展为肌层浸润性尿路上皮癌[13]。浸润性膀胱癌易复发和转移,为膀胱癌死亡的主要因素,研究膀胱癌侵袭、转移的特征及分子机制,对膀胱癌的诊治有重要意义。
KIF26B为驱动蛋白家族成员之一,驱动蛋白可沿微管定向运动,主要参与细胞内mRNA、囊泡、生长因子、转录因子等物质转运,与细胞内信号转导、有丝分裂、免疫反应、细胞分化和凋亡等病理生理过程密切相关,驱动蛋白突变可引起细胞有丝分裂停止和凋亡[14~16]。此外,KIF26B对间充质细胞的黏附和极化具有重要作用,其机制可能是通过Wnt5a/Ror信号通路调节细胞骨架,影响细胞的迁移、极化和黏附[17,18]。有研究表明,干扰KIF26B的表达可抑制乳腺癌细胞的增殖、侵袭及迁移能力。
本研究先通过GEO数据库分析KIF26B在膀胱癌组织中的表达水平,结果显示,KIF26B在膀胱癌组织中的表达高于癌旁组织,同时在细胞水平上进行检测,发现KIF26B在膀胱癌细胞中的表达亦明显高于正常膀胱上皮细胞。进一步在UaLcan数据库中进行生存分析发现,KIF26B高表达的膀胱癌患者生存预后更差,提示KIF26B可能是膀胱癌诊断和预后的标志物。为进一步揭示KIF26B在膀胱癌中的作用,本研究在沉默KIF26B后,检测膀胱癌细胞增殖能力的变化,结果显示,膀胱癌细胞的增殖能力明显下降。进一步检测膀胱癌细胞侵袭和迁移能力的变化,发现沉默KIF26B基因后,膀胱癌细胞的侵袭和迁移能力明显下降,说明KIF26B表达异常可影响膀胱癌细胞增殖、侵袭、迁移的能力,但KIF26B是如何影响癌细胞的增殖、侵袭,目前尚不明确。
有研究对KIF26B基因进行富集分析发现,KIF26B在肿瘤中的作用机制与PI3K/Akt信号通路、细胞凋亡、细胞周期通路关系密切。Zhang等[19]研究发现,KIF26B在胃癌中通过激活VEGF信号通路促进癌细胞增殖和转移。而Liu等[20]在髓母细胞瘤中研究发现,沉默KIF26B后,癌细胞增殖、迁移能力明显下降,其机制为通过激活PI3K/Akt通路促进肿瘤的恶性进展。MEK/ERK信号通路为经典的激酶通路,也是被研究最多的通路之一,参与细胞增殖、分化、转移等调控过程。本研究发现,在沉默KIF26B后,膀胱癌T24细胞中MEK、ERK蛋白表达水平无明显变化,而p-MEK、p-ERK蛋白的表达明显下调,提示沉默KIF26B可能通过抑制MEK/ERK通路活性调控膀胱癌细胞的增殖、侵袭。
综上所述,KIF26B在膀胱癌组织和细胞中表达水平升高,与患者的预后不良有关,沉默KIF26B后,膀胱癌细胞增殖、侵袭、迁移能力下降,其机制可能是通过影响MEK/ERK信号通路而发挥作用。但本研究仅在体外探索KIF26B对膀胱癌的作用,缺乏体内动物实验及直接机制探索,因此KIF26B在膀胱癌中的具体作用机制仍有待于进一步研究。

