上皮性卵巢癌化疗耐药组织中PARP1 与铁死亡的相关性及临床意义
罗锐 王利侠 江汝伟
上皮性卵巢癌的早期症状缺乏特异性,大多数患者首次确诊时已处于晚期,以铂类药物为基础的联合化疗是治疗晚期卵巢癌的一线方案[1]。但是,晚期卵巢癌对铂类化疗药物的敏感性存在个体差异,化疗过程中发生耐药会导致肿瘤复发、转移,从而影响生存预后。目前,卵巢癌化疗耐药的机制尚不十分清楚,有研究认为卵巢癌化疗耐药可能与凋亡、自噬、铁死亡等生物学环节的异常有关,其中铁死亡直接参与非凋亡性细胞死亡的调控、也与细胞自噬和凋亡存在密切关系,激活铁死亡显著改善改善卵巢癌化疗耐药[2]。聚腺苷二磷酸核糖聚合酶1(poly⁃ADP⁃ribose polymerase 1,PARP1)参与基因组稳定、细胞周期、DNA 损伤修复等调控,PARP1 抑制剂展现出抑癌的治疗价值。相关细胞实验表明抑制PAPR1 对卵巢癌细胞的铁死亡具有激活作用[3]。因此,本研究以接受铂类化疗的上皮性卵巢癌患者为对象,分析上皮性卵巢癌化疗耐药组织中PARP1 与铁死亡的相关性及临床意义,旨在为今后深入认识上皮性卵巢癌化疗耐药的机制提供依据。
1 资料与方法
1.1 一般资料
选择2019 年2 月至2023 年2 月期间在安徽省阜阳市颍上县人民医院经病理诊断为上皮性卵巢癌的患者,纳入标准:①经病理确诊,FIGO 分期Ⅰ~Ⅳ期[4];②接受铂类为基础的化疗≥4 次且疗效等级为有效;③临床资料完整;④化疗前留取研究所需的临床组织样本。⑤本研究经所有患者家属知情并签署同意书。排除标准:①入组前接受过放化疗;②既往有其他恶性肿瘤病史;③合并心肝肾功能不全。共80 例患者,年龄(56.51±4.95)岁,FIGO 分期Ⅰ~Ⅱ期46 例、Ⅲ~Ⅳ期34 例,肿瘤直径(3.75±0.39)cm。本研究经院伦理委员会同意批准。
1.2 化疗耐药的评价标准
参照研究[5]评价化疗耐药,方法如下:化疗敏感的标准为化疗后有效,停药6 个月以上未出现复发;化疗耐药的标准为化疗后有效,停药6 月内出现复发。复发的证据如下[4]:①CA125 水平升高;②出现胸水或腹水;③体检发现局部肿块;④影像学检查发现肿块;⑤不明原因肠梗阻。存在上述两项或两项以上指标即可考虑为上皮性卵巢癌复发。
1.3 免疫组化检测
取石蜡包埋的化疗前卵巢癌组织,制作病理切片后采用生物素⁃链霉卵白素免疫组化检测试剂盒对PARP1 的表达进行免疫组化检测,在显微镜下观察PARP1 的染色情况,染色呈黄色或黄褐色为阳性。染色强度评分如下:阴性为0 分,弱阳性为1 分,中等阳性为2 分,强阳性为3 分;细胞阳性率评分如下:不足5%为0 分,5~25%为1 分,26~50%为2 分,51~75%为3 分,超 过75%为4 分。染色强度评分与细胞阳性率评分的乘积0~7 分为低表达、8~12 分为高表达[5]。
1.4 荧光定量PCR 检测
取化疗前冷冻的卵巢癌组织约100 mg,采用总RNA 提取试剂盒提取组织RNA,采用cDNA 第一链合成试剂盒将RNA 反转录为cDNA,采用荧光定量检测试剂盒对cDNA 中的GPX4、SLC7A11、TfR1进行荧光定量PCR 检测,按照试剂盒说明书配置反应体系、设置反应程序,在荧光定量PCR 仪中完成反应,采用2⁃ΔΔCt法计算GPX4、SLC7A11、TfR1的mRNA 表达水平。
1.5 临床资料收集
收集卵巢癌患者的临床病理参数如下[7]:年龄、CA125 水平、FIGO 分期(Ⅰ~Ⅳ期)、组织学分级(G1⁃3 级)。随访患者的预后,包括的无进展生存期(progressionfree⁃survival,PFS)和总生存期(overall survival,OS),随访截止日期为2023 年7月31 日。
1.6 统计学方法
采用SPSS 23.0 软件进行统计学分析数据。计量资料以()表示,两组间比较采用独立样本t检验;计数资料以n(%)表示,两组间比较采用卡方检验;生存分析采用Kaplan⁃Meier 法。P<0.05 为差异有统计学意义。
2 结果
2.1 上皮性卵巢癌中PARP1 表达与部分临床病理参数的关系
不同年龄、组织学分级的上皮性卵巢癌组织中PARP1 表达水平比较,差异无统计学意义(P>0.05);FIGO 分期Ⅲ~Ⅳ期、CA125≥35 U/mL的上皮性卵巢癌组织中PARP1 的高表达率高于FIGO 分期Ⅰ~Ⅱ期、CA125<35 U/mL 的上皮性卵巢癌组织,差异有统计学意义(P<0.05)。见表1。
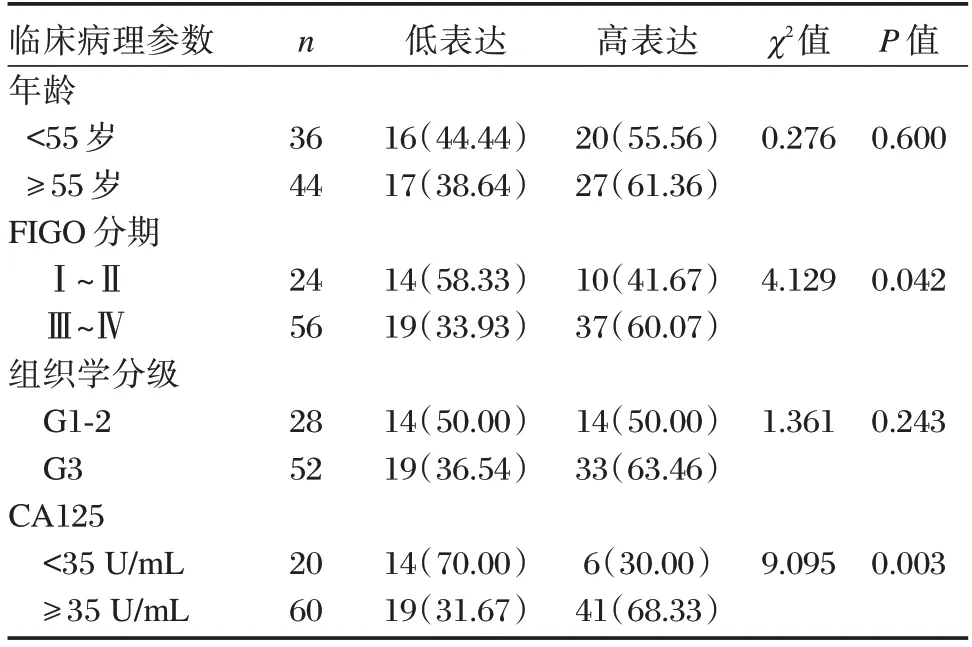
表1 上皮性卵巢癌中PARP1 表达与部分临床病理参数的关系[n(%)]Table 1 Relationship between PARP1 expression and some clinicopathological parameters in epithelial ovarian cancer[n(%)]
2.2 上皮性卵巢癌化疗耐药组织与化疗敏感组织中PARP1 表达的比较
上皮性卵巢癌化疗耐药组织中PARP1的mRNA 相对表达水平及蛋白高表达率均高于上皮性卵巢癌化疗敏感组织,差异有统计学意义(P<0.05)。见表2。
表2 上皮性卵巢癌化疗耐药组织与敏感组织中PARP1表达的比较[(),n(%)]Table 2 Comparison of PARP1 expression in chemotherapy resistant tissues and sensitive tissues of epithelial ovarian cancer[(),n(%)]

表2 上皮性卵巢癌化疗耐药组织与敏感组织中PARP1表达的比较[(),n(%)]Table 2 Comparison of PARP1 expression in chemotherapy resistant tissues and sensitive tissues of epithelial ovarian cancer[(),n(%)]
2.3 上皮性卵巢癌化疗耐药组织与化疗敏感组织中铁死亡标志基因表达的比较
上皮性卵巢癌化疗耐药组织中GPX4、SLC7A11的mRNA 相对表达水平高于上皮性卵巢癌化疗敏感组织,TfR1的mRNA 相对表达水平低于上皮性卵巢癌化疗敏感组织,差异有统计学意义(P<0.05)。见表3。
表3 上皮性卵巢癌化疗耐药组织与敏感组织中铁死亡标志基因表达的比较()Table 3 Comparison of ferroptosis marker gene expression in chemotherapy resistant tissues and sensitive tissues of epithelial ovarian cancer()
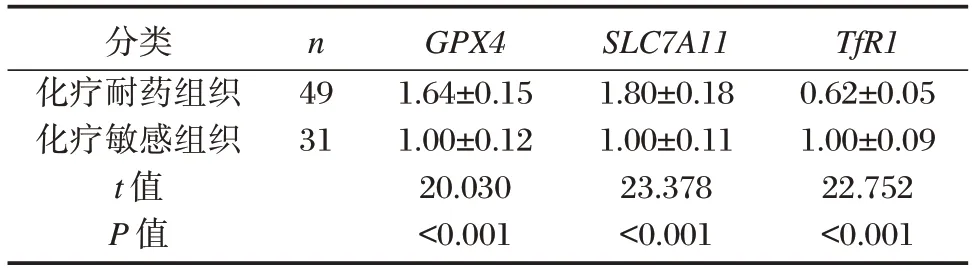
表3 上皮性卵巢癌化疗耐药组织与敏感组织中铁死亡标志基因表达的比较()Table 3 Comparison of ferroptosis marker gene expression in chemotherapy resistant tissues and sensitive tissues of epithelial ovarian cancer()
2.4 上皮性卵巢癌中PARP1 表达与铁死亡标志基因表达的相关性
上皮性卵巢癌中PARP1的mRNA 相对表达水平与GPX4、SLC7A11的mRNA 相对表达水平呈正相关,相关系数为0.351、0.394,与TfR11的mRNA相对表达水平呈负相关,相关系数为-0.364。
PARP1 高表达的上皮性卵巢癌中GPX4、SLC7A11的mRNA 相对表达水平高于PARP1 低表达的上皮性卵巢癌,TfR11的mRNA 相对表达水平高于PARP1 低表达的上皮性卵巢癌,差异有统计学意义(P<0.05)。见表4。
表4 上皮性卵巢癌中PARP1 表达与铁死亡标志基因表达的相关性()Table 4 Correlation between PARP1 expression and ferrop⁃tosis marker gene expression in epithelial ovarian cancer()

表4 上皮性卵巢癌中PARP1 表达与铁死亡标志基因表达的相关性()Table 4 Correlation between PARP1 expression and ferrop⁃tosis marker gene expression in epithelial ovarian cancer()
2.5 上皮性卵巢癌中PARP1 表达与生存预后的关系
与上皮性卵巢癌中PARP1 低表达患者比较,上皮性卵巢癌中PARP1 高表达患者的OS和PFS 缩短,差异有统计学意义(P<0.05)。见图1。
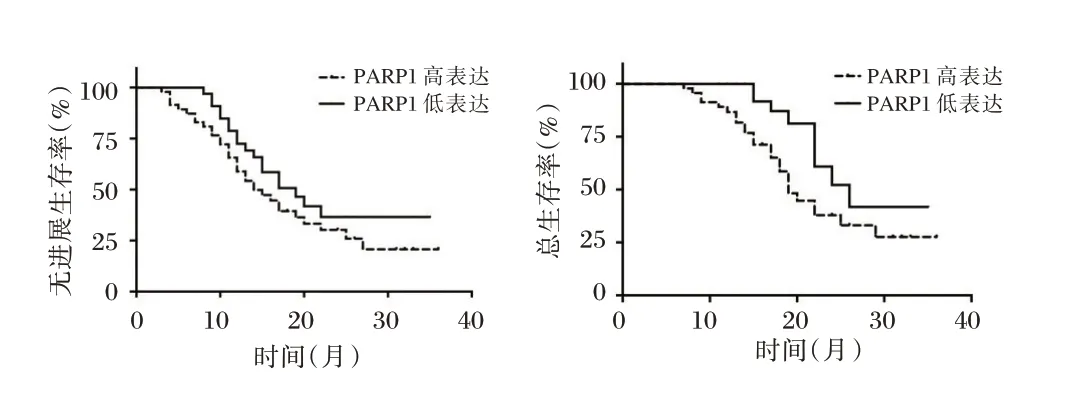
图1 上皮性卵巢癌中PARP1 表达与生存预后的Kaplan⁃MeierFigure 1 Kaplan⁃Meier chart of PARP1 expression in epithelial ovarian cancerand survival outcomes
3 讨论
目前卵巢癌的标准治疗方案是细胞减灭术联合以铂类药物为基础的化疗,约60%~70%的患者因产生化疗耐药而出现治疗后复发[6]。铂类化疗药物杀伤细胞的机制是与DNA 结合、引起DNA结构损伤和破坏,进而通过下游信号通路转导造成细胞死亡,发挥癌细胞杀伤作用。
PARP1 是一类参与DNA 修复的蛋白,能够在细胞核中识别并结合断裂的DNA、促进构象变化,对维持基因组完整性具有重要意义[7]。在恶性肿瘤的发生发展中,PARP1 参与癌细胞增殖、侵袭、血管新生及化疗敏感性的调控,PARP1 抑制剂在不同癌症中的治疗价值受到越来越多关注[8]。卵巢癌相关的临床研究证实:PARP1 在上皮性卵巢癌组织中表达增加且与临床分期增加、死亡率增加相关[9]。本研究中,上皮性卵巢癌组织PARP1高表达与FIGO 分期增加、CA125 水平增加相关,与既往其他学者卵巢癌中PARP1 表达变化的研究结果一致。
目前,PARP1 抑制剂具有抑癌的治疗价值,在卵巢癌中的治疗中PARP1 抑制剂起到协同杀伤和化疗增敏作用,可能机制是抑制PARP1 使其修复DNA 损伤的作用减弱、使化疗药物能够引起DNA 损伤并杀伤细胞[10⁃11]。本研究对上皮性卵巢癌化疗耐药与PARP1 表达的关系进行分析,与化疗敏感的组织比较,化疗耐药组织中PARP1的mRNA 表达及蛋白表达均增加,提示PARP1 高表达与上皮性卵巢癌化疗耐药相关,可能机制是高表达的PARP1 通过修复损伤DNA 影响化疗药物对癌细胞的杀伤作用,进而引起化疗耐药。
PARP1 参与化疗耐药的下游分子机制多样,其中调控铁死亡是相关机制之一。有研究证实,PARP1 抑制剂通过激活铁死亡使化疗药物的细胞杀伤作用增强[12]。铁死亡是一种铁依赖的细胞程序性死亡,TfR1 能够增加细胞内铁含量、对铁死亡具有激活作用,SLC7A11 和GPX4 能够促进自由基清除、对铁死亡具有抑制作用。卵巢癌相关的研究表明,卵巢癌组织中铁死亡受到抑制,激活铁死亡显著抑制卵巢癌细胞的生长[13⁃14]。本研究中,与化疗敏感的卵巢癌组织比较,化疗耐药的卵巢癌组织中SLC7A11和GPX4的表达增加且与PARP1呈正相关,TfR1的表达降低且与PARP1呈负相关,表明铁死亡受抑制与卵巢癌化疗耐药相关且PARP1 可能在化疗耐药过程中调控铁死亡。
最后,本研究对入组的上皮性卵巢癌患者进行生存预后随访并分析其与PARP1 表达的关系,与上皮性卵巢癌中PARP1 低表达的患者比较,PARP1 高表达的患者OS 和PFS 均缩短,提示PARP1 高表达与上皮性卵巢癌生存预后不良有关。
综上所述,上皮性卵巢癌化疗耐药组织中PARP1 表达增加,高表达的PARP1 与上皮性卵巢癌铁死亡减弱、生存预后不良相关。

