磺胺甲恶唑与纳米氧化锌对污泥活性的影响
路云霞,李 超,钱唐健,卜现亭,王超越,*
(1.南京市生态环境保护科学研究院,江苏南京 210013;2.河海大学环境学院,江苏南京 210019)
抗生素作为一种常用抗菌药被广泛应用于生产与生活的各个方面,但作为一种新污染物,其潜在的危害与污染控制问题日益引起学者们的关注。抗生素广泛存在于水环境中,其主要来源包括生活污水、医药废水以及水产或畜牧养殖废水等。抗生素对水环境体系会造成一定程度的污染,同时导致水中微生物耐药基因的改变,我国作为抗生素生产与使用大国,抗生素及其抗性基因成为我国水环境中的优先检出新污染物。
人工纳米材料是环境中一类特殊的新污染物,可通过多种方式进入水环境体系,并对水生动植物与生态系统造成危害。一方面,纳米材料的化学特性、环境行为及毒理效应由于其纳米尺度而不同;另一方面,其他污染物可以将其作为载体,以此实现长距离迁移与生物富集,从而产生更大的环境风险。因此,人工纳米材料与环境中其他污染物复合影响的研究成为目前环境领域的热点。
目前,污水处理厂普遍以生物法为主体对污水进行处理,其中活性污泥法应用最为广泛,利用硝化菌、反硝化菌以及聚磷菌等微生物去除有机污染物。抗生素与纳米材料作为近年来出现的两种新污染物,正引起巨大的环境风险和人类健康问题[1-3],且污水处理厂是抗生素与纳米材料进入自然环境的重要途径之一。研究表明,抗生素[4]与人工纳米材料[5]均对污水处理过程中的重要功能微生物产生危害,从而影响污水处理系统整体效能,进而导致潜在的环境问题。因此,本文研究污水中抗生素与纳米材料共存对活性污泥系统的影响,以期完善两种新污染物在污水处理系统的迁移转化规律,为降低新污染物的环境风险与促进污水处理系统稳定运行提供新的理论依据和技术支持。
当前国内外的研究主要面向单一抗生素或是单一纳米材料[6],而在实际水体中,两种污染物通常同时存在,因此,本研究将探究两者新污染物共存时对污泥系统的影响。
1 材料与方法
1.1 试验装置
本研究采用4组序批式反应器(SBR),按照缺氧/好氧(AO)方式运行。反应器的有效容积为3 L,排水比为66.7%,运行周期为6 h,使用时控开关进行控制,其中进水10 min、搅拌75 min、曝气225 min、沉降30 min、排水10 min、闲置10 min。进水采用人工配制模拟生活污水,选取典型抗生素磺胺甲恶唑(SMZ)与应用广泛的ZnO纳米颗粒(NPs)作为研究对象。
4组SBR反应器进水分别为生活污水、生活污水+SMZ、生活污水+ZnO NPs、生活污水+SMZ+ZnO NPs,反应器依次记作R1、R2、R3、R4。即R1为空白组,进水不投加抗生素或纳米材料,R2、R3、R4为试验组,除进水不同外,其他条件保持相同。
4组反应器的氧气供应采用日常养鱼所用的圆柱形曝气头,利用空气泵和转子流量计分别提供和控制溶氧量,反应器好氧阶段溶解氧(DO)质量浓度维持在2~3 mg/L,缺氧阶段DO质量浓度在0.2~0.5 mg/L。反应器培养温度为室温,pH值控制为6.5~7.5,运行期间定期清洗反应器、进出水管以及进出水箱,减少生物膜生长产生的影响。
1.2 接种污泥与试验水质
试验采用南京某污水处理厂二沉池剩余污泥作为接种污泥,污泥经充分曝气后过1.0 mm筛,使用蒸馏水清洗后接种到反应器中。4组SBR反应器内活性污泥的初始质量浓度均维持在4 000 mg/L左右。
试验采用人工配水方式模拟生活污水,以乙酸钠为碳源,NH4Cl和KH2PO4分别提供微生物生长所需氮源和磷源,同时添加氯化钙、硫酸镁等微生物生长所需元素。
1.3 两种新污染物浓度选择与储备液配制
结合国内外相关研究[7-9],本研究中SMZ质量浓度选择为50 μg/L,ZnO NPs质量浓度选择为5 mg/L。试验所用SMZ生产于Sigma-Aldrich有限公司,为白色粉末,在水中几乎不溶。准确称量10 mg SMZ粉末溶于甲醇,再用超纯水定容至1 000 mL即得10 mg/L的SMZ储备液,转移至棕色瓶备用。试验所用ZnO NPs生产于Sigma-Aldrich有限公司,为亮白色粉末。准确称量100 mg ZnO NPs粉末置于1 000 mL超纯水,超声分散1 h(25 ℃,250 W,40 kHz)后即得100 mg/L的ZnO NPs悬浮液[10],粒径为(50±10)nm,储存备用;每次使用前超声分散,并根据所需浓度进行稀释使用。
1.4 常规指标检测方法
试验中的常规检测指标与方法如表1所示,分析方法选取参照《水和废水监测分析方法》第四版。
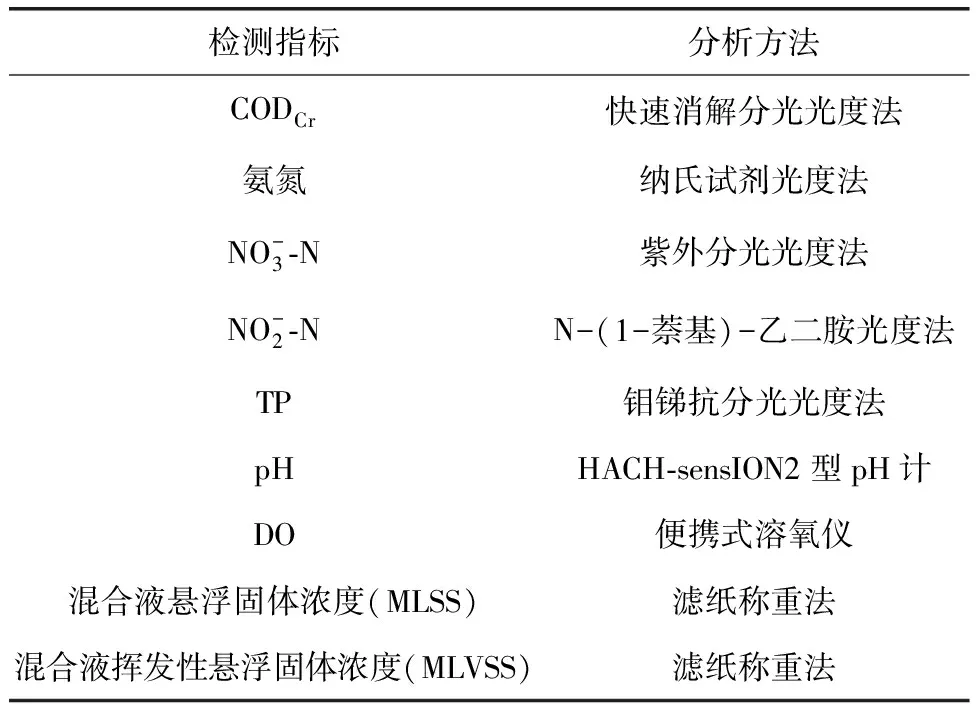
表1 水质指标分析方法
1.4.1 溶解性微生物产物(SMP)的提取与测定
反应器沉降时间段,取上清液过0.45 μm醋酸纤维素膜,即得SMP溶液。SMP中所含多糖采用蒽酮比色法测定,以葡萄糖作为标准;蛋白质和腐植酸采用改进Lowry法测定,分别以牛蛋白血清与腐植酸作为标准。SMP含量为多糖、蛋白质和腐植酸三者含量总和。
1.4.2 乳酸脱氢酶(LDH)的测定
LDH的测定釆用LDH细胞毒性检测试剂盒(南京建成),测定方法参照说明书,具体操作步骤如表2所示。
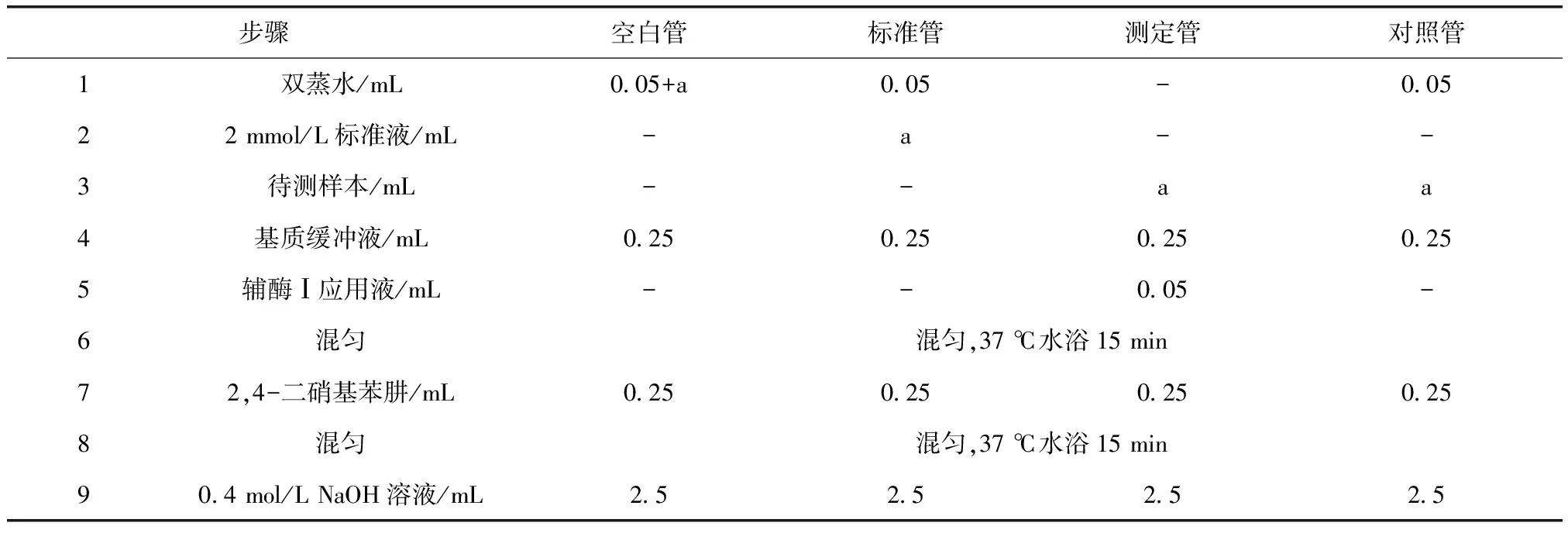
表2 LDH检测步骤
1.4.3 三磷酸腺苷(ATP)的测定
采用ATP含量试剂盒测定(南京建成)活性污泥中的ATP含量。取1 mL活性污泥混合液离心5 min(12 000 r/min),去上清液后加入200 μL裂解液裂解细胞;裂解后离心5 min(12 000 r/min),取100 μL上清液于含有100 μL ATP检测工作液的96孔细胞培养板中,使用多功能酶标仪测定。
1.4.4 活性氧(ROS)的测定
ROS的测定利用ROS检测试剂盒(南京建成),取一定量的活性污泥离心5 min(12 000 r/min),以磷酸缓冲溶液冲洗3次,并将活性污泥重新悬浮于稀释好的2,7-二氯荧光素二乙酸酯(DCFH-DA)(10 μmol/L)中;37 ℃细胞培养箱内解育30 min后,用磷酸缓冲液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA;利用多功能酶标仪,在激发波长(Ex)为500 nm、发射波长(Em)为525 nm下检测所生成2,7-二氯荧光素(DCF)的荧光强度,以反映ROS的水平。
1.4.5 污泥比耗氧速率(SOUR)的测定
污泥的SOUR采用溶解氧仪测定。从反应器中取100 mL污泥混合液放入250 mL锥形瓶内,并向锥形瓶内插入溶解氧仪探头,曝气充氧至饱和后迅速封好锥形瓶口,使用磁力搅拌器搅拌,每隔10 s记录一个DO值,直至锥形瓶内DO质量浓度降至1 mg/L以下时停止。根据DO值随时间的变化率与污泥浓度计算得到污泥的SOUR。
2 结果与讨论
2.1 SMZ与ZnO NPs对活性污泥性能影响
采用MLSS与MLVSS这两个指标表征活性污泥中生物量的相对值,两者比值(MLVSS/MLSS)表征污泥活性部分相对含量,污泥容积指数(SVI)来衡量活性污泥凝聚、沉降性能。反应器初始污泥浓度约为4 000 mg/L,装置运行60 d后取各反应器污泥样分别测定其污泥浓度,结果如图1所示。
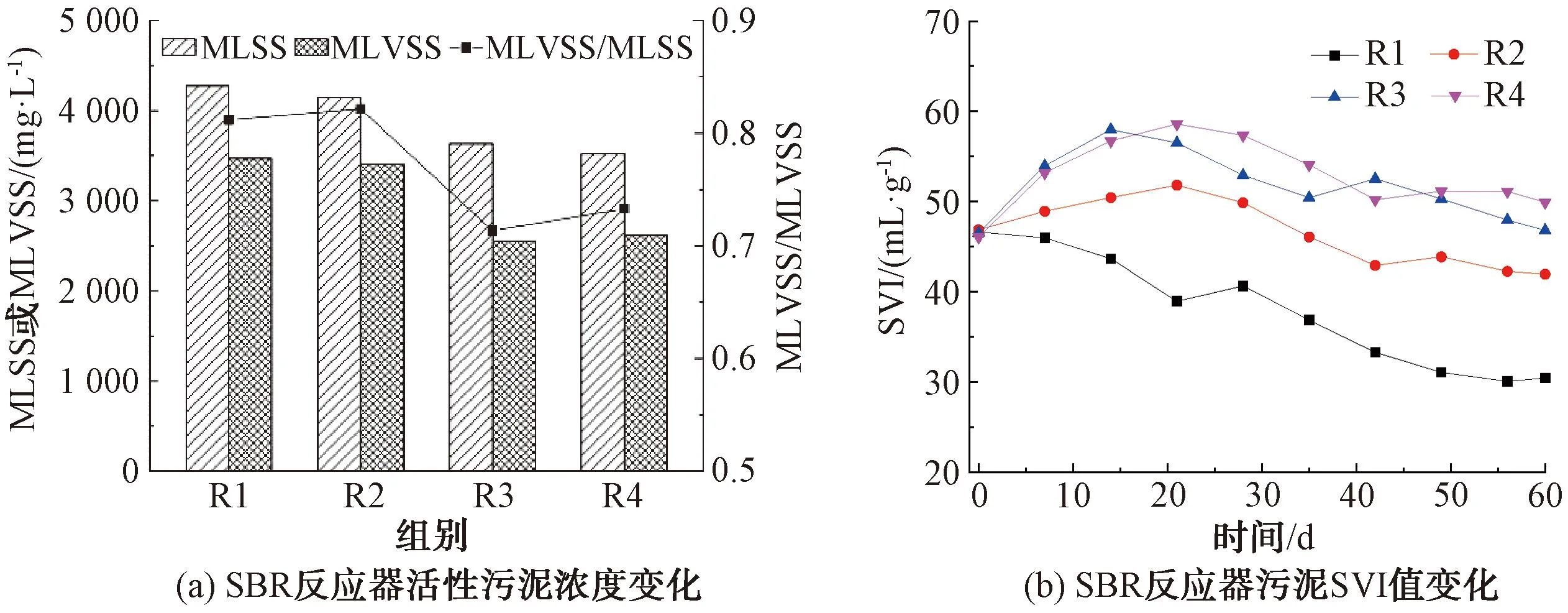
图1 SMZ与ZnO NPs对活性污泥性能影响
由图1(a)可知,连续运行60 d后,空白组R1中MLSS、MLVSS质量浓度分别为4 273、3 468 mg/L,MLVSS/MLSS值约为0.812。R2与空白组R1相比,MLSS、MLVSS及MLVSS/MLSS变化较小;而R3与R4反应器的MLSS、MLVSS及MLVSS/MLSS与前两者相比均明显降低。其中,R3反应器MLSS质量浓度与VSS/SS分别降至3 633 mg/L和0.713,R4反应器MLSS质量浓度与MLVSS/MLSS则分别降至3 518 mg/L和0.733,R4相比于R1,MLSS与MLVSS/MLSS分别降低了17.67%和9.73%。
SMZ或ZnO NPs的长期胁迫均会对活性污泥生长代谢产生抑制作用,且ZnO NPs比SMZ的抑制作用更强,这可能与Zn2+溶出、氧化胁迫等方式影响微生物生长代谢有关,从而导致生物增长速率减慢、污泥生物量减少[8-9]。
图1(b)为4组反应器运行期间污泥SVI值变化情况,污泥出现颗粒化趋势,初始沉降性能较好,SVI值约为46 mL/g。运行期间R1反应器中SVI值呈现逐渐降低的趋势,而R2、R3、R4均呈现先升高后降低的变化趋势。SMZ或ZnO NPs的投加均对活性污泥产生一定毒性,污泥初期未适应环境变化,造成其沉降性降低、SVI值升高,但未出现丝状菌膨胀;随着时间推移,污泥中微生物逐渐适应所处环境,自身做出相应调整,沉降性能则有所恢复。反应器运行至第60 d时,R1~R4反应器的SVI值分别为30.42、42.24、46.79、49.31 mL/g,可以看出SMZ或ZnO NPs的长期胁迫均造成污泥沉降性能降低,且以两者共存时的降低程度最大[10-12]。
2.2 SMZ与ZnO NPs对污泥代谢产物的影响
SMP是影响系统处理水质的重要因素[13],可根据其变化分析活性污泥系统的整体运行状况。试验中每7 d对反应器出水SMP各组分含量进行检测,结果如图2所示。
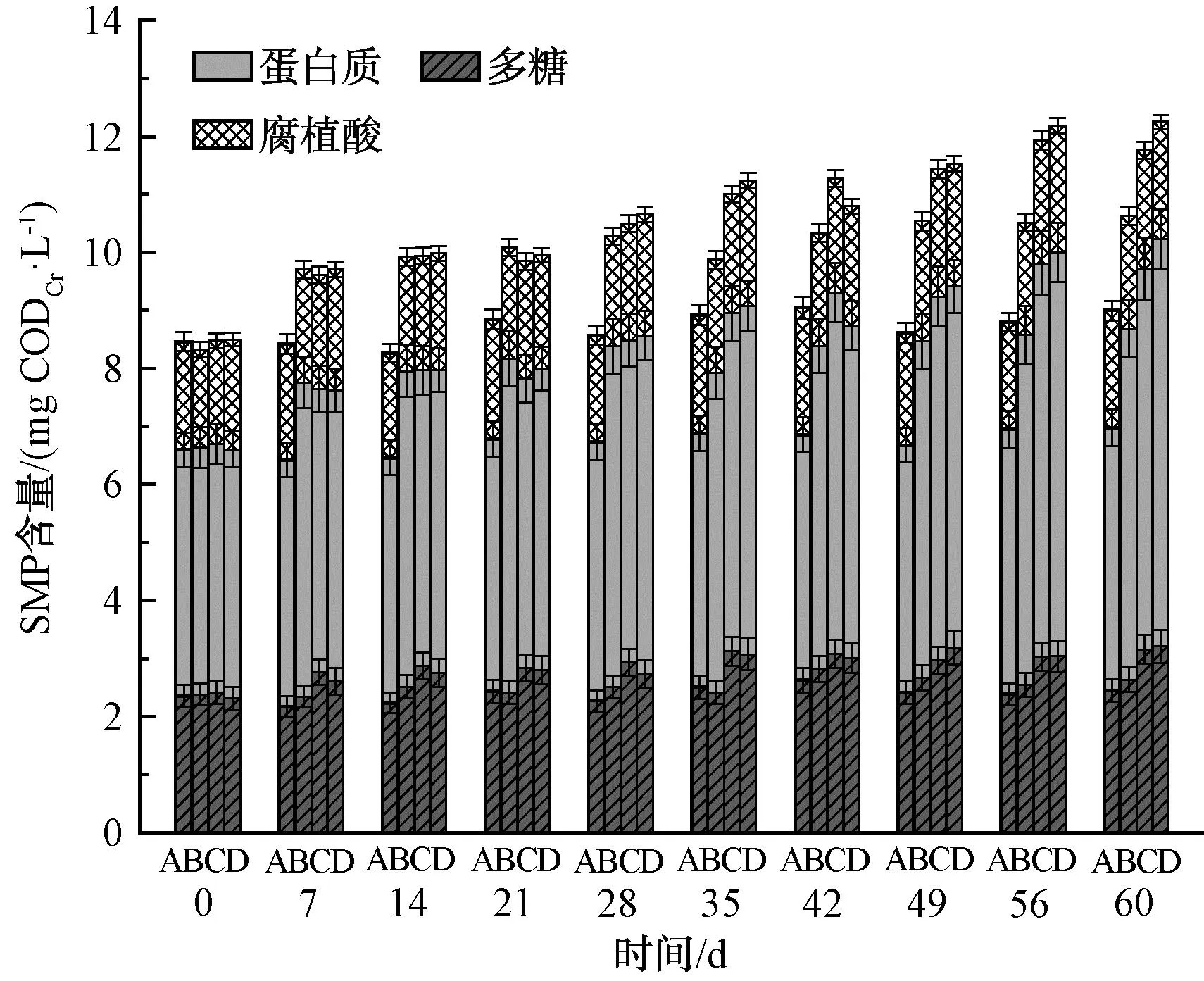
注:A—R1;B—R2;C—R3;D—R4。
由图2可知,试验初始时各反应器出水SMP含量基本相同,SMP质量浓度约为8.5 mg CODCr/L,其中多糖、蛋白质、腐植酸分别为2.3、4.3、1.9 mg CODCr/L。相比于空白组R1,R2~R4反应器出水SMP含量呈现逐渐升高的趋势。运行至60 d时,空白组R1出水SMP质量浓度为9.0 mg CODCr/L,R2~R4反应器出水SMP质量浓度依次为10.6、11.8、12.3 mg CODCr/L,相比于R1分别增加了17.8%、31.1%、36.7%。
SMP又称溶解态胞外聚合物(EPS)[14],实际上SMP与EPS之间可以相互转化,EPS可以通过水解产生与微生物内源呼吸相关的产物BAP[15]。SMZ或ZnO NPs的投加会促使微生物分泌更多EPS以抵御毒性,而EPS的部分水解会造成SMP含量升高。此外,通过污泥处理性能与形态结构的变化,可以看出R2~R4反应器中污泥代谢活性降低,微生物生长代谢相应受到抑制,微生物活性的降低可能影响了其对SMP的生物降解,一定程度上造成了出水SMP含量的明显升高。
运行至60 d时,R2~R4反应器出水SMP的多糖含量较对照组R1反应器分别增长10.6%、30.7%和39.0%,蛋白质含量分别增长42.1%、52.9%和63.3%,腐植酸含量增加相对较小,表明SMP总量的增加以蛋白质含量增加为主,从而造成了蛋白质组分占比的提高。此外,R4反应器出水SMP各组分含量增加均为最高,表明SMZ与ZnO NPs共存对污泥代谢产生的影响最大,使微生物生长代谢受到明显抑制。
聚羟基脂肪酸酯(PHA)与糖原作为活性污泥中微生物细胞的碳源和能源贮存物质,与系统的生物除磷效果有着密切关系。在生物除磷过程中,厌氧阶段糖原通过ED(Entner-Doudoroff)或EMP(Embden-Meyerhof)途径分解并为PHA合成提供还原型辅酶Ⅰ(NADH),而好氧阶段PHA分解产生NADH,与O2反应产生ATP为糖原合成提供能量。反应器运行至60 d,在一个完整周期不同时间点取样,测定污泥中PHA与糖原含量,结果如图3所示。
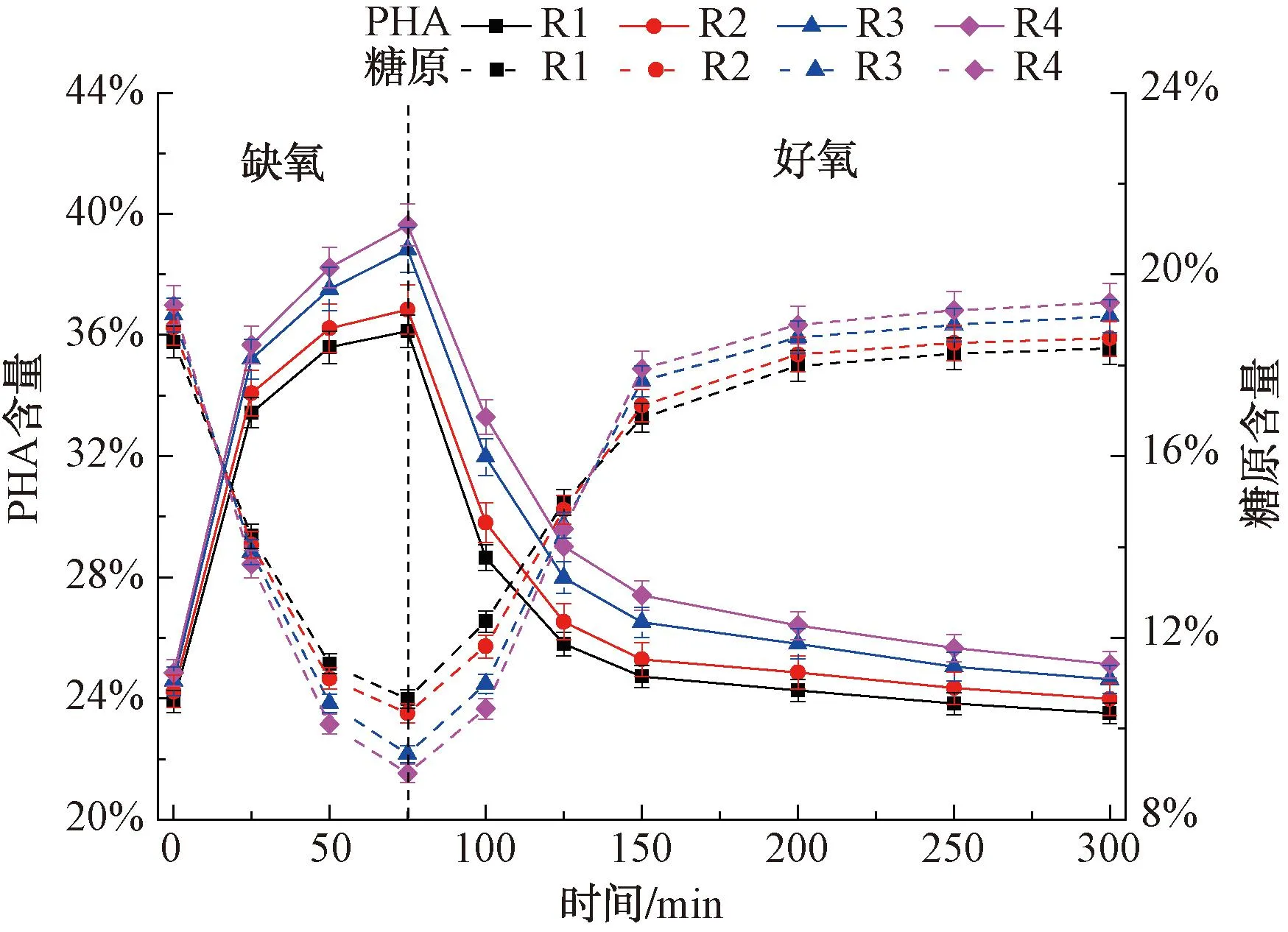
图3 典型周期内活性污泥PHA与糖原含量变化
由图3可知,PHA含量呈现缺氧升高、好氧降低的变化趋势,而糖原含量则呈现缺氧降低、好氧升高的变化趋势。在空白组R1中,缺氧阶段PHA含量由23.9%上升至36.1%,糖原含量由18.5%逐渐降至10.7%,且在前25 min变化最快;好氧阶段PHA与糖原含量逐渐恢复至起始水平,其中PHA在前25 min(总反应75~100 min)降低最快、糖原在总反应100~150 min升高最快,最后分别稳定在23.5%与18.4%。
投加SMZ的R2反应器中PHA与糖原含量变化与R1较为接近,与R2反应器中可溶性正磷酸盐浓度变化规律相符,表明SMZ对活性污泥聚磷菌释磷与吸磷过程影响相对较小。投加ZnO NPs的R3反应器中PHA与糖原含量变化幅度较R1明显增大,缺氧阶段PHA含量由24.6%升至38.8%,糖原含量由19.1%降至9.4%,好氧阶段PHA与糖原含量逐渐恢复至起始水平。好氧阶段R1反应器的PHA与糖原含量变化幅度分别为12.6%与7.7%,相比于空白组R1,R2与R3反应器PHA变化幅度分别增加0.2%、1.6%,糖原变化幅度分别增加0.6%、1.2%,而R4反应器PHA与糖原含量变化幅度最大,其变化幅度增加量超过R2与R3之和。
2.3 SMZ与ZnO NPs对污泥中微生物活性的影响
SOUR是评价活性污泥代谢活性的重要指标,能够较为准确反映污泥处理性能的变化,图4(a)为运行60 d后各反应器中活性污泥SOUR测定结果。从图中可以看出,R1~R4反应器的SOUR值分别为38.5、30.5、25.8 mg O2/(g MLVSS·h)及18.1 mg O2/(g MLVSS·h),SMZ或ZnO NPs长期胁迫对活性污泥代谢活性均产生明显抑制作用,造成SOUR显著下降。
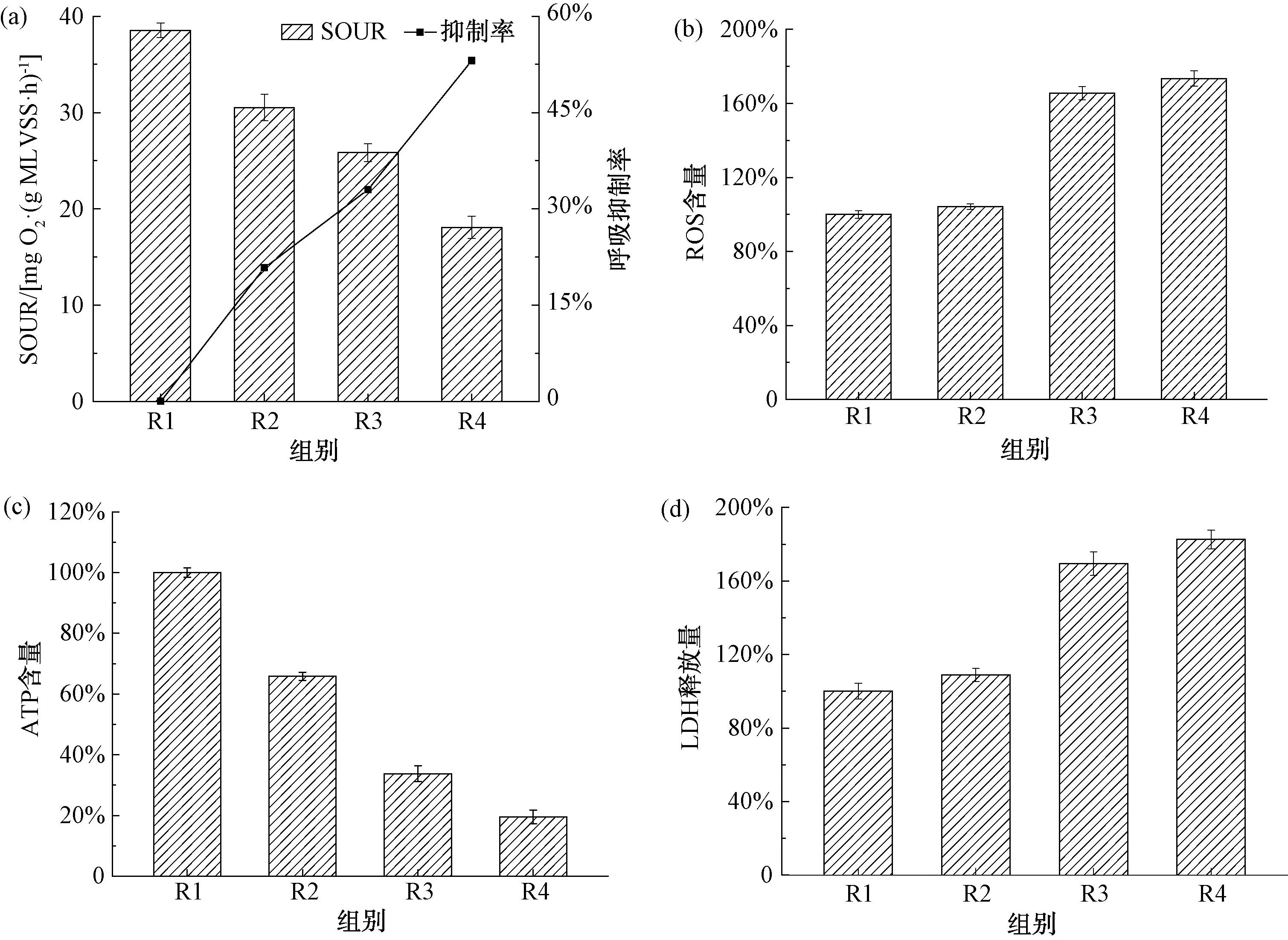
图4 (a)SBR反应器活性污泥SOUR及抑制率变化;(b)SBR反应器活性污泥胞内ROS含量变化;(c)SBR反应器活性污泥ATP含量变化;(d)SBR反应器活性污泥胞外LDH释放量
污泥SOUR与微生物的细胞呼吸相关,呼吸作用能够提供微生物生长代谢所需能量,R2~R4反应器中微生物呼吸抑制率分别达20.8%、33.0%、53.1%。SMZ通过干扰二氢叶酸合成影响微生物遗传物质代谢,从而对微生物生长代谢产生抑制作用,进而影响污泥代谢活性。锌作为微生物必需元素,也是DNA、RNA聚合酶的组成组分,然而ZnO NPs的长期胁迫使Zn元素含量超过其阈值,从而影响微生物的正常代谢。此外,SMZ与ZnO NPs共存使R4反应器的呼吸抑制率接近R2与R3反应器之和,表明两者共存使污泥代谢活性受到的抑制作用进一步增强,最终造成活性污泥处理性能显著降低[16]。
目前,ROS的产生及氧化应激作用被认为是评价纳米材料毒性的最佳指标。因此,运行60 d后对各反应器中污泥胞内ROS含量进行测定,结果如图4(b)所示。
从图4(b)可以看出,R2反应器中投加的SMZ属于有机污染物,其胞内ROS含量与空白组R1基本接近;而R3与R4反应器中污泥胞内ROS含量显著增高,分别达到165.5%与173.4%。ZnO NPs能够穿透细胞膜进入微生物细胞体内,并在细胞内积蓄,诱导细胞内ROS含量升高,进而导致溶酶体和线粒体的损伤、酶活性的降低[17],最终造成细胞分解凋亡。
ATP能够作为衡量活性污泥中微生物活性的重要指标,表征生物降解过程中微生物新陈代谢速度的快慢。装置运行60 d后,对各反应器内活性污泥中ATP含量进行测定,结果如图4(c)所示。
从图4(c)可以看出,以R1反应器活性污泥中ATP含量为100%,R2~R4反应器中ATP含量分别降至65.88%、33.74%和19.52%。与R3、R4反应器相比,R2反应器ATP含量降幅相对较小。SMZ能够与污泥EPS结合形成EPS-SMZ稳定化合物以减小其毒性,而SMZ的长期胁迫也使部分微生物菌群产生抗药性,因此微生物活性有所恢复,污泥中ATP含量受影响程度相对较小。ZnO NPs的投加造成Zn2+的溶出并产生氧化胁迫,从而导致细胞结构破坏、微生物活性降低[18]。同时投加SMZ与ZnO NPs的R4反应器活性污泥中ATP含量降幅最大,达到80.48%,两者共存使其生物毒性显著增加,微生物能量代谢受到影响,导致微生物活性受到严重抑制。
LDH释放已被广泛用于评估有毒物质对细胞生长代谢的影响,各反应器运行60 d后活性污泥胞外LDH释放量如图4(d)所示。
从图中可以看出,R2反应器中LDH释放量增加量较小,胞外LDH释放相对空白组R1(100%)增长至108.8%,表明SMZ对微生物细胞膜完整性的破坏程度较小。在SMZ长期胁迫下,微生物体内储存的叶酸被消耗殆尽后,SMZ与对氨基苯甲酸竞争阻碍四氢叶酸的合成,进而抑制微生物的生长繁殖。
R3与R4反应器胞外LDH释放量显著增加,分别增至169.5%与182.7%,表明ZnO NPs相比SMZ对微生物细胞完整性影响更大,这与污染物之间性质差异有关。ZnO NPs作为一种纳米金属氧化物,在细胞内产生过量ROS引起氧化应激作用,从而导致细胞膜、蛋白质等结构的破坏。此外,ZnO NPs溶出的Zn2+对微生物产生的毒性也会造成细胞凋亡。SMZ与ZnO NPs共存增加了Zn2+的溶出,对微生物活性产生更大抑制,造成更多细胞凋亡、LDH释放。
3 结论
(1)R1反应器具有良好的脱氮除磷能力;投加的SMZ或ZnO NPs吸附在微生物表面,阻碍外部营养物质进入细胞,影响微生物生长代谢,进而导致污泥活性与处理性能降低。
(2)R2~R4反应器SMP含量随运行时间逐渐增加,且以蛋白质组分增加为主,其中R4反应器增幅最大;PHA含量呈现缺氧升高、好氧降低的变化趋势,糖原含量变化则相反;R2反应器中PHA与糖原周期内变化幅度与R1反应器较为接近,而R3与R4反应器中变化幅度则明显增大,ZnO NPs的投加影响聚磷菌与聚糖菌的竞争关系,而SMZ与ZnO NPs共存使聚磷菌受影响程度增加、生物除磷能力降低。
(3)R1反应器运行至60 d时SOUR值分别为38.5 mg O2/(g MLVSS·h),R2~R4反应器SOUR明显降低,R2反应器污泥胞内ROS含量与空白组R1基本相同,而R3与R4反应器中ROS含量分别达到165.5%与173.4%。R2~R4反应器中ATP含量相比空白组R1(100%)分别降至65.88%、33.74%和19.52%,LDH释放量则分别达到108.8%、169.5%、182.7%。

