EGCG调节TLR4/MyD88/NF-κB信号通路对特应性皮炎大鼠Th1/Th2平衡的影响
林建红 陈海军 朱思颐
(邵阳学院附属第一医院1.皮肤科;2.儿科;3.检验科,湖南 邵阳 422001)
特应性皮炎(Atopic dermatitis,AD)是一种慢性复发性皮肤病,伴有过敏性炎症[1]。据报道[2],AD中存在以Th2为主的急性期和以Th1为主的慢性期的双相T细胞应答。Th1和Th2细胞是两个功能不同的细胞亚群,它们分泌不同的效应细胞因子。然而,这些因素在AD发病机制中的相对作用仍有待阐明。
虽然类固醇是常用的治疗AD的主要药物,但由于潜在的副作用,如皮肤萎缩、快速反应和停止治疗后的症状性反弹,不鼓励长期使用[3-4]。在临床研究[5]中,中医药已被证明是预防和治疗炎症性皮肤病的潜在治疗剂来源。一项针对皮肤病的系统研究[6]结果表明,中草药可以缓解AD,并且不会引起严重的不良反应。表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)是茶叶中含量最多的儿茶素。EGCG具有抗炎、抗氧化等诸多活性,并已被应用于治疗炎症性疾病、皮肤病和感染性疾病[7-8]。Chiu等[9]已证实EGCG是治疗AD的潜在治疗剂。然而关于EGCG对AD的作用机制的报道相对较少。本研究评估了EGCG对2,4二硝基氯苯(Dinitrochlorobenzene,DNCB)诱导的AD动物模型的影响,EGCG的抗炎和抗过敏特性是在DNCB诱导的AD模型中确定的,该模型旨在弥补AD治疗中使用类固醇的缺点。
1 材料与方法
1.1 实验动物 90只6~7周龄的SPF级SD大鼠(体重160~200 g)获自北京百奥赛图基因生物技术有限公司,生产证书编号SCXK(京)2020-0007。将动物养在本研究动物房[温度为(23±2) ℃,湿度为50%±10%,12 h明暗循环],提供标准食物和水。本研究获得医院伦理委员会批准。
1.2 主要试剂与仪器 EGCG(E4143,纯度≥95%)、DNCB(237329,纯度≥99%)、地塞米松(Dexamethasone,DXM)(D1756,HPLC≥98%)、Toll样受体4(Toll-like receptor 4,TLR4)激动剂LPS(来自大肠杆菌O55:B5,L2880)、PMA(P1585,HPLC≥99%)、ionomycin (I0634,HPLC≥98%)、Brefeldin A(来自布雷正青霉菌,B5936)均获自美国Sigma;HE染色试剂盒(G1120)、大鼠白介素-2(IL-2)ELISA KIT(SEKR-0003)、白介素-4(IL-4)ELISA KIT(SEKR-0004)、白介素-13(IL-13)ELISA KIT(SEKR-0046)和干扰素-γ(Interferon-γ,IFN-γ)ELISA KIT(SEKR-0008)、ECL发光液(PE0020)获自北京Solarbio;Fixation/permeabilization(555028)获自美国Biosciences;鼠单克隆FITC-anti-CD4(ab59474)、兔单克隆APC-anti-IFN-γ(ab275700)和鼠单克隆PE-Anti-IL-4(ab95717)、兔多克隆TLR4(ab13556)、兔多克隆髓样分化因子88(myeloid differentiation factor 88,MyD88,ab2064)、兔多克隆核因子κB(Nuclear factor kappa-B,NF-κB,ab16502)、兔多克隆GAPDH(ab9485)均获自英国Abcam。DMi8-荧光显微镜(德国徕卡)、SpectraMax Mini酶标仪(上海美谷分子)、ImagerQuant 300凝胶成像系统(美国GE)。
1.3 方法
1.3.1 AD模型构建及分组处理 将DNCB溶解在丙酮/橄榄油(3∶1)中,以应用于大鼠。按照研究进行AD大鼠模型构建[10]。造模前先去除部分(约8 cm2)大鼠背部毛发。使用100 μL的7% DNCB涂抹大鼠背侧剃毛的皮肤上使动物致敏3 d。一周后将200 μL的0.7% DNCB涂在同一位置进行攻击,每周一次,持续6周。大鼠背部出现糜烂、红斑和水肿等现象即为造模成功。同时选择18只作为对照(Control)组,按照AD模型方法涂抹等量的橄榄油/丙酮溶剂。将AD造模成功的大鼠分为AD模型(AD)组(给予等量的生理盐水)、AD+EGCG治疗(EGCG)组(50 mg/kg)[11]、AD+DXM阳性对照(DXM)组(2.5 mg/kg)[12]、AD+EGCG+TLR4激动剂(TLR4)组(0.5 mg/kg)[13],每组18只,而Control组以相同的方式给予等量的生理盐水。各组大鼠通过灌胃给予处理,每天一次,连续2周。实验结束时,根据大鼠背部皮肤的损伤严重程度计算临床评分,评分后进行取血,最后处死大鼠并将18只分别进行组织学分析、流式细胞术检测、Western blot检测(各6只)。
1.3.2 大鼠背部皮肤损伤的严重程度评分[12]处死前给大鼠拍照,根据大鼠背部皮肤的损伤严重程度计算临床评分。临床评分基于红斑、水肿、结痂、脱屑和苔藓化症状的严重程度(0,无症状;1,轻度;2,中度;3,重度)。根据照片评估每个大鼠的皮肤损伤严重程度。
1.3.3 ELISA检测各组大鼠血清中炎症因子表达情况 在对每只大鼠损伤评分后将大鼠麻醉,从眼静脉丛中抽取血液,并以2000 rpm的速度离心血液10 min,以收集用于ELISA测定的血清。分别通过对应的试剂盒检测血清中IL-2、IL-4、IL-13和IFN-水平。
1.3.4 组织学分析 采血后处死大鼠,然后收集大鼠皮肤(n=6),并将其储存在-80 ℃用于进一步分析。将收集的大鼠背部组织(n=6)固定在福尔马林中,通过梯度乙醇脱水后制备成6 μm的切片。干燥后将切片脱蜡、复水后分别经苏木精和伊红染色10 min,封片后通过光学显微镜(日本尼康)在200倍的放大率来观察病理学特征。并对病理学的损伤程度进行评分。通过炎性细胞浸润程度进行评分[12]:无浸润(0分);0%~25%浸润(1分);25%~50%浸润(2分);50%~75%浸润(3分);75%~100%浸润(4分)。
1.3.5 流式细胞术检测[2]从大鼠背部组织(n=6)分离单个核细胞,计数后将细胞在5% CO2培养箱中于37 ℃中培养24 h。使用PMA(100 mg/L)、ionomycin(1 mg/L)和Brefeldin A(10 mg/L)处理细胞4 h,随后将细胞置于EP管中,与FITC-anti-CD4室温避光30 min,用细胞染色缓冲液洗涤后与500 μL fixation/permeabilization溶液混合,避光45 min。用1× BD perm/wash buffer洗涤后,将细胞与PE-anti-IL-4和APC-anti-IFN-γ在室温中避光45 min,再次使用1× BD perm/wash buffer洗涤,通过300 μL flow buffer重悬。最后使用流式细胞仪和FlowJo软件进行分析。根据FITC-CD4荧光测定Th1(IFN-γ+CD4+)和Th2(IL-4+CD4+)细胞百分比。
1.3.6 Western blot检测 从大鼠背部组织中提取总蛋白。经电泳转移到PVDF膜上,封闭液将膜封闭2 h后与一抗TLR4、MyD88、NF-κB、GAPDH在4℃下孵育过夜。然而与二抗孵育2 h。将膜洗涤后,通过ECL对膜进行可视化。使用凝胶成像系统和Quantity One软件获得蛋白相对表达。
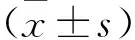
2 结果
2.1 EGCG减轻AD大鼠的特应性病变的严重程度 为了在动物模型中研究EGCG对AD的影响,用DNCB过敏源使SD大鼠的背部皮肤敏感,成功诱导AD的临床特征,如干燥、糜烂、红斑和水肿等。EGCG和DXM治疗明显改善了AD大鼠皮肤损伤中的这些表型。通过对各组皮肤损伤程度进行评分显示,与Control组(0分)比较,AD组(5.67±0.54)大鼠皮肤损伤评分明显升高(P<0.05);与AD组比较,DXM组(2.64±0.20)和EGCG组(2.80±0.18)大鼠皮肤损伤评分明显降低(P<0.05);与EGCG组比较,DXM组大鼠皮肤损伤评分变化差异无统计学意义(P>0.05),TLR4组(4.02±0.45)大鼠皮肤损伤评分升高(P<0.05)。见图1。
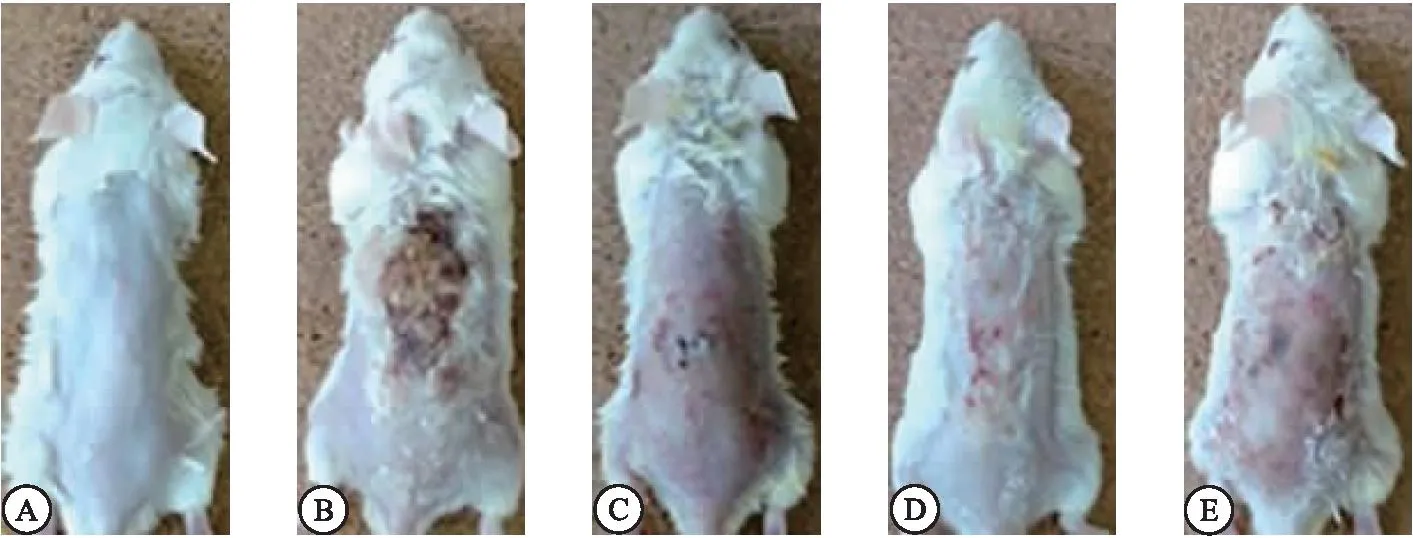
图1 各组大鼠背部皮肤损伤代表性图片Figure 1 Representative images of back skin damage in each group of rats注:A.Control组; B.AD组; C.EGCG组; D.DXM组; E.TLR4组。
2.2 EGCG抑制AD大鼠的炎症反应 与Control组比较,AD组大鼠血清中IL-2和IFN-γ水平下调,IL-4和IL-13水平上调(均P<0.05);与AD组比较,EGCG组和DXM组大鼠血清中IL-2和IFN-γ水平上调,IL-4和IL-13水平下调(均P<0.05);与EGCG组比较,DXM组大鼠血清中IL-2、IL-4和IL-13、IFN-γ水平变化差异无统计学意义(P>0.05),TLR4组大鼠血清中IL-2和IFN-γ水平下调,IL-4和IL-13水平上调(均P<0.05)。见表1。

表1 各组大鼠血清中IL-2、IL-4、IL-13和IFN-γ水平检测Table 1 Detection of serum levels of IL-2, IL-4, IL-13 and IFN-γ in each group of rats
2.3 EGCG减少AD大鼠皮损组织病理学特征 HE染色结果显示,AD组大鼠较Control组大鼠表皮、真皮明显增厚,同时炎症细胞向皮肤组织的浸润增多,EGCG和DXM治疗显著较少了AD大鼠的这些病理学特征(见图2)。与Control组(0分)比较,AD组(2.65±0.19)大鼠皮肤损伤的病理学评分明显升高(P<0.05);与AD组比较,DXM组(1.18±0.13)和EGCG组(1.27±0.12)大鼠皮肤损伤的病理学评分明显降低(P<0.05);与EGCG组比较,DXM组大鼠皮肤损伤的病理学评分变化差异无统计学意义(P>0.05),TLR4组(1.98±0.14)大鼠皮肤损伤的病理学评分升高(P<0.05)。

图2 HE染色评估各组大鼠背部皮肤的病理学变化(200×)Figure 2 HE staining evaluation of pathological changes in the back skin of rats in each group 注:箭头所示为炎性浸润部分。A. Control组; B. AD组; C. EGCG组; D. DXM组; E. TLR4组。
2.4 EGCG改善AD大鼠的Th1/Th2平衡 为了确定EGCG可以改善Th1/Th2平衡,流式细胞术用于分析大鼠皮损组织中的Th1细胞和Th2细胞(见图3)。与Control组比较,AD组大鼠皮损组织中Th1细胞百分比降低,Th2阳性细胞百分比升高(均P<0.05)。与AD组比较,EGCG组和DXM组大鼠皮损组织中Th1细胞百分比升高,Th2阳性细胞百分比降低(均P<0.05)。与EGCG组比较,DXM组大鼠皮损组织中Th1、Th2细胞百分比变化差异均无统计学意义(P>0.05),TLR4组大鼠皮损组织中Th1细胞百分比降低,Th2阳性细胞百分比升高(均P<0.05)。见表2。
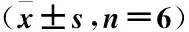
表2 各组大鼠皮损组织中Th1和Th2阳性细胞百分比Table 2 Percentage of Th1 and Th2 positive cells in skin lesions of rats in each group
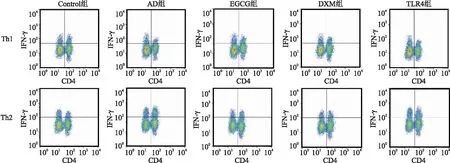
图3 流式细胞仪检测各组大鼠皮损组织中Th1和Th2细胞表达Figure 3 Flow cytometry detection of Th1 and Th2 cell expression in skin lesions of rats in each group
2.5 EGCG降低AD大鼠皮损组织中的TLR4/MyD88/NF-κB通路相关蛋白 与Control组比较,AD组大鼠皮损组织中TLR4、MyD88、p-NF-κB蛋白水平上调(P<0.05)。与AD组比较,EGCG组和DXM组大鼠皮损组织中TLR4、MyD88、p-NF-κB蛋白水平下调(P<0.05)。与EGCG组比较,DXM组大鼠皮损组织中TLR4、MyD88、p-NF-κB蛋白水平变化无统计学意义(P>0.05);TLR4组大鼠皮损组织中TLR4、MyD88、p-NF-κB蛋白水平上调(P<0.05)。见图4、表3。
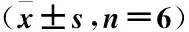
表3 各组大鼠皮损组织TLR4、MyD88、NF-κB蛋白表达Table 3 Expression of TLR4, MyD88 and NF-κB protein in skin lesions of rats in each group

图4 Western blot检测各组大鼠皮损组织中TLR4、MyD88、NF-κB蛋白表达Figure 4 Western blot analysis of TLR4, MyD88, NF-κB protein expression in rat skin lesions
3 讨论
AD是最常见的复发性炎症性皮肤病之一,其特点是Th1/Th2失衡[2]。随着社会工业化进展,AD的发病率在不断上升,但其发病机制仍不清楚[14]。其中,皮肤屏障的缺陷和免疫功能的障碍可能是AD发生的两个主要因素[15]。本研究通过在大鼠背部使用DNCB,在一个半月内诱发了AD样皮肤损伤,结果显示,AD模型大鼠皮损组织中表皮、真皮明显增厚,炎症细胞向皮肤组织的浸润增多,表明皮肤损伤增加。此外,Th1/Th2失衡与肿瘤免疫逃逸、微生物感染(细菌和病毒等)有关,也与过敏性疾病、自身免疫性疾病和移植排斥反应有关,并在介导AD发展中发挥重要作用[16]。本研究结果还发现皮损组织中Th1细胞百分比降低,Th2阳性细胞百分比升高。以上数据提示AD模型构建成功且Th1/Th2平衡被破坏,表现为Th2细胞占优势。
EGCG是绿茶中的一种活性儿茶素,具有抗炎、抗癌、免疫调节等多种生物学功能,能够对发炎的皮肤提供抗氧化、抗炎和免疫调节作用,以改善AD症状[9]。Yang等[17]研究发现,EGCG治疗通过减轻组织损伤、炎症、粘液产生、胶原沉积以及M2巨噬细胞的浸润,从而对室内尘螨诱导的过敏性哮喘具有保护作用。Bing等[18]研究表明,EGCG在葡聚糖硫酸钠诱导的大鼠溃疡性结肠炎中通过抑制Th1细胞因子表达和诱导Th2细胞因子表达,从而具有抗炎和调节免疫功能的作用。与本研究结果不一致,推测其可能的原因是葡聚糖硫酸钠诱导溃疡性结肠炎和DNCB诱导的AD的发展过程并非由相同的细胞因子发挥功能所致。因此,EGCG对Th1和Th2细胞因子的调节作用在不同疾病中并不相同。据报道,AD是急性特应性湿疹中以Th2为主的炎症性疾病,随后在慢性阶段表现为Th1积累[2]。其中,在IFN-γ和IL-2诱导下,CD4+T细胞分化为Th1细胞并介导细胞免疫;在IL-4诱导下,CD4+T细胞分化为Th2细胞,分泌IL-4等细胞因子以激活B细胞,并介导体液免疫和超敏反应[19]。Aierken等[10]证明,背侧AD样皮损急性期Th2细胞因子IL-4和IL-13水平显著高于正常皮肤组织。本研究也观察到同样趋势,且EGCG可以明显抑制AD大鼠的临床表现和病理学特征;增加Th1细胞百分比和IL-2、IFN-(水平,降低Th2细胞百分比和IL-4、IL-13水平。以上数据证实,EGCG可通过维持Th1/Th2平衡减缓AD大鼠皮肤炎症性损伤,但其具体机制还需探讨。
TLR是先天免疫识别受体的重要组成部分,在微生物鉴定中发挥着重要作用。TLR通过识别微生物(脂多糖、脂蛋白和遗传物质核酸等)激活先天免疫反应进而释放细胞因子、上调共刺激分子的表达,最终为获得性免疫反应提供激活信号[20]。TLR4是TLR的重要成分,可通过靶向MyD88激活NF-κB促炎信号通路,促使效应细胞分泌细胞因子,在炎症反应中发挥重要作用[21]。据报道[22],川芎嗪纳米粒可通过抑制TLR4/MyD88/NF-κB通路,调节下游细胞因子的表达,维持Th1/Th2平衡有效防止术后炎症反应触发的宫腔粘连形成。此外,EGCG通过抑制TLR4/MyD88/NF-κB信号通路维持Th1/Th2平衡并抑制结肠组织中的免疫炎症反应[17]。本研究结果表明,EGCG能显著下调TLR4、MyD88、p-NF-κB蛋白水平,提示EGCG可能通过抑制TLR4/MyD88/NF-κB通路减轻AD大鼠的炎症反应,进而维持Th1/Th2平衡减轻皮肤损伤。此外,Aierken等[10]通过抑制NF-κB/TLR4信号通路,部分改善Th1/Th2免疫反应,进而对AD具有抑制作用,与本研究结果一致。为了进一步验证EGCG与TLR4/MyD88/NF-κB通路之间的关系,引入了TLR4激动剂进行处理,结果表明TLR4激动剂处理后可部分逆转EGCG对AD大鼠的影响,表明EGCG通过维持Th1/Th2平衡对AD大鼠的保护作用,与抑制TLR4/MyD88/NF-κB通路激活有关。
4 结论与展望
EGCG可通过抑制TLR4/MyD88/NF-κB通路维持Th1/Th2平衡,进而抑制AD大鼠皮损组织的免疫反应,减轻皮损的严重程度。这为临床开发AD的靶向治疗提供了理论基础。然而,EGCG虽然有很多好处,但由于生物利用度低、不稳定,目前主要用于细胞和动物研究,临床研究较少。因此,提高EGCG的生物利用度,转向临床研究也将是未来研究的重点。

