肠道类器官在肠疾病机制研究中的运用*
强龙征 毛海光 王梦婷 齐莉莉 王进波
(浙大宁波理工学院,生物与化学工程学院,宁波 315100)
肠道作为消化系统的重要组成部分,承担着食物消化、营养物质吸收和代谢的重要作用。特别是肠上皮,对营养物质的吸收和药物的口服生物利用度起关键作用,是营养物质和药物吸收的重要部位[1]。由于肠道各部分独特的生理构造,导致在体外模拟肠道内环境从而探究肠道疾病的发病机制十分困难。虽然,永生化细胞、动物活体模型等技术已经应用于肠道疾病机制的相关研究[2],但是由于无法有效模拟肠道结构与功能,导致研究结果有局限。类器官的出现,极大地改变了这一局面。肠道类器官是一种来源于肠道干细胞且具备三维(3D)结构的微器官,因其获得相对容易,培养周期较短,而且可以进行传代、冻存,遗传相对稳定,经诱导后可以有效地模拟人肠道上皮的多细胞组成和复杂功能。同时,类器官技术与生物材料学等多领域的互相结合,极大推动了肠道类器官作为研究肠道疾病的重要体外工具的进展。然而将肠道类器官应用于肠道疾病的研究尚在起步阶段,尤其是在许多疾病的发病机制上,仍有大量问题亟待解决。本文从肠道类器官的定义入手,介绍了肠道类器官在不同疾病机制探究及药物研发、筛选方面的最新进展。
1 肠道类器官的来源与分类
肠道类器官可以定义为使用来源于肠道原代组织、胚胎干细胞(embryonic stem cell,ESC)或诱导多能干细胞(induced pluripotent stem cells,iPSC)构建的,具有自我更新和自我组织能力的,并且表现出与原始组织类似的器官功能的微器官[3]。该类器官包含功能性的组织单元,但缺乏间基质细胞、免疫细胞、神经细胞和间充质细胞[4]。目前,成功构建的肠道类器官主要是小肠类器官和结肠类器官(图1)。2007年,Clevers团队[5]发现,亮氨酸重复序列G蛋白偶联受体5阳性(leucine-rich repeat-containing G-protein coupled receptor 5,Lgr5+)在隐窝基底柱状细胞的特殊表达,标志着多种成人组织和肿瘤中的干细胞。而且位于隐窝底部的Lgr5+干细胞可以分裂增殖产生转运扩增(transit amplifying,TA)细胞,并由TA细胞分化生成包括肠细胞、肠内分泌细胞、潘氏细胞、杯状细胞等细胞。2009年,Sato等[6]即通过单个Lgr5+干细胞,首次培养并构建出小鼠隐窝-绒毛样类器官。2011年,Spence团队[7]通过新的方式将多能干细胞(pluripotent stem cells,PSC)诱导培养为肠道类器官。根据不同研究中干细胞来源的不同,可以将类器官分为原代肠组织干细胞来源类器官和诱导多能干细胞来源类器官。其中,原代肠组织干细胞来源的类器官又可分为成体干细胞类器官和胚胎干细胞类器官。
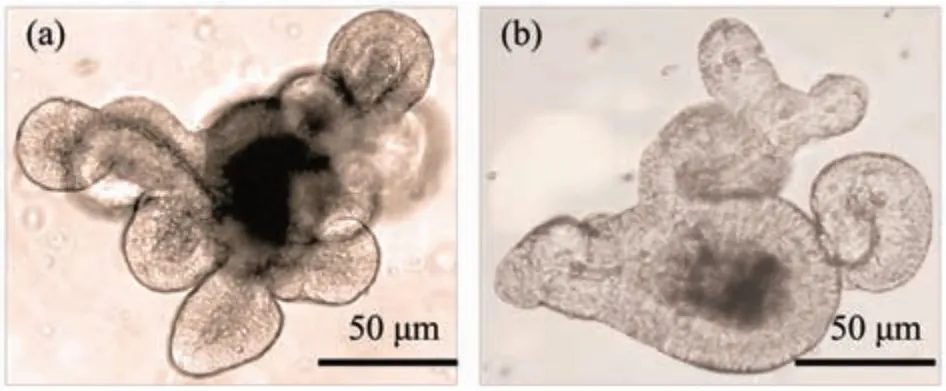
Fig.1 Appearance of intestinal organoids from different intestines sources in mice图1 不同肠源的小鼠肠道类器官样貌图
2 肠道类器官的培养
2.1 传统培养方式
Lgr5+干细胞的鉴定及干细胞生态位的表征证明了可以在体外扩增肠上皮以培育3D肠道类器官。这种类器官的培养模式不仅可以长时间维持,而且不会造成遗传完整性的破坏,或者使组织生理学发生任何本质的变化[8]。Clevers团队[6]首次构建肠道类器官时,将分离的单个Lgr5+干细胞或隐窝放入富含层黏连蛋白并起3D骨架支撑作用的基质凝胶(matrigel)中培养(图2),加入基础培养基,并添加必要的细胞生长因子:表皮生长因子(epidermal growth factor,EGF)、头蛋白(Noggin)和R-Spondin1。其中,R-spondin1是Wnt激动剂和Lgr5的配体,Noggin是BMP通路抑制剂,二者都具有促进隐窝数量增加的作用[9-10];EGF主要促进小肠细胞的增殖。由于结肠类器官缺乏分泌Wnt3A的潘氏(paneth)细胞,必须加入Wnts用以维持干细胞自我更新、分化的能力[11]。相较于鼠源类器官,人源类器官更为复杂。用于培养小鼠来源类器官的培养基无法支撑人源类器官的形成,因此,需要在原来的培养基的基础上增加胃分泌素(Gastrin)和烟酰胺(Nicotinamide)。其中,烟酰胺对延长类器官的存活时间至关重要。另外,还需要加入A-83-01和SB202190,促进提升类器官的形成。上述生长因子可以维持肠道类器官的生长,但是不能促进分化。除去Wnt3A、烟酰胺和SB202190可以促使结肠类器官分化成各类成熟细胞(图3)[11]。由于结直肠癌(colorectal cancer,CRC)肿瘤的Wnt信号通路被异常激活,所以构建CRC类器官的培养基只需在正常结肠类器官培养基的基础上进行修改即可。表1总结了用于构建不同类型的人源、鼠源肠道类器官的培养基成分。

Table 1 Components of intestinal organoids culture medium表1 肠道类器官培养基成分

Fig.2 Growth process diagram of mouse small intestinal organoids图2 小鼠小肠类器官生长过程图

Fig.3 Human intestinal organoid cell type composition[11]图3 人类肠道类器官细胞类型组成[11]
2.2 新兴培养材料及方法
肠道类器官的成功构建并运用于疾病机制探究,依赖于培养基能够有效重现天然肠道的特征,而培养基则需借助外在支架的支撑。由于传统基质凝胶来源于Engelbreth-Holm-Sarm小鼠肉瘤,其构建的类器官在临床应用中存在安全隐患,而且该基质凝胶不能有效地重现天然肠道微环境[16],也无法提供类器官生长及成熟必需的组织特异性信号[17]。为解决基质凝胶在肠道类器官培养中存在的局限性,近年来,许多新兴生物材料(表2)被应用于肠道类器官的体外培养。水凝胶作为一种生物材料,其内部结构和孔隙大小均可人为调控,经过不同方法的修饰可以实现类器官的个性化培养。Gjorevski等[18]和Luo等[19]精密设计的聚乙二醇(polyethylene glycol,PEG)水凝胶和透明质酸(hyaluronic acid,HA)水凝胶,相对于传统基质凝胶,二者在生物化学和生物物理特征上得到了更好的控制。PEG水凝胶有效地再现肿瘤细胞外基质(extracellular matrix,ECM)的机械及化学性质,更加适合患者衍生肿瘤类器官(patientderived organoid,PDO)的培养。HA-明胶水凝胶可以促进肠道干细胞的增殖,更适用于肠道干细胞(intestinal stem cell,ISC)衍生类器官的形成与发展。有研究发现[20],由纤维蛋白和层黏连蛋白为主要成分的水凝胶上天然存在精氨酸-甘氨酸-天冬氨酸(RGD)黏附结构域和层黏连蛋白111。纤维蛋白上RGD的浓度足以促进类器官生长。其中,RGD基序是肠干细胞增殖的必要因子,是促进类器官形成和扩张的关键因素。此外,该水凝胶还可以广泛作为基底膜提取物(basement membrane extract,BME)的等效替代物。另有学者设计出一种脱细胞肠组织衍生的3D水凝胶,额外增加的3种蛋白质增强了肠道ECM微环境,并实现了类器官的长期传代和移植[21]。水凝胶(2 g/L)中层黏连蛋白111、511、肾连蛋白浓度在0.1 g/L、0.01 g/L、0.01 g/L条件下,类器官的培养具有最高形成率。其中,层黏连蛋白有助于隐窝绒毛单元的形成,肾连蛋白通过特异结合α8β1整合素促进肠隐窝稳态[16]。Gjorevski等[18]指出,只有使用含有基质金属蛋白酶敏感可降解序列和额外ECM成分的较软PEG水凝胶构建肠道类器官时,才能使干细胞向类器官方向发展。平滑肌细胞特异性表达的小生境因子——基质金属蛋白酶(matrix metalloproteinase,MMP)17,通过直接修饰ECM成分和切割生长因子来调节其与ECM和细胞结合的能力[22],进而介导类器官的生长。微孔阵列[23]和悬滴技术[24]运用了新的悬浮培养方法,提供了更受控的培养体系,实现了更加均匀地培养肠道类器官。相比于将类器官浸入凝胶层的培养模式,微孔及悬滴技术仅将基质胶作为培养基的补充,避免了凝胶包埋带来的并发症。同时,因基质胶的用量极其有限,也大大降低了类器官的构建成本。

Table 2 Application of new biomaterials and technical means in intestinal organoid culture表2 新生物材料和技术手段在肠道类器官培养中的运用
3 肠道类器官在常见肠道疾病机制研究中的应用
3.1 炎症性肠道疾病
溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),统称为炎症性肠道疾病(inflammatory bowel disease,IBD),属于肠道慢性炎症性疾病[28]。近年来的研究表明,炎性肠道疾病的起始和延续与肠上皮屏障(intestinal epithelial barrier,IEB)功能的损坏、异常免疫应答、内稳态紊乱和肠道微生物群失调都有紧密联系,进一步支持了肠道类器官的研究对IBD发病机制探索的重要性[29-30]。
促炎细胞因子,如IL-6、IL-1β、IL-17A、IL-17f等的上调以及紧密连接(tight junction,TJ)错位会导致上皮屏障完整性的破坏[29,31]。在分子水平上[32],这些细胞因子会增加CLDN-2、MLCK和STAT1磷酸化,降低E钙黏蛋白和ILDR-1。Cook等[33]用样本中提取的Tr1细胞和FOXP3阳性的Treg细胞上清液培养人结肠类器官,发现Tr1细胞和FOXP3阳性的Treg细胞抑制了效应T细胞的增殖和髓系细胞对IL-1β和肿瘤坏死因子(tumor necrosis factor,TNF)的产生。而且Tr1细胞可以分泌IL-22促进人肠上皮细胞的屏障功能,其细胞培养上清液促进了肠道类器官培养物中产生黏蛋白的杯状细胞分化。Patnaude等[34]通过培养人肠道类器官(图4),对极化的T-84细胞单层细胞,进行丁酸盐共处理和与免疫细胞的类器官共培养,监测微生物衍生的代谢物和炎症环境对IL-22反应的影响,研究发现,IL-22促进上皮干细胞的扩增与增殖、屏障功能障碍和抗菌肽的产生。Cheng等[35]使用右旋糖酐硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎模型研究uPAR缺乏的小鼠,发现通过药物抑制uPA-uPAR的相互作用可以保护上皮屏障免受炎症的诱导损伤,从而确定uPA-uPAR是肠上皮屏障完整性的关键因子,表明该配体受体对是预防肠道屏障破坏、促进黏膜愈合的潜在IBD靶点。

Fig.4 Brightfield microscopic images of human colon organoids after 6 d coculture with T-cell supernatants[33]图4 与T细胞上清液共培养6 d后人结肠类器官的亮场显微镜图像[33]
免疫反应失调、肠道黏膜内稳态的破坏也是IBD发病的重要原因。最新研究发现[36-38],NF-κB激活、内质网应激增加、未折叠蛋白反应和TLR5激活都会导致免疫反应的异常。Onozato等[39]用人类iPSC成功培养出具有成熟小肠特征的芽状类器官,发现当用TNF-α治疗时,该类器官可以复制黏膜损伤的发病机制。Li等[40]从脱乙酰酶(sirtuin 2,SIRT2)基因敲除小鼠和IBD患者中分离肠隐窝培养类器官,通过检测发现,SIRT2缺失导致Wnt/β连环蛋白信号通路的过度激活,引起肠道上皮细胞分化失调,加剧炎症。由此表明SIRT2对维持肠道黏膜内稳态有独特作用。另有中国学者的研究[41]发现,流苏石斛多糖通过维护肠黏膜完整性来改善DSS诱导的溃疡性结肠炎。甄爽[42]将海藻酸钠-类器官微球移植入UC小鼠体内,发现小鼠的肠炎症状得到有效改善,证实类器官移植对于治疗肠炎有着可观的效果,并且能显著降低促炎细胞因子的表达水平。
新的证据表明,微生物群-宿主的交换作用(cross-talk)调节[37,43]肠道免疫活动和IBD的易感性,肠道菌群和上皮细胞相互作用是影响上皮通透性的关键因子,对于维持肠道屏障完整、防止小分子和细菌进入到宿主体至关重要。同时,肠道微生物群还可以作为外部调节影响免疫内稳态。因此,可以利用肠道类器官模拟体内肠道微生态,促进有关肠道菌群和肠道上皮细胞互作的研究。Giri等[37]在IBD的背景下通过体外筛选能够抑制NF-κB的细菌。使用基于类器官的体外方法,鉴定了5株梭状芽孢杆菌,它们在肠道上皮类器官中可以抑制免疫介导的NF-κB激活。
3.2 结肠直肠癌
作为世界第三致命的恶性肿瘤疾病和第四大最常见的诊断癌症[44-45],结肠直肠癌的致死率在中国癌症死亡率中也高居第三位,而且该癌症的发病率及死亡率逐年提高,并趋于年轻化。目前认为,大多数结直肠癌来源于癌变的干细胞[46]。基因和表观遗传学的改变,通过不断积累使抑癌基因失活,并激活癌基因,最终产生癌症干细胞,癌症干细胞是肿瘤形成和维持的关键因素。
Wang等[47]通过建立患者衍生的肿瘤类器官,并进行单细胞RNA序列分析,发现PDO在转录组水平上与体内上皮细胞相似,并且忠实地保留了疾病特异性基因的表达,可以对不同阶段的癌症的发展因素进行针对性分析,是研究癌症分子机制的有力平台[47-49]。但是,传统培养基难以满足肿瘤类器官对特定微环境的需求[25]。有研究发现,癌相关成纤维细胞(cancer-associated fibroblasts,CAFs)有助于肿瘤的进展,将CAFs和CRC-PDO在HA-明胶水凝胶中共同培养的方法(图5),相较于单独构建PDO的传统培养方式,使得CRC-PDO保留了原始患者肿瘤的关键分子特征,并在CAFs的介导下,与基质间的交互作用得到重现[19]。Shin等[50]构建了PDO和小鼠结肠炎诱导的肿瘤类器官,与对照组相比,肿瘤组织中的DKK2表达增加100倍,证明DKK2是Lgr5+在结肠癌干细胞中表达的必要因子,且从分子机制上证明了SMAD4、TP53、APC和KRAS基因序列突变显示APC的敲除使DKK2激活C-Src,降解HNF4α1蛋白,进而促进Lgr5+的表达。Naruse等[51]利用小室系统的新培养模式,构建CAF-CRC PDO类器官,通过DNA微阵列分析发现包括REG家族和DUOXs等多种基因表达上调2倍以上,导致肿瘤细胞大量增殖,引发癌症。另有研究组通过整合基因组、转录组和磷酸化蛋白质组多组学的方法,在不同阶段、不同生长状况条件下对患者衍生结肠类器官进行特征化。经过RNA序列实验确定有5 125个在肿瘤中与正常类器官表达不同的转录物,尤其是PTEN途径[52]。最新研究发现,有近20%的新确诊CRC患者出现结肠直肠癌肝转移(colorectal cancer liver metastasis,CRLM)的情况,Mo等[53]对来自多组学水平的CRLM-PDO进行全面分析,发现该类器官平台可以捕捉患者内和患者间的异质性并预测患者的化疗反应,显示了在个性化医疗中的潜在应用价值。

Fig.5 Brightfield microscopic images of CRC-PDO in hydrogel derived from different patients[19]图5 水凝胶中不同患者来源的CRC-PDO亮场显微图像[19]
3.3 乳糜泻
乳糜泻(celiac disease,CeD)是一种遗传因素决定的,由麸质等环境因素诱发的小肠炎症性疾病[54],患者症状通常表现为因绒毛萎缩引起小肠黏膜损失而导致的营养吸收不良。研究表明,乳糜泻的发病与易感性基因[55]、麸质触发免疫反应[56]都有紧密联系。
乳糜泻作为一种多基因易感性炎症肠病,位于主要组织相容性复合物(major histocompatibility composites,MHC)上的人类白细胞抗原(human leukocyte antigen,HLA)-DQ2和HLA-DQ8基因型的个体具有CeD遗传易感倾向[55,57],其中HLADQ2.5发病的风险最高[58]。Dieterich等[59]从健康组和CeD患者体内分离十二指肠隐窝干细胞培养类器官,发现两组类器官表型及基因表达的巨大差异,并证明其原因是表观遗传修饰,从而解释了CeD中错乱的隐窝/绒毛轴发育。虽然有约30%的人群具有HLA-DQ2或-DQ8的遗传倾向,但实际上只有极小一部分人会真正发生CeD[60]。因此,对该疾病发生的其他因素的探究就显得尤为重要。Freire等[61]成功地构建CeD患者的肠道类器官(图6),与健康对照组的类器官相比,发现乳糜泻发病与先天免疫反应显著相关。从机理上讲,麸质部分分解产生的降解产物与tTGA形成复合物,被HLA-DQ2或HLA-DQ8传递给免疫细胞,从而产生抗tTGA及抗AGA抗体,引发炎症[62]。另外,γ干扰素(interferon-γ,IFN-γ)及TG2也会对肠组织造成破坏,TG2在HLA-DQ2或HLA-DQ8存在时,会增强抗麦胶T细胞的反应,而且HLA-DQ8可以促进并放大IFN-γ下游通路[55]。Serena等[63]构建患者来源的肠隐窝类器官,并用经消化的醇溶蛋白刺激类器官,发现醇溶蛋白会引发肠上皮细胞释放大量促炎因子,如INF-γ,加剧CeD发生。同时,Serena等还强调了CeD患者先天免疫机制的改变,从根本上导致其对麸质耐受性的丧失。

Fig.6 Patient derived duodenal organoids[61]图6 患者来源的十二指肠类器官[61]
4 肠道类器官用于药物研发与筛选
药物开发成本高且耗时长,很多情况下新药的开发往往难以成功。动物模型的缺陷使大部分药物不能应用于人体,这使得选择适合的药物开发模型显得尤为重要[64]。而药物能否应用于临床阶段,由本身的安全性质决定。因而,必须对研发的不同药物进行筛选[65]。类器官的出现,为药物的研发与筛选提供了一个全新且可靠的平台。肠道上皮存在大量药物代谢酶和外源加工蛋白,是药物吸收和代谢的重要部位,对药物的口服生物利用度起着至关重要的作用[2,66]。Xu等[32]利用CD患者衍生的肠类器官(图7)研究发现,CS-泼尼松龙可以降低CLDN-2、MLCK和STAT1的表达,提高E钙黏蛋白和ILDR-1的表达,对细胞因子引起的屏障功能破坏具有直接预防作用。患者衍生的类器官可以重现原始肿瘤的遗传学和组织学特征,并有效体现患者对药物的反应。Du等[67]利用高密度平板形式进行类器官培养,加速了基于类器官研究的药物研发,同时大幅降低了大规模筛选的成本。由此说明,肠道类器官作为药物研发与筛选的平台具有极高的灵敏性,其在药物研发及筛选中的优势尽显无疑。

Fig.7 Representative FITC-D4 penetration or brightfield microscopic images of intestinal organoids after treatment[32]图7 经处理后肠类器官的代表性FITC-D4渗透或亮场显微图像[32]
5 结论与展望
目前,国内外研究主要采用Lgr5+干细胞和多能干细胞进行肠道类器官的构建[68],结合生物材料创造新的外基质以维持类器官的生长,并不断探索基质中不同生长因子的比例及培养时间,以求最大程度地重现肠道内环境,旨在提供一个更精确的模型模拟肠道生理结构,检测疾病进展状况,探究其发病机制。虽然肠道类器官本身仍旧存在一些局限,但是相比于传统体外模型,类器官具有极大的模型优势与应用价值。在疾病机制探索方面不断提供新的见解,逐渐取代动物模型作为药物研发与筛选的工具。同时,肠道类器官在宿主-病原体相互作用、组织再生、肿瘤个性化治疗等方面也有广泛的应用。

