41Ca的AMS测量方法及在生物医学领域的应用
毕艳婷,付云翀
(1.西安地球环境创新研究院,西安 710061;2.中国科学院地球环境研究所 黄土与第四纪地质国家重点实验室,西安 710061;3.西安加速器质谱中心 陕西省加速器质谱技术及应用重点实验室,西安 710061)
钙(Ca)是动植物生长的必须营养元素[1]。动物体内99%的钙存在于骨骼和牙齿中,少部分存在于细胞外液和血液中。骨骼作为钙储存库,通过不断的骨吸收与骨形成维持体内钙平衡,当平衡改变(骨重塑异常),就会导致代谢性骨病,例如骨质疏松。Ca2+可以维持动物的新陈代谢和细胞的正常生理功能,并作为“生物学信使”参与细胞信号传导,胞浆内游离Ca2+浓度的变化可以反映多种疾病的发生,例如癌症和肾脏疾病等[2-8]。此外,Ca在植物细胞功能中发挥多重作用[9],对植物的生长发育和长期储存等方面至关重要。Ca2+在土壤中以游离金属或水合物形式稳定存在,植物根系从土壤溶液中吸收Ca,树叶、针叶凋落物和树皮分解再次将Ca释放到自然界形成循环过程[10-16]。但植物从土壤或营养液中摄取钙以及钙在植物内部的精确运转机制目前尚不清楚。充分了解并阐明Ca2+在植物体内的传输过程、分布规律和吸收情况可为植物的科学补钙提供帮助。因此,利用钙同位素对个体(植物和动物)进行精细化钙循环示踪对生物医学领域具有重要意义。
Ca的众多同位素中有6种稳定同位素(40,42,43,44,46,48Ca),它们在生物体内含量较高且自然界来源复杂,因此不适合对个体精确地定量化示踪。还有3种半衰期1 d以上的放射性核素,即41Ca(T1/2=(9.94±0.15)×104a)[17]、45Ca(T1/2=162.6 d)和47Ca(T1/2=4.5 d)。其中45Ca和47Ca衰变时会发射出电子和γ射线,二者半衰期相对较短,易对生物体造成辐射损伤(特别是应用前景最为重要的人体钙代谢研究)[18];由于二者监测周期相对较短,而骨代谢比较缓慢(时间尺度为月和年),即使忽略辐射剂量的影响,他们仍然不是研究生命系统钙代谢的最佳选择。
41Ca半衰期较长,衰变方式为轨道电子俘获并发射出3.3 keV的X射线,放射性极低,对生物体的损伤很小,适合长期生物示踪工作,120 ng41Ca对受试者的辐射剂量约为每年0.06 μSv,比自然辐射的总剂量低3万倍[20]。且天然样品中41Ca/40Ca比值非常低(10-14~10-15),实验时不用考虑自然界的影响,使得测量灵敏度得以提升。因此41Ca是一种理想的生物示踪剂,广泛应用于生命科学[21-35]和生物医学领域[36-46]。一般加入41Ca作为示踪剂使41Ca在样品中浓度有所提升,但由于其半衰期长、发射的X射线能量低和同量异位素41K干扰等诸多原因,传统的测量方法如衰变计数法、中子活化分析法和一般质谱法都难以高效准确地测定41Ca。与共振电离质谱(RIMS)[47-49]、液体闪烁谱仪(LSC)[50-52]和X射线(X-ray)光谱法[53]等相比,加速器质谱仪(AMS)通过测量41Ca/40Ca丰度比,从而量化分析41Ca并可有效排除干扰提升测量灵敏度[54]。X-ray光谱法虽然操作方便,样品制备过程简单,但计数率(<0.08%)和灵敏度较低[53];LSC方法相比于X-ray光谱法灵敏度略有提高(1%~13%)[50],但样品制备和计数时间较长;RIMS方法与LSC和X-ray光谱法相比是较为灵敏的41Ca测量方法,但综合对比检测限和测量时间,AMS为最佳选择[55]。
由此,本研究对41Ca的AMS测量技术发展和其在生物医学领域的应用进行阐述。主要介绍41Ca-AMS分析技术中涉及的研究样品形式的选择和不同能量下AMS的仪器技术发展,总结了主要的基于添加41Ca为示踪剂的生物医学领域的应用研究情况,如动物长期骨钙代谢、疾病防治与机理研究以及植物示踪等方面。
1 41Ca的AMS测量方法
1.1 不同样品形式的比较
1979年,Raisbeck和Yiou教授[19]验证了利用AMS测定41Ca的可行性,提出将41Ca加速至足够大能量(≥300 MeV)将41Ca和41K分离从而抑制同量异位素41K的干扰。基于这种方法,他们以310 MeV的能量在Orsay的ALICE回旋加速器上首次实现了AMS对陨石样品中41Ca的测量,样品形式为CaO,测量的41Ca/40Ca丰度灵敏度为1×10-11[56]。


CaH2样品的制备需要将41Ca从样品中以CaC2O2形式沉淀,在1 000 ℃下转化成CaO,CaO与Zr粉混合,在1 500 ℃下还原成金属Ca,金属Ca与H2进一步生成CaH2,回收率在80%~90%之间。但是制备过程复杂,危险性高,且CaH2在空气中吸湿性强,必须在惰性气体(如氩气)的保护下处理和储存,测试大批量样品不够便捷。
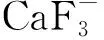

表1 AMS 的与方法本底对比Table 1 Comparison of background level using
1.2 41Ca-AMS测量技术
截止本世纪初,41Ca的测量主要在大型(≥5 MV)AMS上进行[18,74]。因为在较高的能量下,AMS对同量异位素41K有足够的辨别能力,可以很好地将41Ca与41K分离,灵敏度满足自然含量样品41Ca/40Ca的测量要求。但随着小型(≤3 MV)AMS已快速发展成为应用最广的加速器质谱仪类型(约占AMS总量的75%)[82],以及分析灵敏度在10-11以上即可开展生物医学领域的41Ca示踪研究相关工作,致使能否在小型AMS上进行41Ca分析备受瞩目。
对于小型(≤3 MV)AMS,较低的能量下无法完全分离41Ca和同量异位素41K,那么对其有效抑制显得格外重要。如前所述,在离子源引出阶段CaF2对41K的抑制能力不够高。因此,各实验室也尝试在测量阶段建立更为有效的分离41Ca和同量异位素41K的方法。2000年,Gif-sur-Yvette AMS在重离子线上建立了一个入射离子X射线探测系统(PXD),并尝试在2.25 MV的端电压下使用CaO样品测量41Ca[77, 83]。PXD系统通过探测被分析的离子束与目标箔相互作用产生的特征X射线来分辨同量异位素。对于低能加速器来说,X射线的分离程度几乎不受束流能量影响,但其产率对能量依赖性较强,所以这种方法测量灵敏度不高,41Ca/40Ca约为10-9。随后,使用CaH2和CaF2,在2.25 MV端电压下,通过气体电离探测器对41Ca进行分析,得到的本底值分别为10-13和10-11。
VERA尝试通过ΔTOF方法在3 MV串联加速器上利用CaF2样品对41Ca进行测量,本底值可以达到10-13[84]。ΔTOF方法的基本原理是根据41Ca和41K通过均匀的SiN箔后的能量损失差异导致飞行速度不同,从而在时间能谱上区分41K和41Ca[54,84-86]。但由于ΔTOF方法的探测效率较低,没有用于批量测量,他们还尝试使用一种紧凑型气体电离室测量41Ca,本底水平约为10-13[87]。

对于紧凑型AMS(<1 MV)来说,目前仍然无法在低能量情况下将41Ca和41K分离,但是可以通过39K校正的方法来实现对41Ca的测量。首次在紧凑型AMS上分析41Ca的是ETH,在0.5 MV的端电压下分析41Ca,校正后的背景值接近5×10-12,表明紧凑型AMS可以用于生物医学样本中41Ca的测量[74,92-93]。TNO和CNA在1 MV的端电压下获得了和ETH相当的本底水平,且TNO的测量效率较ETH有所提升[80-81]。近期MRC-EMSI实验室和Aarhus大学也测试了其1 MV AMS对41Ca的分析能力,背景值分别为1.41×10-11[78]和9×10-12[79]。
Xia等[94]报道了基于激光捕获和冷却的原子阱捕获分析技术(ATTA),可以测量41Ca原子的数量。单个原子在塞曼减速器中选择性冷却,通过谐振激光束捕获在磁光阱(MOT)中,并通过观察捕获原子的荧光来检测。ATTA分析完全不受其他元素(例如41K)的影响,可以用于增强超灵敏同位素痕量分析的能力。通过这种方法可以对自然样品中的41Ca/40Ca进行分析,目前检测限已经达到10-17,但总体分析效率有待进一步提升,样品需还原至金属Ca且用量较大。
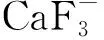
综上所述,3 MV AMS虽然无法将41K和41Ca完全分开,但在此能量下结合气体电离探测器可一定程度上分离41K,从而将41Ca/40Ca的本底值降到10-13左右。
2 41Ca的AMS测量技术在生物示踪中的应用
41Ca-AMS技术在生命科学[20-35]、生物医学[36-46]、地球科学[19]、环境科学[95-98]、核天体物理[66]等诸多领域应用广泛,本研究主要介绍41Ca-AMS技术在生物医学领域中的示踪应用。
2.1 41Ca的AMS测量技术在动物骨钙动力学研究中的应用
骨质疏松是全球公共健康问题之一[18],骨钙动力学研究对于骨质疏松的早期发现和治疗非常重要。与质量平衡法、骨活检的组织形态测量、双能X射线骨密度仪(DXA)测量骨密度(BMD)以及利用生化标志物监测骨吸收率的短期变化等方法相比,钙同位素示踪技术是一种理想的骨钙代谢直接测量方式。目前41Ca示踪技术是探究生物体骨钙代谢情况以及钙缺乏疾病机理等方面的重要手段,在评估人类骨骼健康、监测骨重塑动态和药物干扰效果等方面具有潜力[21-23]。早期测量只获得一些简单的结果,例如狗的骨代谢方法研究[18];人体血液与尿液中的41Ca/40Ca比值在一次性给药100 d左右后趋于稳定,约为1.5×10-11[24];药物干扰对41Ca浓度的影响等[21-22]。
二十世纪初,科学家们开始通过41Ca示踪人体骨转换率的微小变化建立人类钙平衡的线性动力学模型,可用来预测个体骨转换率的变化[25]。并通过群体药代动力学(NONMEM)分析41Ca数据,建立描述尿液中41Ca示踪剂动力学的连续三隔室模型[26],后将其扩展为四隔室模型[27-28],可用来评估药物干扰、饮食、激素水平和生活方式对骨骼代谢的影响。例如,评估双膦酸盐[29]、大豆异黄酮[30-31]、维生素D[32]等药物以及特殊饮食[33-34]对骨吸收的影响和高钙饲料(奶制品或碳酸钙)对代谢综合症猪的冠状动脉钙沉积的影响[35]。与传统技术相比,使用41Ca对骨骼进行同位素标记可以缩短干预周期,降低受试者数量,并更容易进行交叉研究。
2.2 41Ca-AMS测量技术在疾病防治与机理研究中的应用
41Ca-AMS技术可以应用于临床医学中一些疾病的早期诊断和预后监测。如监测健康个体与特殊疾病(例如ESRD、甲亢和肿瘤骨转移)患者之间的钙动力学差异可作为患者的早期诊断和长期预后的监测指标。研究人员对晚期肾病(ESRD)患者和健康个体的血清进行41Ca标记,并通过AMS测量受试者血清样本中的41Ca/40Ca比值,对比钙动力学分布可以看出,ESRD患者血浆中的41Ca/40Ca比值与对照组存在明显差异[36]。
航天医学领域也离不开41Ca-AMS的技术支持。航天员在训练和执行任务期间会长期处于失重状态,骨钙代谢失衡,骨量减少,且恢复非常缓慢,严重危害航天员的身体健康。对失重状态下的实验鼠进行41Ca标记,再用药物进行干预。通过AMS测量实验鼠股骨部位的41Ca/40Ca比值可以得到骨钙沉积情况,从而评估失重对股骨摄取外源钙的能力以及骨量下降和骨钙代谢紊乱的机理,有利于针对失重导致的钙代谢异常疾病提出相应的预防和治疗措施[37-38]。
钙吸收率的准确测量对于临床医学上合理补钙和预防钙代谢疾病具有一定指导意义。与传统的钙吸收率测量方式相比,41Ca标记体内钙库,可以区分内源钙从而获得补钙剂的净钙吸收率[39-40]。表观吸收率=(摄入Ca-粪便Ca)/摄入Ca×100%;净钙吸收率=(摄入Ca-粪便Ca+粪便中的内源Ca)/摄入Ca×100%;粪便中的内源Ca=粪便Ca×(粪便中41Ca/40Ca比值/血液中41Ca/40Ca比值)。通常净钙吸收率大于表观吸收率,这种测量方法可以更精准的测量钙吸收率,为临床上补钙剂量的确定提供理论指导。
41Ca-AMS技术也可以通过探究细胞内钙离子动力学从而研究相关疾病的机理。由于缺血时细胞内外Ca2+浓度会发生变化,用41Ca作示踪剂可以探究心肌缺血和氧气再灌注时心肌组织中的钙吸收和沉积情况,从而阐明不可逆肌细胞损伤的事件和机制[41]。致癌物质引起细胞癌变的过程中,胞浆内游离的Ca2+浓度呈现迅速升高的趋势。因此可以通过分析增加的Ca2+来源开展致癌机理研究。使用致癌物质刺激人肺成纤维样细胞时,41Ca-AMS技术可测量胞浆内Ca2+浓度变化和运动情况,为癌症的机理研究提供了一种新的检测手段[42-43]。这种方法还可用来检测中枢神经系统类药物(谷氨酸和MK-801)作用下的PC12细胞内外钙内流情况[44]和药物刺激破骨细胞时破骨细胞骨吸收行为[45-46]。
2.3 41Ca-AMS测量技术在植物示踪研究中的应用
此外,应用41Ca-AMS技术还可以对植物体进行示踪研究。2016年[99],国内首次建立了41Ca-AMS技术示踪植物体的样品制备方法,并基于该方法对桃树做了个别样品的41Ca示踪研究[100],通过树干注射的方法进行41Ca标记,利用AMS测量各器官的钙含量。结果表明,41Ca-AMS技术可以用于研究植物对土壤和水中Ca2+的吸收情况以及Ca2+在植物体内的转运机制,有望为农作物的科学补钙和破译植物-土壤系统界面化学相互作用过程提供帮助。
3 小结与展望
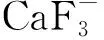
虽然利用41Ca-AMS可以实现生物样品的批量测量,但是,目前41Ca-AMS技术仍然面临一些挑战。对于小型AMS测量41Ca来说,如何将本底降到可以测量自然含量下的样品是亟待解决的问题。样品制备阶段可以利用CaH2和CaF2两种样品形式对41K进行抑制,其中CaH2的效果虽好,但制备流程复杂且危险,样品保存困难,不适合大批量测量;CaF2易于制备,但对41K的抑制在4个量级左右,且氟化物具有较强的记忆效应,导致即使使用大型AMS,在41K和41Ca完全分离的情况下,依然得不到理想的本底水平,无法满足大批量的地质年代学样品的测量。

