黄连解毒汤对ApoE-/-小鼠动脉粥样硬化炎症及主动脉斑块稳定性作用的机制研究
杨秀君,左 强,毛龙燕,张 军,戴小华
(1.安徽中医药大学研究生院,安徽 合肥 230012;2.安徽中医药大学第一附属医院,安徽 合肥 230031;3.安徽省中医药科学院心血管病研究所,安徽 合肥 230031;4.国家中医心血管病临床医学研究中心分中心,安徽 合肥 230031)
动脉粥样硬化(atherosclerosis,AS)是一种慢性、渐进性血管病变,以其为主要病理基础导致的心脑血管疾病,全球发病率和死亡率呈明显上升趋势,发病态势正逐渐向年轻化方向转变[1-2]。AS发生发展的过程是以脂质代谢障碍为基础病变,多种炎症因子参与其中,最终促使动脉血管内膜斑块形成,甚至斑块破裂,导致多种急性心脑血管疾病的发生[3]。因此,调脂抗炎是治疗AS的重要环节。他汀类药物是目前防治AS的一线药物,但部分应用他汀类药物治疗的患者发生了肝毒性、肌溶解等不良反应。目前,无论是实验研究还是临床研究,都已经广泛认可了中医药在AS防治方面的功效,且相对安全[4-5]。中医认为,高脂饮食易生湿热,而高脂饮食同时也是导致AS的重要危险因素之一,因此,湿热证与AS关系密切。黄连解毒汤是清热燥湿解毒的经典方剂[6-8]。既往多项研究[9-11]表明,黄连解毒汤能够有效达到降脂、抗炎等多种治疗效果,其干预作用不仅可改善AS小鼠的脂质代谢,还可影响干扰素γ(interferon-γ,IFN-γ)等多种炎症因子的表达。
本研究旨在观察黄连解毒汤对AS ApoE-/-小鼠血脂、血清炎症因子[白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-10(interleukin-10,IL-10)]水平,主动脉内膜斑块不稳定指数(vulnerability index,VI)的影响,进一步分析炎症因子水平和脂质代谢与AS斑块稳定性的关系。
1 材料
1.1 动物 36只SPF级6周龄健康雄性ApoE-/-小鼠[北京唯尚立拓科技有限公司,生产许可证号:SCXK(京)2016-0009],体质量为(22.5±3.0)g,购买后于安徽中医药大学动物实验中心饲养,每笼6只,自由进食及饮水,饲养设备严格无菌操作后使用,置于清洁饲养环境[SPF级,室温为(23±3)℃,相对湿度为50%,12 h光/暗循环]中饲养。本实验经安徽中医药大学实验动物伦理委员会批准,伦理编号为908138606021。
1.2 药物 黄连解毒汤(组成:黄芩、黄柏各6 g,黄连、栀子各9 g)饮片:购自安徽中医药大学第一附属医院中药房;阿托伐他汀(批号 EM4291):辉瑞制药有限公司。总胆固醇(total cholesterol,TC)测定试剂盒(货号 A030)、三酰甘油(triglyceride,TG)测定试剂盒(货号 A033)、低密度脂蛋白—胆固醇(low density lipoprotein-cholesterol,LDL-C)测定试剂盒(货号 A028)、高密度脂蛋白—胆固醇(high density lipoprotein-cholesterol,HDL-C)测定试剂盒(货号 A020):长春汇力生物;IL-10 ELISA试剂盒(货号 JYM0651Ra)、IL-6 ELISA试剂盒(货号 JYM0419Ra)、IL-1β ELISA试剂盒(货号 JYM0419Ra)、TNF-α ELISA试剂盒(货号 JYM0635Ra):武汉基因美科技;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号 BJ09162470):北京Bioss公司;CD68抗体(批号 GR3415295-10):英国Abcam公司。
1.3 仪器 酶标仪(RT-6000):深圳雷杜生命科学股份有限公司;半自动生化分析仪[CB171(A)X]:长春汇力生物技术有限公司;徕卡切片机(RM2016):上海徕卡仪器有限公司;OLYMPUS显微镜(CX41):上海普赫光电科技有限公司。
2 方法
2.1 动物分组及模型复制 采用高脂饮食构建AS ApoE-/-小鼠模型[12]。取36只6周龄健康雄性ApoE-/-小鼠,随机分为6组(空白组,模型组,黄连解毒汤低、中、高剂量组,阿托伐他汀组),每组6只;空白组6只始终喂食普通饲料,模型组及给药组均喂食高脂饲料(合肥青源生物科技有限公司生产;组成:4%胆固醇、10%猪油、5%白糖、81%基础饲料)。第8周末随机选取2只小鼠,取尾静脉血进行血清学指标检测,若与空白组比较,血清TC、TG、LDL水平显著上升,HDL-C水平显著下降,即为模型制备成功。后8周继续给予相应饲料喂养,共16周。
2.2 药物干预 自第8周末进行药物灌胃干预。将黄连解毒汤中药材依照原方比例加水煮沸,合并3次煎液,恒温100 ℃浓缩制成水煎剂,含5 g/mL生药,放冰箱冻存,使用时以蒸馏水以1∶10比例稀释。根据人和动物体表面积折算系数进行换算给予相应临床给药剂量,黄连解毒汤低、中、高剂量组小鼠分别按10、20、40 g/(kg·d)剂量给予黄连解毒汤;阿托伐他汀组小鼠按10 mg/(kg·d)剂量给予阿托伐他汀;空白组、模型组给予等量蒸馏水。每日灌胃1次,共8周。
2.3 标本采集 第16周末(药物治疗8周后的最后1天)采集标本。实验小鼠禁水禁食12 h,1%戊巴比妥钠40 mg/kg进行腹腔注射麻醉,摘取小鼠眼球,采集血液,样本静置2 h后,离心(4 ℃,3 400 r/min,10 min),收集上清,-20 ℃保存待测。将小鼠胸腹腔打开,摘取主动脉,清理干净后,裁取数段,分别放置在透射电子显微镜固定液、4%多聚甲醛溶液及液氮罐中,保存待测。
2.4 观察指标及方法
2.4.1 小鼠主动脉内膜的病理结构变化 取小鼠主动脉1 cm左右,放置在10%甲醛溶液的EP管中固定,梯度乙醇脱水,二甲苯使组织透明化,石蜡包埋,随后切片,蒸馏水洗,每组随机选取5张进行苏木精—伊红(hematoxylin-eosin,HE)染色,光学显微镜观察小鼠主动脉的组织形态。
2.4.2 小鼠血脂水平及炎症因子检测 取血清适量,使用半自动生化分析仪检测各组小鼠血清TC、TG、LDL-C及HDL-C水平;采用ELISA法检测各组IL-1β、IL-6、IL-10及TNF-α水平,实验步骤严格依照相应试剂盒说明书进行。
2.4.3 小鼠主动脉内膜斑块VI检测 利用组织学特殊病理染色技术测定主动脉内膜斑块内巨噬细胞含量、α-SMA细胞含量、斑块内胶原纤维含量及斑块内脂质含量,从而计算斑块VI:VI=(巨噬细胞含量/%+脂质含量/%)/(胶原纤维含量/%+平滑肌细胞含量/%)。
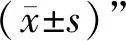
3 结果
3.1 各组小鼠主动脉内膜的组织形态比较 空白组小鼠主动脉管壁结构清晰,形态正常。与空白组比较,模型组小鼠主动脉管壁明显增厚,内膜下有大量泡沫细胞堆积、斑块形成,少量纤维在斑块表层沉积,部分动脉管壁变薄且轻度膨出。与模型组比较,黄连解毒汤中剂量组小鼠动脉管壁情况有所改善,主动脉内膜下少量泡沫细胞聚集,脂质斑块变小。黄连解毒汤高剂量组与阿托伐他汀组小鼠动脉内膜组织病理变化改善则更加明显,主动脉管壁结构清晰,趋于正常,其中黄连解毒汤高剂量组疗效最佳。见图1。

注:A.空白组;B.模型组;C.黄连解毒汤低剂量组;D.黄连解毒汤中剂量组;E.黄连解毒汤高剂量组;F.阿托伐他汀组;箭头指示处为疏松的结缔组织、泡沫细胞及炎症细胞浸润
3.2 各组小鼠血脂水平比较 与空白组比较,模型组小鼠TC、TG、LDL-C水平均显著上升(P<0.05),HDL-C水平均显著下降(P<0.05);与模型组比较,黄连解毒汤中、高剂量组小鼠TG、TC、LDL-C水平显著下降(P<0.05),HDL-C水平显著上升(P<0.05);与阿托伐他汀组比较,黄连解毒汤高剂量组小鼠TG、TC、LDL-C、HDL-C水平差异无统计学意义(P>0.05)。见表1。
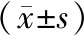
表1 各组小鼠血脂水平比较
3.3 各组小鼠血清炎症因子水平比较 与空白组比较,模型组小鼠血清IL-1β、IL-6、TNF-α含量均显著增加(P<0.05),IL-10含量显著减少(P<0.05);与模型组比较,黄连解毒汤中、高剂量组小鼠IL-1β、IL-6、TNF-α均显著减少(P<0.05),IL-10含量显著增加(P<0.05)。与阿托伐他汀组比较,黄连解毒汤低、中剂量组小鼠IL-1β、IL-6、TNF-α含量均显著升高(P<0.05),IL-10含量显著降低(P<0.05),黄连解毒汤高剂量组小鼠血清IL-1β、IL-6、TNF-α、IL-10含量差异无统计学意义(P>0.05)。见表2。

表2 各组小鼠血清炎症因子水平比较
3.4 各组小鼠主动脉内膜斑块VI比较 与空白组比较,模型组小鼠主动脉内膜斑块VI显著增加(P<0.05);与模型组比较,各给药组小鼠主动脉内膜斑块VI均显著减少(P<0.05);与阿托伐他汀组比较,黄连解毒汤低、中剂量组小鼠主动脉内膜斑块VI均显著增加(P<0.05),而黄连解毒汤高剂量组小鼠主动脉内膜斑块VI无明显变化(P>0.05)。见表3。
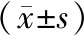
表3 各组小鼠主动脉内膜斑块VI比较
4 讨论
AS是以巨噬细胞中脂质异常代谢堆积并伴发炎症为特征的动脉内膜慢性病变,是多种心血管疾病的主要发病原因[13-14]。AS发生发展过程中,血脂状况及多种炎症细胞因子均具有重要作用,它们共同参与了AS斑块的形成。而动脉内膜斑块由稳定转变为不稳定,乃至破裂,或突发血栓、出血,则是急性心脑血管事件发生的重要原因之一[15-17]。目前对斑块不稳定的机制研究成果欠佳,因此,研究斑块不稳定的机制以及延缓斑块向不稳定方向发展,对于预防斑块破裂、血栓形成都具有重要的意义。
研究[18-20]发现,AS的病理变化以脾气虚为主,合并瘀、毒、痰三者的相互作用。气郁化火,内蕴热毒,灼伤脉络,脉损血瘀,阻塞脉管,热毒血瘀脉阻为心血管疾病的主要病机,故认为热毒蕴结是AS的关键病机,可用清热泻火解毒法对AS进行治疗。黄连解毒汤源自唐代王焘《外台秘要》,全方主要由黄连、黄柏、黄芩、栀子4味药组成,苦寒直折,清三焦之火。方中黄连为君,清泻心火、中焦之火;黄芩为臣,清泻肺热、上焦之火;佐以黄柏,泻下焦火;再使用栀子,通泻三焦之火。以上四药配伍,共奏清热解毒之良效。实验和临床研究[21-23]表明,黄连解毒汤对AS等心血管疾病均有显著的治疗作用,能明显减少患者动脉内膜斑块的面积,稳定斑块;还可以提高机体的抗氧化能力,防止各种炎症因子的破坏;还有可能通过改善血浆内源性代谢物的水平,使机体恢复正常代谢,从而达到治疗AS的目的。
本研究采用高脂饮食诱导构建AS ApoE-/-小鼠模型,16周后模型复制成功。就具体研究结果而言,不同剂量的黄连解毒汤对AS模型小鼠的血脂水平均具有改善作用,其中以黄连解毒汤高剂量组的总体效果最好。同时,经黄连解毒汤干预后,AS小鼠血清中促炎因子IL-1β、TNF-α、IL-6的表达水平均显著下降,而抗炎因子IL-10的表达水平均显著上升,VI也有所下降,且具有剂量依赖性,说明黄连解毒汤可能通过抑制炎症反应来维持动脉内斑块的稳定性,最终达到降低或延缓AS进程的目的。
综上所述,本研究结果表明,黄连解毒汤对改善模型小鼠AS具有明显的防治作用,其作用机制可能是降低炎症因子水平和血脂水平,改善主动脉血管壁斑块的稳定性。同时也表明,黄连解毒汤的疗效具有剂量依赖性,高剂量的黄连解毒汤作用和阿托伐他汀相当,且相对安全,未见明显不良反应。但是本研究的样本量较少,其深入的机制与靶点有待进一步研究和探索。

