ADC值在下腔静脉梗阻型布-加综合征肝脏氧化应激损伤中的应用初探
朱 楠,刘 亚,成德雷,袁支忠,郑 磊,刘 超,齐吴娟,袁 昊,陈 丽
1.安徽省蚌埠市中医医院影像科,安徽 蚌埠 233300;2.安徽省合肥市第三人民医院影像科,安徽 合肥 231000;3.中国科学技术大学附属第一医院/安徽省立医院介入放射科,安徽 合肥231000
布-加综合征(Budd-Chiari syndrome,BCS)是肝静脉流出道梗阻导致的一系列症候群[1-2]。肝静脉梗阻后改变细胞内外水分子弥散状态和微循环的灌注,进而影响DWI信号[3-4]。DWI是反映水分子布朗运动的MRI 功能成像技术,可检测水分子扩散信息[5]。DWI 已用于评估脂肪肝、乙肝后肝硬化等其他肝病[6],但其在BCS 淤血性肝损伤中的应用报道较少,应用价值尚未形成共识。因此,本研究参考Cheng等[3]的方法建立BCS 动物模型,探讨ADC 值在BCS肝损伤模型中的应用价值。
1 资料与方法
1.1 一般资料
本研究经安徽医科大学附属省立医院(安徽省立医院)伦理委员会批准,自动物实验中心购买体质量215~275 g 的健康雄性SD 大鼠135 只[许可证号:SCXK(苏)2005-0001],随机分为对照组(15只)、模型组(60 只)和假手术组(60 只),模型组及假手术组又各分为4个亚组(1、4、8、12周组,每亚组15只)。
1.2 方法
1.2.1 模型制备 在12 h 明暗交替光照周期、温度15~25 ℃、湿度50%~60%条件下清洁饲养,丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒均购自上海信裕生物科技有限公司,3 F 微导管购自日本泰尔茂公司。模型组于剑突下正中开腹分离肝镰状韧带,暴露肝后段下腔静脉,平行紧贴下腔静脉以3 F微导管,以0 号线环绕结扎后抽出(图1)。假手术组未结扎肝后段下腔静脉,其他过程同模型组。对照组仅常规饲养。

图1 模型组结扎下腔静脉图 注:开腹暴露肝后段下腔静脉,平行紧贴下腔静脉以3 F微导管,并以0号线环绕结扎
1.2.2 MRI 及DSA 检查 对照组于第12 周末,模型组及假手术组亚组分别于实验后1、4、8、12 周末晨起停饲。MRI 检查前以3.6%水合氯醛腹腔麻醉,剂量1.0 mL/100 g 体质量。大鼠取仰卧位,腹部加压固定,将肝脏置于腕关节线圈中心。使用GE HDXT 1.5 T MRI 常规行T1WI、T2WI 序列及DWI 检查。DWI 序列的b 值取800 s/mm2,SE-EPI 序列加脂肪抑制(SPAIR),扫描参数:TR 1 250 ms,TE 65 ms,视野56 mm×56 mm,层距0.3 mm,层厚3.0 mm,翻转角90°,矩阵192×192,激励次数8。图像后处理:测量ADC 值,ROI 大小15~20 mm2,尽量避开肝脏边缘及胆管、血管,取3 个ROI 的平均值行进一步分析。使用GE Innova 3100-IQ DSA 行DSA 检查,各组大鼠于任意一侧下肢消毒、铺洞巾,以21 G 静脉留置针穿刺股静脉,注射对比剂观察下腔静脉血流情况。
1.2.3 标本采集及检测 分别于实验后1、4、8、12周末,取大鼠肝组织标本,制作组织切片行HE 染色,余标本制备肝组织匀浆,采用双抗体夹心法[3]检测MDA、SOD 的表达量,严格参照试剂盒说明书相应步骤操作。
1.2.4 标本采集及病理染色 取适量MRI 测量ROI相应层面的新鲜肝组织,10%福尔马林固定24 h后,石蜡包埋,制作肝脏病理组织切片,用HE 染色,观察肝脏病理染色情况,余标本均置于-80 ℃冰箱冷藏备用。
1.3 统计学方法
采用SPSS 22.0 统计软件,检验数据是否符合正态分布及方差齐性,正态数据以表示,ADC 值、MDA、SOD 在对照组与模型组及假手术组间的差异行单因素方差分析,模型组与假手术组间的差异行两因素方差分析,各亚组间多重比较行LSD 检验;以Pearson 法分析ADC 值、MDA、SOD 间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 成模情况
对照组存活15 只,假手术组1、4、8、12 周亚组分别存活14、14、15、15 只,对照组及假手术组活动如常、反应机警,DSA 均无阳性表现。模型组各亚组均存活14、13、13、13 只,存活大鼠均成模,大鼠术后毛色灰暗无光泽,活动逐渐减少、反应迟钝,肝后段下腔静脉管腔变窄,远端扩张,4 周后见侧支循环逐渐形成(图2)。
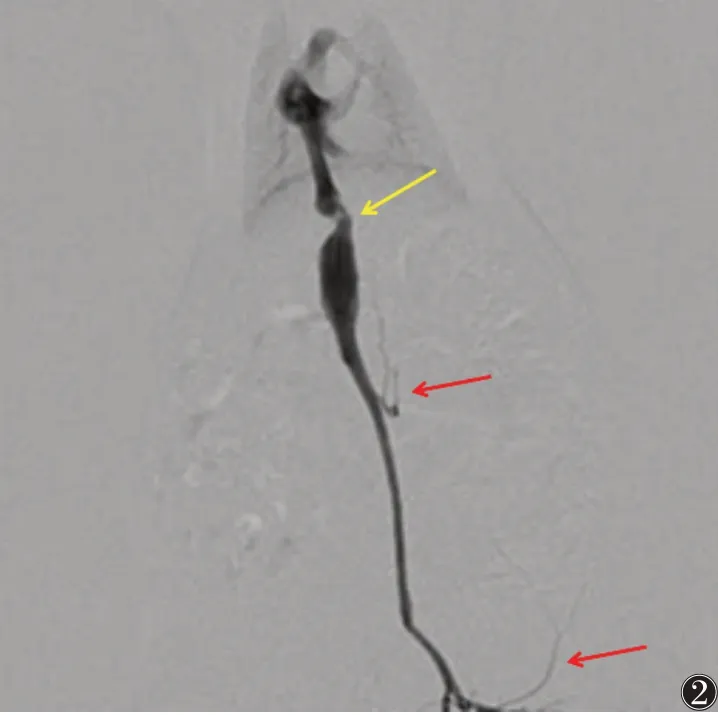
图2 模型组4周DSA 图 注:肝后段下腔静脉管腔变窄(黄箭),远端扩张,见侧支循环形成(红箭)
2.2 MRI表现
对照组、假手术组及模型组大鼠12 周常规T1WI未见明显异常,肝脏表面光滑,实质信号均匀,肝叶比例协调(图3~5);各组随机抽取9 只,纳入数据分析。各组大鼠ADC 值比较见表1,图6~8。对照组与假手术组各亚组ADC 值比较,差异均无统计学意义(均P>0.05);模型组各亚组ADC 值均低于对照组及假手术组各亚组,差异均有统计学意义(均P<0.05)。两两比较,模型组4周亚组及8周亚组均低于对照组及同一时间点的假手术亚组。模型组内ADC值随下腔静脉结扎时间延长呈先下降后升高趋势,1 周亚组高于4、8周亚组,4周亚组低于12周亚组,差异均有统计学意义(均P<0.05),ADC 值在4 周亚组最低(表1)。
表1 各组大鼠ADC值比较(×10-3 mm2/s,)
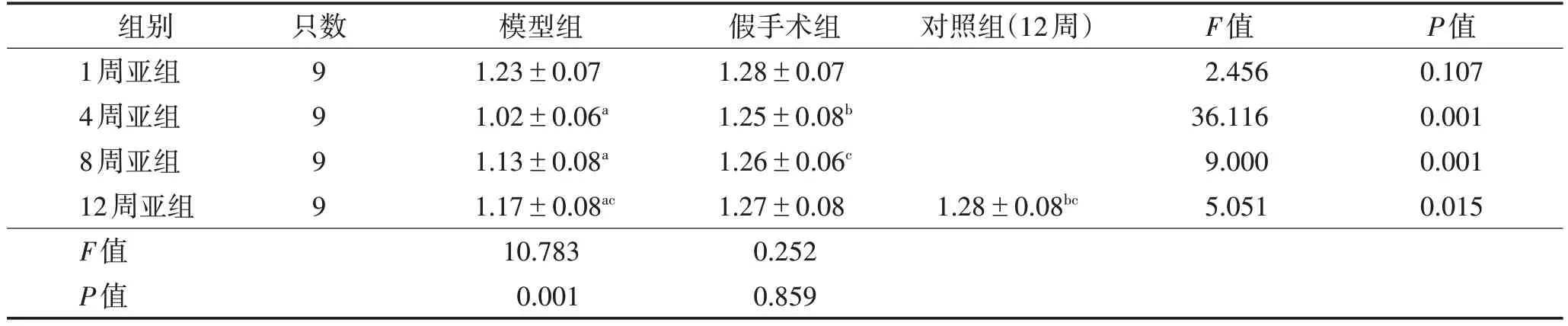
表1 各组大鼠ADC值比较(×10-3 mm2/s,)
注:与模型组1 周亚组比较,aP<0.05;与模型组4 周亚组比较,bP<0.05;与模型组8 周亚组比较,cP<0.05;对照组、假手术组各亚组方差分析,F=0.203,P=0.935;对照组、模型组各亚组方差分析,F=13.053,P=0.001;模型组、假手术组各亚组方差分析,F=12.999,P=0.001。
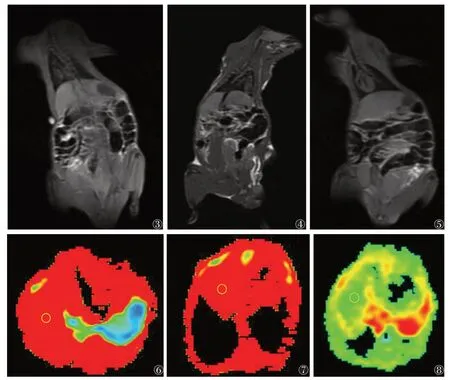
图3~5 对照组、假手术组和模型组大鼠12 周肝脏T1WI 冠状位图 注:肝脏表面光滑,肝叶比例协调,实质信号均匀 图6~8 对照组、假手术组和模型组12周肝脏ADC伪彩图
2.3 MDA、SOD结果(表2,3)
表2 各组大鼠MDA比较(nmol/L,)
注:MDA 为丙二醛。与模型组1 周亚组比较,aP<0.05;与模型组4 周亚组比较,bP<0.05;与模型组8 周亚组比较,cP<0.05;对照组、假手术组各亚组方差分析,F=0.337,P=0.851;对照组、模型组各亚组方差分析,F=50.937,P=0.001;模型组、假手术组各亚组方差分析,F=148.262,P=0.001。
表3 各组大鼠SOD比较(nmol/L,)

表3 各组大鼠SOD比较(nmol/L,)
注:SOD为超氧化物歧化酶。与模型组1周亚组比较,aP<0.05;与模型组4周亚组比较,bP<0.05;与模型组8周亚组比较,cP<0.05;对照组、假手术组各亚组方差分析,F=0.102,P=0.903;对照组、模型组各亚组方差分析,F=28.368,P=0.001;模型组、假手术组各亚组方差分析,F=29.683,P=0.001。
对照组与假手术组各亚组间的MDA、SOD 水平比较,差异均无统计学意义(均P>0.05)。模型组各亚组MDA 均高于对照组及假手术组各亚组,模型组各亚组SOD 均低于对照组及假手术组各亚组,差异均有统计学意义(均P<0.05);两两比较,同一时间的模型组亚组与假手术组亚组MDA、SOD 值比较,差异均有统计学意义(均P<0.05)。
模型组MDA 先升高后下降(第4 周最高),SOD先下降后升高(第4周最低),在模型组内各亚组比较,差异均有统计学意义;两两比较,模型组MDA、SOD在各亚组间多重比较,除了1 周亚组与12 周亚组、4 周亚组与8 周亚组间差异均无统计学意义之外,其余各亚组间多重比较均有统计学意义(均P<0.05)。
2.4 病理结果
假手术组及对照组观察至第12 周,肝细胞规律排列,形态正常,核仁清晰,肝血窦无扩张(图9,10)。模型组肝脏病理损伤随病程进展而加重,肝血窦扩张,小叶中心性肝细胞萎缩、变性、坏死,胞浆红染,红细胞淤积,以12周亚组最明显(图11~14)。

图9 对照组12 周大鼠病理图(HE 染色,高倍放大)图10 假手术组12 周大鼠病理图(HE 染色,高倍放大)图11~14 模型组大鼠1、4、8、12周病理图(HE染色,高倍放大)
2.5 各指标相关性分析
模型组ADC 值与SOD 呈正相关(r=0.828,P=0.001),与MDA呈负相关(r=-0.756,P=0.001),SOD与MDA呈负相关(r=-0.834,P=0.001)(图15~17,表4)。
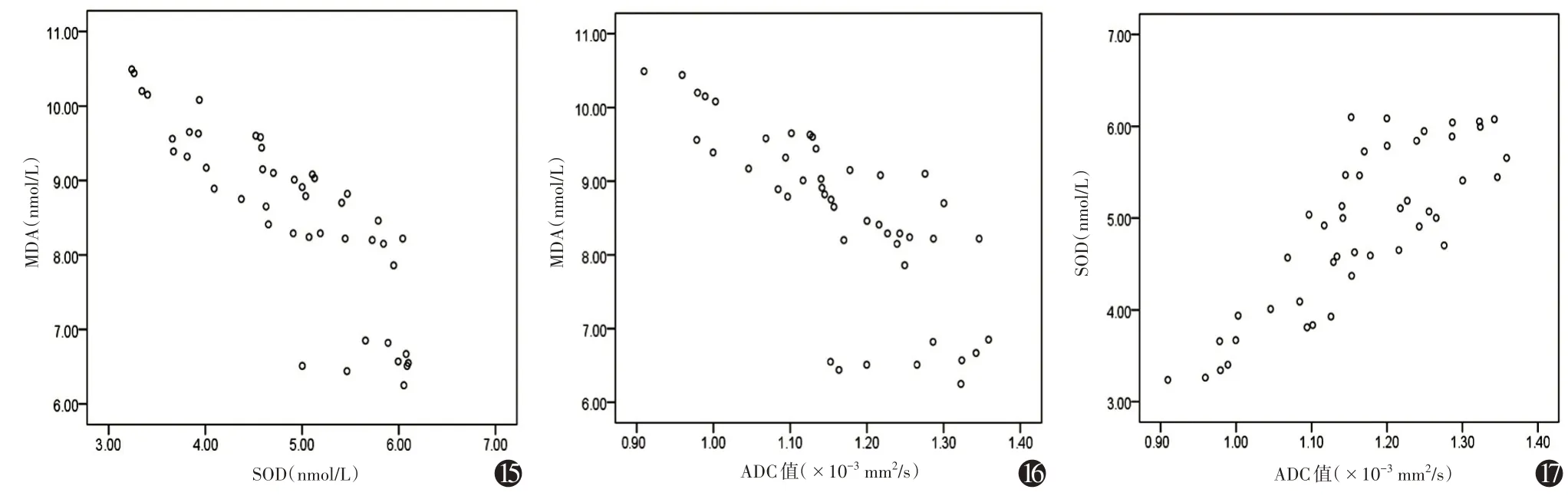
图15 MDA 与SOD 相关性散点图 注:模型组ADC 值与SOD 呈正相关(r=0.828,P=0.001)。MDA 为丙二醛,SOD 为超氧化物歧化酶 图16 MDA与ADC值相关性散点图 注:模型组ADC值与MDA呈负相关(r=-0.756,P=0.001)图17 SOD与ADC值相关性散点图 注:模型组SOD与MDA呈负相关(r=-0.834,P=0.001)
3 讨论
ADC 值是DWI 的量化参数,其可活体检测水分子运动[5-6]。Shin 等[7]研究发现,肝脏损伤会导致细胞外基质沉积,进而影响肝脏ADC值,肝脏ADC值与肝损伤严重程度呈负相关。BCS 的病理改变表现为肝静脉回流受阻,导致肝内微循环障碍,肝窦红细胞淤积;随着肝细胞水肿加重,肝细胞坏死,核破裂,进而影响水分子弥散[4]。BCS的本质是淤血性肝损伤,肝淤血后的缺氧状态可导致氧化应激损伤[3,8]。细胞的氧化损伤与能够引发胞膜脂质过氧化的自由基的产生有关。脂质过氧化的醛类产物MDA可能介导肝脏的慢性氧化应激损伤。MDA 在肝纤维化过程中增加了星状细胞中的Ⅰ型前胶原信使RNA 和蛋白质的表达[9-10];SOD 是机体抗氧化系统的代表物,其可清除氧自由基[10]。
本研究发现,模型组MDA呈先上升后下降趋势,SOD 呈先下降后升高趋势,ADC 值始终低于正常水平,说明BCS 肝细胞存在水分子弥散受限和淤血后氧化应激损伤。研究发现,随着肝损伤加重,细胞外基质不断增加,水分子弥散受限,ADC 值逐渐降低,与肝损伤的发展呈负相关[11]。BSC模型损伤的机制可能是肝淤血缺氧后发生氧化应激损伤,改变细胞膜的通透性,阻碍细胞内水分子扩散,同时肝脏病理损伤随大鼠模型的观察时间推移不断进展,第12 周时淤血病理损伤最严重,这说明氧化应激介导了BCS淤血性肝损伤[12-15]。
本研究中模型组ADC 值与SOD 呈正相关,与MDA 呈负相关,这是因为肝静脉回流受阻,导致肝窦淤血,肝细胞内水分子扩散受限,淤血缺氧后诱导缺氧因子表达,导致氧化应激损伤[4];这与内镜下观察到的肝索破坏、汇管区红细胞聚集、肝脏淤血一致,提示DWI 可一定程度反映肝淤血缺氧损伤程度[4]。4 周后,随着侧支循环建立,MDA 逐渐下降(SOD 及ADC 值逐渐上升),这说明随着4 周后侧支血管的建立,代偿了肝脏的静脉回流障碍,从而改善了肝脏的微循环障碍,提高了肝细胞水分子扩散能力。然而,模型组ADC 值始终低于对照组健康大鼠,说明BCS 的肝脏损伤随着自然病程会持续进展,无法自愈,与其他学者的研究[16-17]相符。
综上所述,ADC 值与BCS 的肝脏淤血缺氧后的氧化应激损伤存在一定的相关性,可作为动态评估BCS肝脏淤血缺氧损伤的新的检查手段。

