米糠酚类物质对高脂诱导的小鼠糖代谢异常及氧化应激的改善作用
马 勤,童 鑫,张名位,董丽红,黄 菲,赵 东,池建伟,贾栩超,张瑞芬
(广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室广东省农产品加工重点实验室 广州 510640)
随着生活水平的提高,高脂膳食也日益流行,由此造成了肥胖症的发生,进而引发糖尿病等慢性疾病。脂质的积累与机体的氧化应激水平密切相关,氧化应激条件下可通过激活相关代谢通路,增加脂肪的生成并减少脂肪的分解,来促进机体脂质积累[1]。此外氧化应激反应可影响骨骼肌和脂肪组织中葡萄糖的吸收,并引起胰岛素抵抗[2],因此降低体内氧化应激水平是改善脂代谢和糖尿病的重要途径。酚类物质是植物中重要的次级代谢产物,是一种重要的抗氧化剂,可能是膳食中预防糖脂代谢紊乱的重要活性物质[3-4]。在临床上,姜黄素、表没食子儿茶素和咖啡因等抗氧化剂已被用于肥胖症的预防[5-6]。流行病学研究表明增加主食中全谷物的比例能够明显降低肥胖、糖尿病、动脉粥样硬化等慢性疾病的发病风险[7-8]。随着对全谷物认知的加深,越来越多的科研人员对全谷物进行开发利用以替代精制谷物。糙米作为一种典型的全谷物,富含酚酸、膳食纤维、γ-谷维素等生物活性物质,且大部分存在于麸皮层[9]。目前有研究表明米糠酚类物质具有改善脂代谢的作用,然而其改善糖代谢的活性作用及其机制尚不清楚。通过动物实验探究米糠酚类物质对高脂膳食引起的糖代谢异常及氧化应激的影响,对引导民众健康饮食具有一定的意义。
HPLC 分析显示糙米中富含对香豆酸、阿魏酸、表儿茶素、原儿茶酸、芥子酸等酚酸类物质;药理学研究发现其具有抗氧化、抗炎、降血脂、护肝等活性[10-12]。富含酚类物质的红米可通过ACAT-2、HMG-CoA 还原酶和SREBP-2 降低肝脏胆固醇合成,并通过CYP7a1 和CYP8b1 促进高胆固醇饮食小鼠肝脏胆固醇降解,从而发挥降低胆固醇的作用[13]。课题组前期研究发现米糠酚类物质通过AMPK 信号通路降低肝脏中脂质的生物合成,促进脂肪酸的氧化分解,从而调节脂代谢[14]。米糠酚类物质可通过抗氧化活性减少自由基损失,从而改善β 细胞功能障碍,促进胰岛素分泌[15]。
米糠酚类物质具有抗氧化的作用已广泛报道,且有研究证实其具有改善脂代谢的作用并能调节胰岛细胞的功能,然而其是否与改善机体氧化应激相关尚不清楚。本研究采用高脂膳食诱导的小鼠模型,研究米糠酚类物质对其糖脂代谢的影响,重点探讨其对脂肪组织细胞形态、体内相关激素水平及氧化应激水平的影响。
1 材料与方法
1.1 材料与仪器
新鲜米糠,广州荔泉食品有限公司;HPD-300大孔树脂,沧州宝恩吸附材料科技有限公司;6 周龄雄性C57BL/6J 小鼠购于中山大学实验动物中心(许可证号为SYXK(粤)2012-0081);胰岛素ELISA 试剂盒,Crystal Chem 公司;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒、谷胱甘肽过氧化物酶(GSH-px)试剂盒、过氧化氢酶(CAT)试剂盒,南京建成生物工程研究所;Infinite M200pro 酶标仪,TECAN 公司;Nikon Eclipse Ci 显微镜,Nikon 公司;ACCUCHEK Mobile 血糖仪,德国Roche 公司。
1.2 米糠酚类物质的制备
米糠酚类物质参考前期研究的方法制备[10]。采用超临界二氧化碳的方法进行脱脂得到脱脂米糠,采用冷的80%的丙酮水溶液对脱脂米糠中酚类物质进行提取,提取液浓缩后过HPD-300 大孔树脂,纯水洗脱后,采用70%乙醇洗脱,洗脱液经旋转蒸发仪浓缩,并经冷冻干燥后得到米糠酚类物质粉末。采用Folin-Ciocalteu 比色法测定米糠酚类物总酚含量,采用HPLC-DAD 检测米糠酚类提取物中酚类物质的构成及其含量。所得总酚含量为82.5%,对香豆酸、芦丁、咖啡酸、阿魏酸和芥子酸是含量最高的5 种化合物,其含量分别为(86.18 ± 3.16),(81.75± 1.38),(81.87 ± 1.12),(68.74±3.15),(58.36±2.44)mg/g[10]。
1.3 动物饲养
80 只C57BL/6J 小鼠于温度(23±2)℃,相对湿度40%~60%的条件下适应饲养1 周后,随机分为4 组(n=20):正常组(NC 组)、高脂组(HF 组)、低剂量组(HF+LP 组)和高剂量组(HF+HP 组)。其中NC 组饲喂正常饲料,HF 组、低剂量组和高剂量组均饲喂高脂饲料,低剂量组和高剂量组分别灌胃200 mg/(kg·d)和400 mg/(kg·d)剂量的米糠酚类物质(RBPE),NC 组和HF 组灌胃相同体积的蒸馏水作为对照。
饲喂16 周后,小鼠禁食12 h,眼眶取血,3 000×g 离心15 min 后,取上清保存于-80 ℃冰箱备用。处死小鼠后取肝、脾、肾、附睾脂肪及肾周脂肪并称重,计算脏器指数。取部分新鲜附睾脂肪组织固定于4%多聚甲醛溶液中,用于组织染色。其余脏器分装保存于-80 ℃冰箱备用。
1.4 组织染色
新鲜附睾脂肪组织经4%多聚甲醛固定24 h后,脱水、包埋切片后,用苏木素-伊红染色,并于显微镜下观察拍照。
1.5 血糖、胰岛素水平测定
小鼠禁食、不禁水12 h 后,眼眶取血,采用罗氏血糖仪测定空腹血糖;参照试剂盒说明书的方法测定血清胰岛素和瘦素水平。
1.6 葡萄糖耐量测定
小鼠处死前1 周,禁食、不禁水12 h,腹腔注射葡萄糖溶液(2.0 g/kg)后,断尾取血,采用罗氏血糖仪分别测定0,0.5,1.0,1.5,2.0 h 的血糖水平,并计算血糖曲线下面积(AUC)。
1.7 血清及肝脏氧化应激水平测定
根据试剂盒操作说明书测定血清和肝脏MDA、SOD、GSH、GSH-px 和CAT 的水平。
1.8 数据处理
所有数据以“平均值±标准偏差(SD)”表示,采用SPSS 18.0 软件进行单因素方差分析,P<0.05表示为差异显著。
2 结果与分析
2.1 RBPE 对高脂喂养小鼠体质量和脏器指数的影响
由图1 可知,各组小鼠体质量均随着饲喂时间的延长而增长,其中HF 组小鼠的体质量增长幅度最大,低剂量和高剂量的RBPE 可以减缓高脂膳食引起的体质量增加,而差异不显著。由表1可知,与正常饮食相比,高脂膳食可以显著提高小鼠肝脏、附睾脂肪、肾周脂肪、肾脏和脾脏的脏体比(P<0.05)。RBPE 可以剂量依赖地降低肝脏、附睾脂肪和肾周脂肪的脏体比(P<0.05);高剂量的RBPE 膳食可以显著降低肾脏的脏体比,而低剂量的RBPE 对脾脏的脏体比没有显著影响。这些结果表明RBPE 可以降低高脂膳食引起的小鼠内脏脂肪的积累。
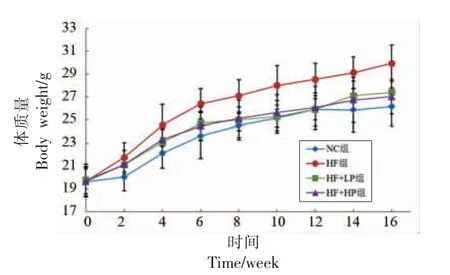
图1 RBPE 对小鼠的体质量的影响Fig.1 Effect of RBPE on body weight of mice
2.2 RBPE 对高脂喂养小鼠血糖的影响
各组小鼠血糖水平及其口服葡萄糖耐量下曲线面积如图2 所示。与NC 组相比,HF 组小鼠空腹血糖水平显著升高,而低剂量和高剂量RBPE均可以显著降低高脂小鼠的空腹血糖水平(P<0.05),提示RBPE 可以有效改善高脂膳食引起的小鼠血糖水平升高。葡萄糖耐量可反应胰岛β 细胞功能以及机体对血糖的调节能力[16]。结果显示,腹腔注射葡萄糖后各组小鼠血糖均迅速升高,于0.5 h 达到最大值并缓慢下降。2 h 时,NC 组和RBPE 处理组小鼠血糖水平均恢复至正常水平,而HF 组小鼠血糖仍处于较高水平。空腹糖耐量曲线下面积(AUC)结果显示,高脂膳食明显导致糖耐量受损,而RBPE 对高脂引起的糖耐量受损具有一定的改善作用(P<0.05)。这些结果表明RBPE 对高脂引起的小鼠糖代谢异常具有改善作用。
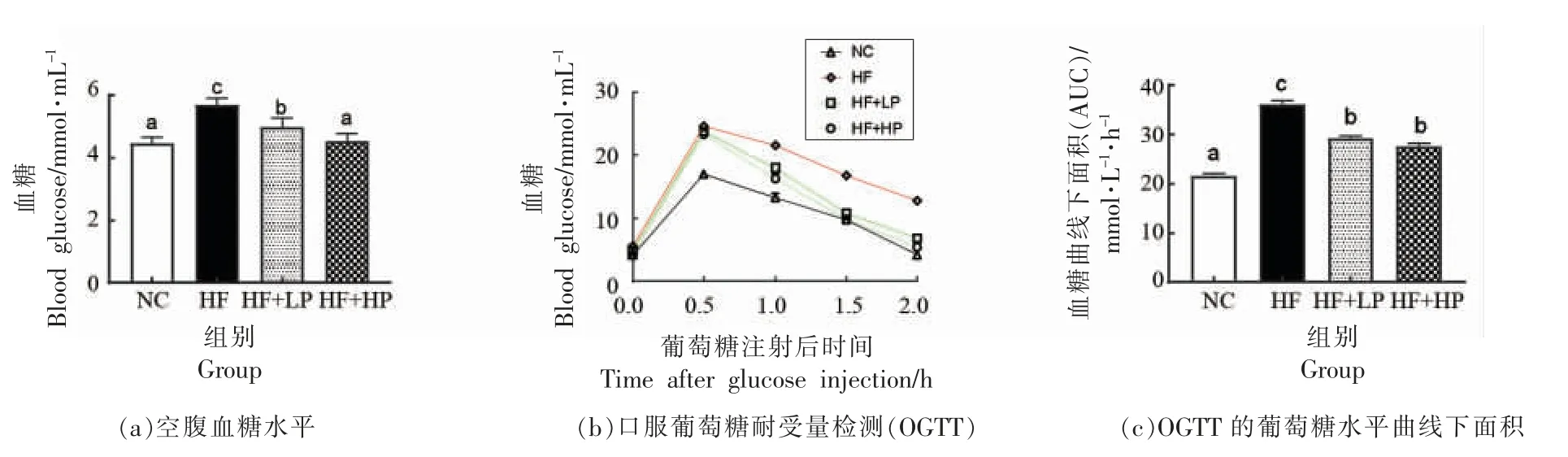
图2 RBPE 对小鼠糖代谢的影响Fig.2 Effect of RBPE on glucose metabolism in mice
2.3 RBPE 对高脂喂养小鼠胰岛素水平和附睾脂肪组织形态的影响
胰岛素抵抗是2 型糖尿病的重要特征,机体表现为高胰岛血症,而胰岛素敏感性降低[17]。血清胰岛素测定结果如图3a 所示,与NC 组相比,HF组小鼠胰岛素水平显著升高(P<0.05),而高剂量RBPE 干预可显著降低高脂小鼠的血清胰岛素水平(P<0.05)。脂肪组织在糖尿病的发展过程中发挥重要作用,其可以通过调控PKCε 介导脂肪饮食诱导的胰岛素抵抗,而当存在和缺乏PKCε 时,脂肪细胞在形状和大小上会表现出差异[18]。因此进一步探究了RBPE 对小鼠附睾脂肪组织形态的影响。结果如图3b 所示,与NC 组相比,HF 组小鼠附睾脂肪细胞显著增大,而经RBPE 干预鼠附睾脂肪细胞的体积明显减小。这些结果表明RBPE 对高脂引起的小鼠高胰岛血症具有一定的抑制作用。
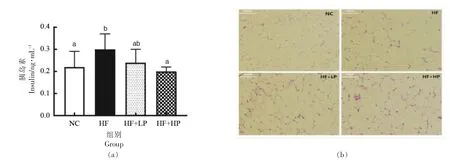
图3 RBPE 对小鼠胰岛素水平(a)和附睾脂肪组织形态(b)的影响Fig.3 Effect of RBPE on insulin level(a)and histopathological observation of epididymal fat tissue(b)
2.4 RBPE 对高脂喂养小鼠氧化应激水平的影响
SOD、CAT 和GPx 是内源性抗氧化酶,可以清除细胞内的氧自由基。GSH 是一种主要的内源性抗氧化剂,能中和细胞内的自由基和活性氧化合物。SOD、CAT、GPx 和GSH 在维持机体氧化还原稳态中发挥重要作用;MDA 为脂质过氧化的终产物,可反映机体氧化损伤程度[19-20]。各组小鼠血清SOD 活力和MDA 含量如表2 所示,与NC 组相比,HF 组小鼠SOD 的活力显著降低,MDA 的含量显著升高(P<0.05)。与高脂膳食相比,RBPE 膳食可以显著提高SOD 的酶活力,并降低血清MDA的含量(P<0.05)。肝脏是调节血糖代谢的重要器官。各组小鼠肝脏的氧化应激水平如表2 所示,与正常饮食相比,高脂膳食显著降低肝脏SOD、CAT和GSH-px 等抗氧化酶的活力,降低抗氧化物GSH 的含量,并促进过氧化产物MDA 的产生(P<0.05)。与HF 组相比,RBPE 组小鼠的SOD、CAT和GSH-px 等抗氧化酶的活力显著提高,MDA 含量显著下降,且抗氧化物GSH 的含量显著升高(P<0.05)。这些结果表明RBPE 可以显著降低高脂膳食引起的小鼠体内氧化应激水平。
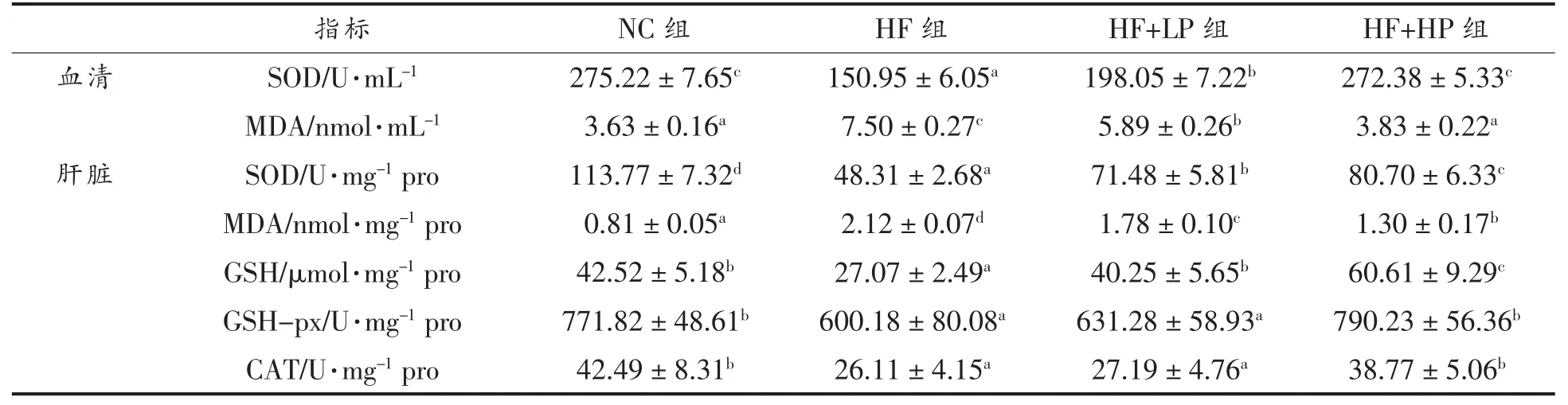
表2 RBPE 对小鼠血清和肝脏氧化应激水平的影响Table 2 Effect of RBPE on oxidative stress in serum and liver
3 讨论与结论
本研究发现米糠酚类物质可以显著减少高脂小鼠脏器脂肪积累,降低空腹血糖水平,改善小鼠的葡萄糖耐受性,调节小鼠糖代谢紊乱。Justo 等[12]的研究也表明米糠酶解提取物可以减轻高脂诱导的小鼠的血糖升高、胰岛素抵抗、血脂异常以及脂肪组织的形态改变。Jung 等[11]探究了米糠酚酸类物质和阿魏酸对db/db 小鼠的影响,结果表明两者均可以显著降低小鼠血糖水平。本研究中米糠提取物酚类物质含量超过80%,其主要成分为对香豆酸、芦丁、咖啡酸、阿魏酸和芥子酸。研究表明咖啡酸、阿魏酸、没食子酸和原儿茶酸可显著降低高果糖饮食诱导的大鼠血糖、胰岛素和瘦体水平,减少血清炎症因子的含量[21-22]。这些研究结果一致表明米糠酚类物质具有改善糖代谢的作用。
米糠酚类物质体外抗氧化作用已被广泛报道,研究显示其具有清除ABTS、DPPH、过氧化自由基(ORAC 法)的作用[23-25]。Saji 等[26]发现米糠酚类物质可以显著抑制过氧化氢诱导的RAW 264.7细胞内活性氧生成,降低细胞内MDA 水平。Xiao等[27]研究表明米糠酚类物质可以通过减轻线粒体功能障碍,降低酒精诱导的小鼠体内氧化损失,从而发挥护肝的作用。然而米糠酚类物质对高脂诱导的小鼠体内氧化应激作用尚不清楚。本研究表明米糠酚类物质可以提高高脂小鼠SOD、CAT 和GSH-px 等抗氧化酶的活力,降低MDA 的含量,并提高抗氧化物GSH 的含量,降低高脂引起的氧化应激反应。芦丁可以降低高脂小鼠肝脏MDA 的水平,提高GSH 含量,并提高SOD 和GPx 等抗氧化酶的活性[28]。Shen 等[29]研究表明米糠酚类物质的主要成分对香豆酸可以通过Nrf 信号通路抑制活性氧的生成,从而改善高脂小鼠的糖脂代谢。这些研究提示米糠酚类物质改善高脂小鼠氧化应激的作用,可能是对香豆酸、芦丁、阿魏酸等酚类物质协同作用的结果。
本研究发现米糠酚类物质可以显著改善高脂小鼠的糖代谢紊乱,其机制可能通过提高机体SOD、CAT 和GSH-px 等抗氧化酶的活力,促进GSH 等抗氧化物质的合成,并降低氧化产物MDA的产生从而降低小鼠体内氧化应激水平。

