基于纤维素稳定乳液的生物活性物质运载体系研究进展
李 想,隋沅均,庞一帆,魏 佳,周 慧,何云海,任丹丹,刘 舒,武 龙,*
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034)
乳液是指在乳化剂的参与下,使某种液体以液滴的形式,分散在与之不相溶的另一种液体中而构成的均一的、稳定的体系[1-2]。基于乳液连续和分散的不同两相共存的特殊结构,生物活性物质可以嵌入在乳液的分散相中,从而实现有效成分的包埋和递送[3-4]。近年来,乳液作为生物活性物质递送载体已成为广大科研学者的研究的热点内容。姜黄素[5-6]、虾青素[7]、β-胡萝卜素[8-10]、番茄红素[11]、葡萄柚精油[12]、茶多酚[13]、α-生育酚及白藜芦醇[14]等多种生物活性物质已经成功地荷载在乳液系统中,在食品、药品及包装材料中发挥重要作用。将乳液作为递送生物活性物质的载体系统,不仅可以改善有效成分的分散性,延缓功能性成分的降解、氧化和挥发[15],还可以在其运送到人体的过程中起到运载和缓释的作用[16-17]。此外,乳液的稳定性受稳定粒子的种类、内相比、温度、pH 和离子浓度等条件的影响[18-19],这种对特定条件的刺激响应特性,使乳液载体系统能在指定条件下释放其荷载的生物活性物质,从而实现有效成分的靶向递送,进一步提高功能性成分的生物利用度[20]。
为实现不同生物活性物质的荷载,稳定剂在整个系统中起到至关重要的作用。在稳定乳液水油界面的基础上,稳定乳液的粒子或乳化剂既需要对荷载的生物活性物质起到包封的作用,同时也需要在不同的条件下保护功能性成分的活性[21]。尤其当系统应用于食品组分时,对载体稳定剂的研究往往侧重于安全性更高的天然高分子化合物,包括多糖类化合物(如淀粉颗粒、壳聚糖和纤维素等),蛋白质以及二者的复合物等[22]。其中,纤维素作为自然界中含量最多的天然高分子材料,以纤维状的形式广泛存在于植物、细菌、藻类和被囊动物中,年产量超过90 亿吨[22],具有分布广,产量大,价格低廉,生物降解性良好等优良特性[22-23],在稳定生物活性物质的乳液载体中表现出高度的应用潜力,具有广阔的开发前景。
当前,关于食品生物活性物质递送载体的研究方兴未艾。针对不同有效成分的特性及应用需求,定制最佳的释放策略是实现乳液载体智能化发展的关键环节[24]。纤维素材料的结构特性使其在提高乳液稳定性的同时,也为载体的结构和组装形式可调性创造了广阔的设计空间。然而,相关领域的研究仍缺乏系统的指导资料。为此,本文以纤维素乳液负载生物活性物质的载体体系为切入点,从纤维素乳液的稳定机制、稳定乳液载体的纤维素类型、体系负载的主要生物活性物质及乳液中影响生物活性物质释放的主要因素四个角度,综述国内外报道中最新研究进展,旨在深度开发纤维素资源的利用空间,揭示其在食品相关领域中的发展潜力,深入研究纤维素材料的界面特性及其稳定乳液的释放机制,进一步拓展功能性食品开发的市场,为新型生物活性物质递送载体的构建提供理论研究基础。
1 纤维素乳液的稳定机制
如图1 所示,在纤维素稳定乳液载体方面,通过Web of Science(www.web of science.com)数据库检索组合“cellulose emulsion encapsulation”,共有250余条研究报道,成果数量呈现在波动中逐年上升的趋势(图1A),体现了相关领域对纤维素材料日益升高的关注度。其中,在药物药理学领域的大量研究也证实,纤维素乳液为药物递送系统提供了绿色高效的载体材料[25-31]。此外,按研究发表的国家来划分,中国发表的文章以55 篇的数量位居第一,占研究总和的22%,反映了我国对纤维素基乳液载体研究的重视(图1B)。

图1 通过Web of Science 检索“cellulose emulsion encapsulation”相关论文的数量分布图Fig.1 Quantitative distribution of the articles on ''cellulose emulsion encapsulation'' searched by Web of Science
作为负载生物活性物质的必要前提,纤维素乳液自身的稳定性在载体的构建中起到至关重要的作用[32]。纤维素自身不溶于水,因此绝大多数由纤维素稳定的乳液属于由固体粒子稳定的Pickering 乳液[33-35]。如图2 所示,相较于依靠表面活性剂降低界面张力以稳定油水界面的传统乳液,在不含有表面活性剂的Pickering 乳液中,两相界面的稳定通过固体粒子的吸附改变空间位阻实现[36-37]。以Pickering乳液的稳定机理为主要依据,纤维素乳液的稳定机制主要可以划分为界面膜稳定机制和三维粘弹粒子网络稳定机制[38-39]。
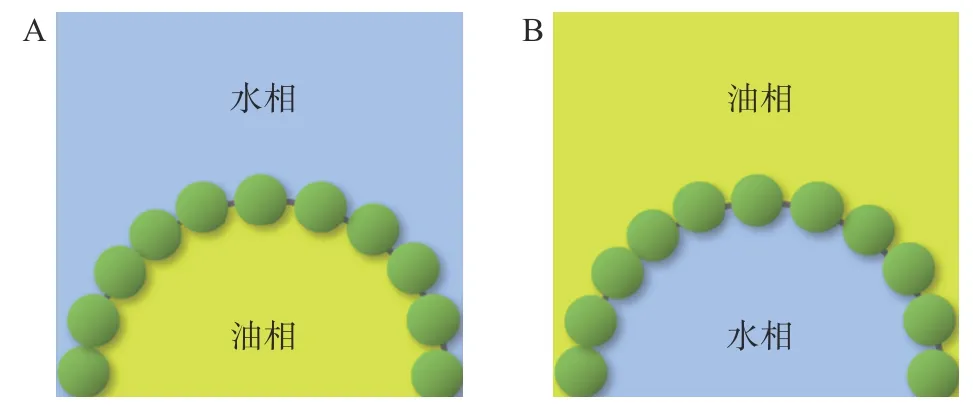
图2 Pickering 乳液结构示意图Fig.2 Structure of the Pickering emulsions
1.1 界面膜稳定机制
Pickering 乳液的界面膜稳定机制指出,乳液的稳定依赖固体粒子吸附在两相形成界面处所形成的物理屏障,使分隔的乳滴不可并聚[40]。固体粒子能够不可逆地以单层或多层的形式紧密吸附于油水界面,所形成的界面膜包裹油滴,有效阻止了乳滴间的碰撞和絮凝[41]。同时,界面膜中的固体粒子进一步增大了乳滴间的静电斥力,二者共同作用于稳定乳液,维持Pickering 乳液的长期稳定。纤维素较之于传统的固体粒子拥有更高的长径比,其形态更趋近于细长棒状[42-43]。如图3 所示,棒状粒子能有序地平行排布于油水界面,因此相同颗粒量的棒状粒子可以更大面积地包裹乳液液滴[44]。大量研究证实,长径比较高的纳米纤维素能够减少其在界面膜的堆积,有助于提高乳液的稳定性[45-46]。

图3 粒子形态对乳液的影响Fig.3 Effects of the particle morphology on the emulsions
1.2 三维粘弹粒子网络稳定机制
Pickering 乳液的三维粘弹粒子网络稳定机制认为,稳定乳液的固体粒子可以在连续相中形成3D 桥联网络环绕在乳滴周围,通过空间位阻效应使乳滴嵌入其中并固定,防止乳滴因聚集而导致的絮凝作用[41]。纤维素纳米晶在Pickering 乳液中可以通过范德华力形成桥联网络,环绕乳滴提供空间位阻稳定乳液[47]。杆状的纤维素纳米晶可以在两相界面上弯曲,使粒子之间的结构发生重组和交联,形成粘弹网络[48]。与此同时,形变过程中围绕粒子产生的毛细管力则进一步增加了Pickering 乳液的稳定性。此外,固体粒子增加了乳液连续相的黏度,使得液滴沉降速率下降,纤维素乳液的稳定性大大提高[49-50]。
除Pickering 乳液之外,部分研究针对纤维素进行亲水改性,通过降低油水界面的张力,成功稳定了传统乳液。与传统乳液相比,Pickering 乳液中的界面膜与三维网络能够进一步增加载体乳液稳定性,使其在生物活性物质的封装保护及运载释放中更具优势。有鉴于此,在纤维素稳定的生物活性物质载体中,乳液的稳定性亦可以通过纤维素的结构设计进行调控。
2 稳定乳液载体的纤维素类型
近年来,关于纤维素乳液稳定性表征的研究取得了较大进展,为生物活性物质载体的构建提供了坚实的理论研究基础。结合纤维素乳液的界面膜和三维粘弹粒子网络稳定机制,研究者往往对稳定乳液的纤维素材料进行一定程度的物理化学改性,以期获得最佳的界面润湿特性[51-52]。如表1 所示,在相关研究的报道中,改性纤维素及纳米纤维素材料在乳液载体系统的稳定中发挥重要作用。

表1 改性纤维素材料及纳米纤维素材料作为乳液载体稳定剂的特点Table 1 Properties of modified cellulose and nanocellulose materials as stabilizers for emulsion system
2.1 改性纤维素材料
纤维素表面丰富的羟基具有较高的反应活性,为其化学改性创造了丰富的可能,进一步扩大了纤维素作为生物活性物质载体材料的应用范围[53-54]。如图4 所示,对纤维素进行酯化、硅烷化,氧化及聚合物接枝等反应,能够使所构建的乳液获得温度敏感,pH 响应等控释特性[54-56]。
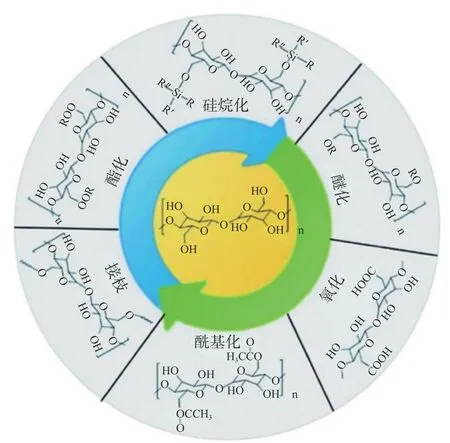
图4 纤维素化学修饰方法示意图[56]Fig.4 Methods of the chemical modification on cellulose[56]
乙基纤维素和醋酸丁酸纤维素均为不溶于水的改性纤维素材料,二者通常以固体粒子的形式分布于乳液分散相中,稳定Pickering 乳液。乙基纤维素分别以1.0%,1.5%,2.0%和2.5%(w/w)的质量分数分散在水相中,稳定内相比为0.2 的水包油(oil in water,O/W)型虾青素乳液[57]。而在利用醋酸丁酸纤维素与负载茶碱的环己烷混合构建乳液中[58],茶碱微球可以通过乳液进一步制备,该方法所得到的微球中封装率可达64.71%。
羧甲基纤维素由纤维素进行亲水表面改性制备,在水中具有良好的溶解性,是研究中广泛应用的乳液稳定剂。在西米羧甲基纤维素稳定的红棕榈油乳液中[59],12.5%(w/w)羧甲基纤维素制备的乳液具有良好的稳定性,可以生产负载22.8%(w/w)红棕榈油的载油凝珠。应用凤凰木(Delonix regia)的果荚分离天然纤维素,并在酸性条件下分别将其改性获得羧甲基纤维素和醋酸纤维素,三种纤维素在乳液中均能够以1.0%(w/w)的质量分数稳定内相比为0.5的维生素A 的载体体系[60],其中羧甲基纤维素稳定的乳液在自然pH 下的稳定性高于天然纤维素和醋酸纤维素,证实了纤维素表面改性对乳液体系稳定性的影响。
2.2 纳米纤维素材料
作为稳定乳液的粒子,纤维素材料的长径比也是实现载体控释的重要因素之一[61]。在改性纤维素材料的研究日趋成熟的基础上,具有更高长径比的纳米纤维素材料在近年来获得了更多关注。采用物理或化学方法对纤维素进行处理,令其某一维度的尺寸减小到100 nm 以内,即获得纳米纤维素[23]。来源于生物的纳米纤维素主要包括细长柔软呈缠绕状的纤维素纳米纤丝(nanofibrillated cellulose,cellulose nanofiber,cellulose nanofibri 或nanofibrillar cellulose),棒状或须状的纤维素纳米晶体(nanocrystalline cellulose,cellulose nanocrystals 或nanocrystal of cellulose)和细菌中分离获得的细菌纳米纤维素三大类[62-64],相关的纳米纤维素乳液已经逐步应用于食品中。
如表1 所示,纤维素纳米纤丝稳定的乳液被证实可以提高对油相的负载量,并且具有良好的稳定性。从刺棒棕(Bactris gasipaes)中分离的纤维素纳米纤丝具有纵横比高的纳米纤维素典型特性,研究证实其可应用于稳定鳄梨油乳液[65]。与传统的非纳米纤维素相比,该纤维素纳米纤丝能够以1.0%低质量分数实现较高的脂质负载效率,揭示了体系在不同温度和pH 下对负载生物活性物质的保护作用。
纤维素纳米晶体在乳液中的添加量对乳液稳定性具有重要影响。由不同添加量的硬木纤维素纳米晶体构建的大麻(Cannabis sativaL.)籽油乳液稳定性有所差异[66],相似的脂质载体也可以通过芦笋(Asparagus officinalisL.)纤维素纳米晶体稳定的棕榈油乳液构建[67]。该结果阐明了纤维素纳米晶体质量分数对乳液稳定性的显著影响,支持了纤维素乳液的界面膜稳定机制。
细菌纤维素乳液载体的研究也在逐步深入的过程中,由Komagataeibacter sucrofermentansDSM 15973 经静态发酵获得细菌纳米纤维素稳定了肉桂(Cinnamomum zeylanicum)精油乳液[52]。该研究证实了以0.4%(w/w)的质量分数的细菌纳米纤维素可以稳定内相比0.2%~3.1%(v/w)的肉桂精油乳液,揭示了来源于细菌的纤维素纳米材料具有植物纤维素相似的载体稳定作用。
目前,由纳米纤维素稳定的乳液已被广泛研究,但针对其乳液载体的研究尚浅。纤维素纳米纤丝、纤维素纳米晶体和细菌纳米纤维素的不同结构对其稳定乳液载体的影响尚未明确。深入研究二者间的构效关系,对于生物活性物质载体的开发具有重要意义。纤维素材料具有优良的表面特性和较高的乳液稳定性,有助于满足不同特性的生物活性物质的递送需求,为乳液载体的定制化设计提供了一类有潜力的材料。
3 纤维素基乳液体系负载的主要生物活性物质
部分生物活性物质在水中溶解性差,在生产加工和储存的过程中大多容易分解和氧化[68-70]。当功能性成分随食物进入人体后,还存在易被胃酸分解,生物利用度较低的局限性,成为制约其发展和应用的关键科学问题。随着生物活性物质载体研究的逐步深入,纤维素乳液包封被公认为是解决上述问题的有效途径之一。
3.1 酚类化合物
酚类化合物具有较高的抗氧化活性,其抗病毒、抗变异及抑制肿瘤活性等功能已被大量研究证实。然而,酚类物质在食品加工过程中极易氧化降解。基于此,对于部分难溶于水或脂溶性的酚类物质,将其搭载于纤维素基乳液载体中,可以大大提高其在食品介质中的溶解度,提高其氧化稳定性的同时也可以增加酚类物质在人体的吸收利用率。
纤维素乳液系统被证实可以有效抑制酚类物质的氧化降解。最新研究证实,未经纤维素乳液包埋的游离姜黄素在pH7.2 的缓冲溶液中30 min 内降解率超过85%,而包封在纤维素乳液中的姜黄素表现出良好的稳定性,在储存30 d 后降解率低于50%[6,71]。此外,姜黄素也已经成功地在纤维素基乳液中实现与多种化合物的共搭载。姜黄素与香豆素被证实可以共同搭载于胺化纳米纤维素稳定的乳液,其中,香豆素和姜黄素的包封率大于90%[72],乳液的释放动力学曲线显示二者的持续释放增加了其生物利用度,搭载姜黄素与香豆素的乳液在体外抗肿瘤和抗菌实验中使细胞毒性减弱,该研究证实乳液的负载可以提高二者的生物利用度。
较强的抗氧化活性是酚类物质的重要特性之一,研究结果表明,纤维素基乳液系统的界面膜包封有助于保护酚类物质的抗氧化活性。二氢杨梅素属于多酚黄酮类物质,因其具有较强的抗氧化活性,在食品中普遍用于防止脂质氧化[73]。二醛纤维素纳米晶体稳定的乳液保护了二氢杨梅素的抗氧化活性,因此,利用乳液制备基于明胶基质的活性可食用薄膜具有较强的紫外线阻隔能力、高透明度、良好的耐水性、良好的机械性能和有效的抗氧化活性[74]。
在保护酚类物质免于氧化降解的同时,纤维素基乳液系统还可以抑制其在胃部消化过程中的降解,并显著影响功能因子的释放过程[75]。将芒果(mangifera indicaL.)皮酚类提取物搭载于羧甲基纤维素钠稳定的水包油包水型乳液的内水相中[76],在模拟胃部消化的前40 min,羧甲基纤维素钠会因物理或空间位阻而减缓脂肪分解反应,导致含有羧甲基纤维素钠的乳液脂质消化速度明显慢于对照组,证实了纤维素乳液体系对酚类物质降解的抑制作用。
3.2 维生素与类胡萝卜素
维生素及类胡萝卜素组分不仅在水中分散性差,光照、温度及pH 的不稳定均会对其活性造成负面影响。因此,纤维素乳液体系可以根据维生素及类胡萝卜素对改善分散性,抑制高温降解,保护生物活性及在释放中提高生物利用度等需求,设计不同的负载方案。
维生素A 在利用凤凰木(Delonix regia)羧甲基纤维素和醋酸纤维素稳定乳液中的包封率可达65.45%[60,77]。包封水溶性维生素C 的羧甲基纤维素微乳液载体也在最新的研究中被成功构建,可以在4、25 和40 ℃的温度下稳定储存三周以上,证实了纤维素乳液在温度影响下的高度稳定性,有利于实现维生素C 的包埋[78]。虾青素作为类胡萝卜素成分之一,其抗氧化活性超过玉米黄素、叶黄素等其他类胡萝卜素10 倍以上[79]。通过连续超临界乳液提取法在乙基纤维素载体中负载虾青素,保护虾青素强大抗氧化活力的同时实现了高达84%的封装效率[57]。以上研究均证实,棒状结构的纤维素制备的乳液具有优异的乳液稳定性,可以实现对生物活性物质的封装与保护。
在提供高度稳定包封载体的同时,纤维素乳液体系还可以显著影响维生素在肠道中的释放。乙基纤维素乳液制备的微胶囊递送载体可以应用于抑制叶酸在胃酶消化中的释放和降解[78],并在肠道中释放以供给人体吸收。随着乙基纤维素浓度从7.5%(w/v)减小到2.5%(w/v),叶酸释放率从40%增加至52%,最高可达79%,证明微胶囊的特性和体外释放曲线与乳液中乙基纤维素的浓度具有相关性。
研究证实,纤维素可以通过调节乳液的界面特性实现维生素与类胡萝卜素的封装及释放。同时,调节系统中纤维素质量分数可以有效改善活性物质的生物利用率。
3.3 脂质
乳液载体对脂质的负载方式通常是直接将其作为乳液的分散相,O/W 型纤维素乳液可以有效封装脂质。纤维素乳液体系对红棕榈油、茶树(Melaleuca alternifolia)油、金枪鱼油或薄荷(Mentha piperita)油有较高包封效率,依次为22.8%[59]、90.4%[80]、91.48%和93.19%(w/w)[81]。
纤维素乳液体系不仅可以提高酚类物质的抗氧化稳定性,对脂质也具有相似的保护作用。硫酸铵纤维素纳米晶体乳液中橄榄油质量分数为0.1wt%时,油相抗氧化活性最好,为44.94%[82],并且随着乳液中硫酸铵纤维素纳米晶体浓度的增加,油相的抗氧化活性也随之增加,证实了纤维素基乳液载体对脂质氧化的保护作用。
综上,大量研究结果证实,纤维素稳定的乳液可以有效地提高脂质、酚类物质、维生素及类胡萝卜素的氧化稳定性,改善茶碱生物利用度,并在消化过程中防止上述生物活性物质的降解,实现功能因子在肠道中的释放。因此,纤维素乳液是一种极具开发潜力的生物活性物质载体,可以针对不同生物活性物的特性及应用需求,定制最佳的释放策略。
4 乳液中影响生物活性物质释放的主要因素
纤维素在乳液中吸附在油水界面形成致密界面膜以及粘弹性的三维网络,在进一步增加乳液稳定性的同时,也可以通过较高的长径比控制乳滴内部的功能因子释放,进而提高所负载生物活性物质的利用率。如图5 所示,当体系随食物组分被人体摄入后,或在一定的环境因素影响下,乳液系统可以有效释放其负载的生物活性物质。根据乳液体系释放功能因子机制的不同,大体可以将其划分为缓释和控释两大系统。
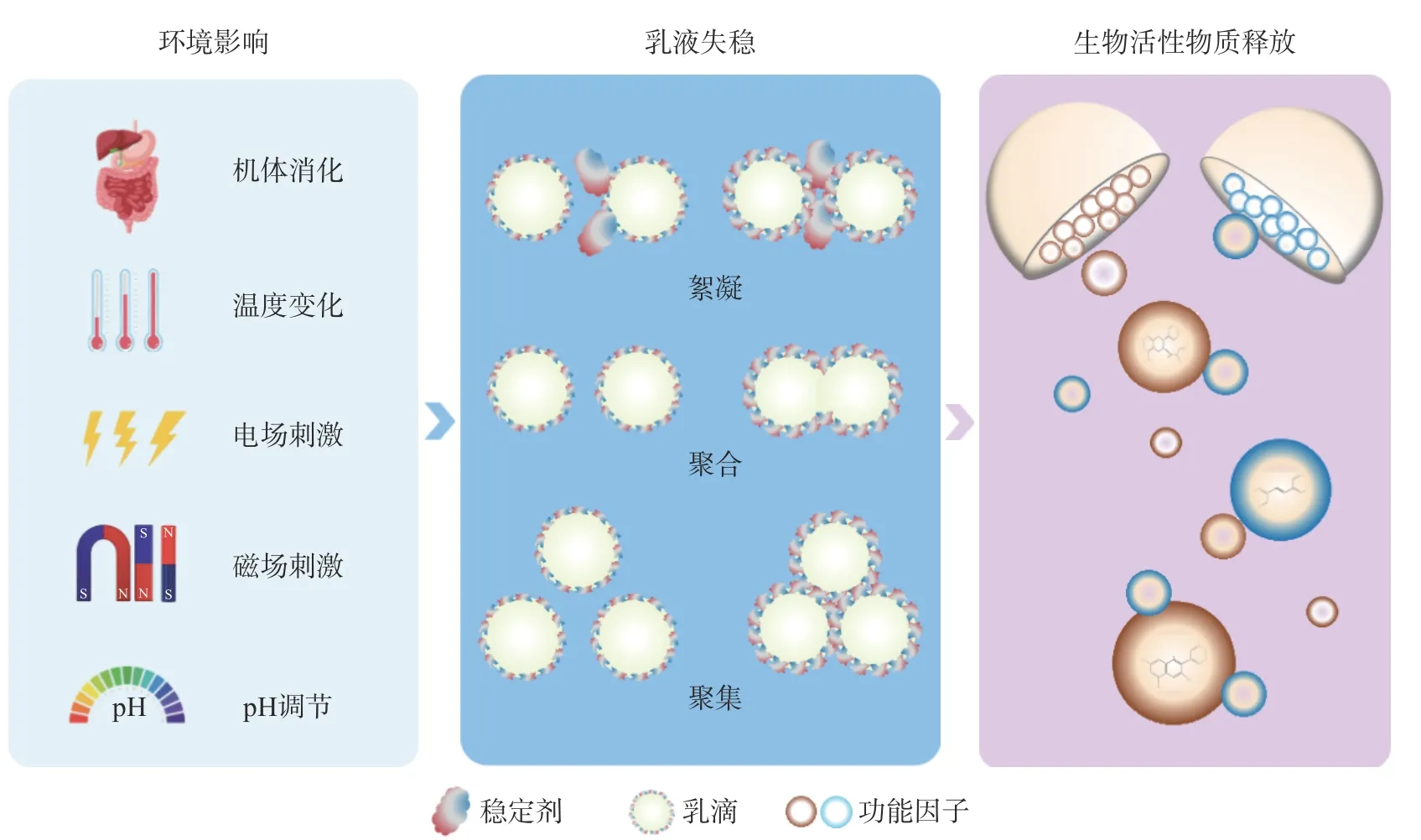
图5 乳液系统中生物活性物质的释放示意图Fig.5 Release effect of bioactive substances in emulsion system
4.1 缓释系统
生物活性物质的缓释系统是指载体在进入人体后,能够以受控的速率长效释放所负载的功能因子的体系[83]。在纤维素乳液的缓释系统中,由乳滴作为该体系的载体,通过将活性物质封装其中实现活性保护和可控释放。因而影响纤维素乳液系统缓释作用的因素主要源自于内部功能因子的扩散,以及外部乳液的破乳两个方面。在研究中,纤维素界面膜特性、乳滴粒径及体系粘度均被证实对载体的扩散和破乳具有显著影响。
根据乳液的界面膜稳定机制,界面膜厚度的增加可以改善功能因子的保留系数,控制功能因子在载体系统中的扩散,影响体系缓释效果。在乳清蛋白与多糖复合物稳定原花青素乳液中释放动力学的研究中,释放速率被证实与界面膜的厚度显著相关[68]。乳液的界面膜厚度由0.6 nm 增加至4.2 nm 过程中,乳液中原花青素的释放速率常数显著减小。该结果支持内部扩散影响乳液载体缓释作用的假设,提出了通过调控界面膜厚度控制系统缓释作用的新策略。
乳滴的粒径与界面膜的厚度息息相关。在纤维素稳定的乳液体系中,乳滴的粒径在影响乳液载体稳定性的同时,也对其负载的生物活性物质的缓释过程具有调控作用[84]。以O/W 型纤维素乳液为例,在功能因子从油相传递到水相的分子传质过程中,其传质效率受到传质路径,即乳滴粒径的影响。然而,尽管有大量研究对乳滴粒径与功能因子释放的相关性进行了报道,对于二者间的构效关系仍未得到一致的结论。部分研究认为,粒径较小的乳滴因其较小的比表面积以及乳滴中心到界面较短距离,促进功能因子的快速传质及释放[85];而另一部分研究则认为,粒径较小且比表面积较大的乳滴会导致其界面吸附的粒子更多,即界面膜增厚,进而降低功能因子的传质效率[68]。因此,乳滴粒径对其释放系统的影响机制有待进一步研究证实,二者的构效关系可能与其负载的生物活性物质的特性有关。
乳液的流变学特性也是影响生物活性物质缓释的主要因素之一,主要体现为乳液的表观粘度对功能因子释放的影响。Stoke-Einstein 方程定义了粒子在粘性流体中的扩散系数(D)的与体系粘度关系,如下式所示:
其中,k 为波尔兹曼常数;T 为绝对温度;η为粘度;d 为粒子流体力学直径。由该公式可知,乳液载体中功能因子的扩散系数与乳液的粘度成反比,即乳液粘度的增加会在一定程度上抑制其负载功能因子的扩散。纤维素乳液体系中生物活性物质的扩散系数较小,进一步提升了该系统对生物活性物质的包封效果的同时,也对其释放效果提出了新的挑战。在最新的报道中,研究通过对纤维素进行表面修饰,可以赋予载体刺激-响应的控释特性,使载体能够在指定的环境、时间和位点中靶向释放其所负载的功能因子。因此,改性纤维素在载体控释作用中占有重要地位,可以有效提升乳液体系在释放过程中的可控性与精准性。
4.2 控释系统
乳液系统的控释作用在功能性食品开发、药物递送和封装细胞的移植等领域具有重要意义。如图5 所示,乳液载体中应用的智能环境响应型材料可以通过pH(图6A)、电场(图6B)或磁场(图6C)等外部环境刺激,对其负载生物活性物质的释放时间、释放速率或释放位点进行调节。这种靶向递送的特异性极大地拓展了乳液载体系统的应用价值。目前,乳液载体的控释体系已成为药物递送领域的热点研究对象。然而,以纤维素基乳液为主体的控释系统研究极少见于报道。
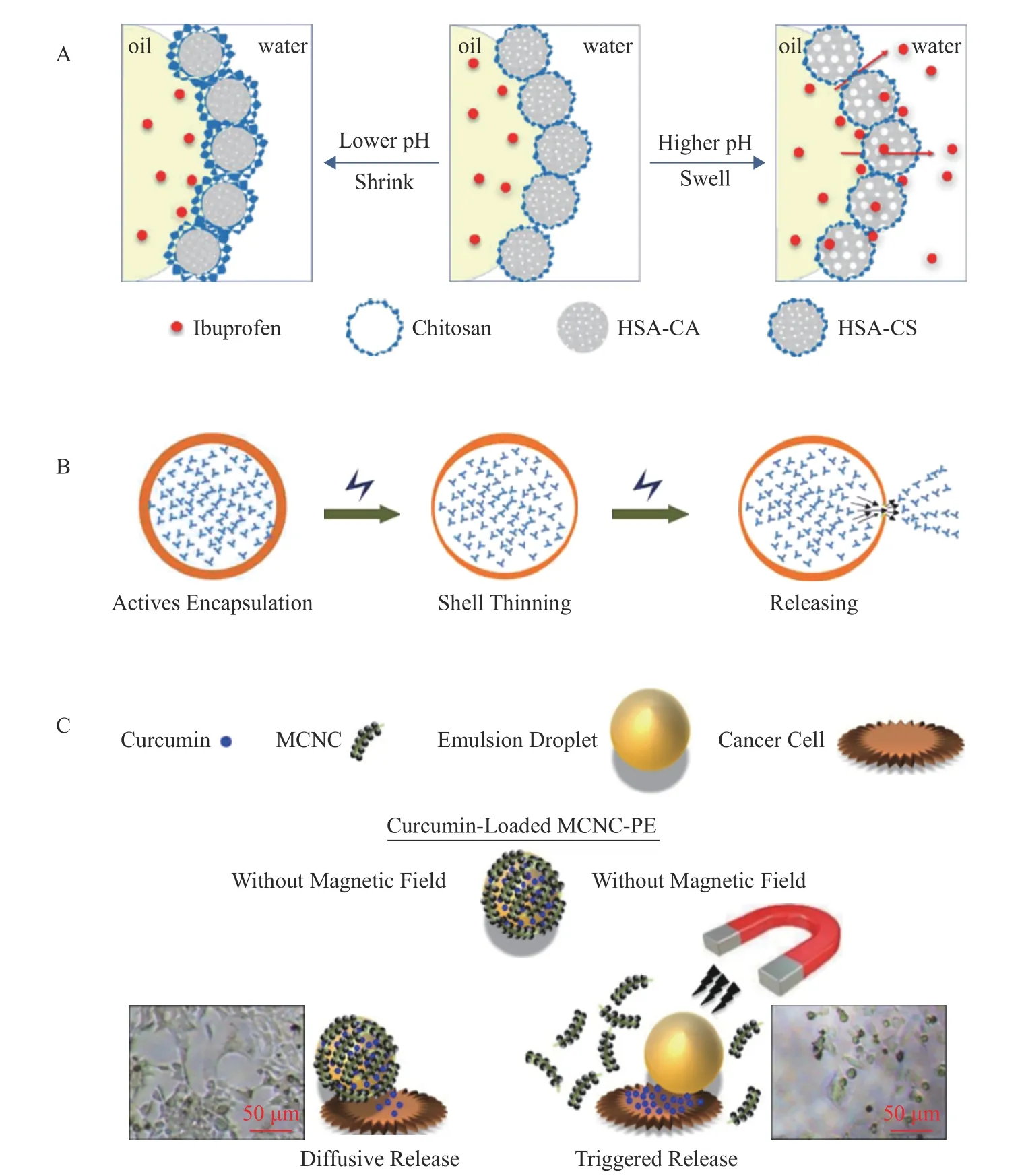
图6 pH、电场及磁场控释的乳液体系作用机制示意图Fig.6 Schematic diagrams of release mechanism of the pH,electrical or magnetic-controlled emulsion systems
由Fe3O4@纤维素纳米晶稳定的具有pH 和磁性双重响应性的乳液控释体系突破了纤维素乳液控释载体的空白[45],其通过对纤维素纳米晶体进行表面修饰,从而提高了其表面疏水性,进而实现通过改变外部刺激条件(pH3.0~13.0)调节乳液的稳定。相关研究利用上述乳液体系对姜黄素进行负载,并考察了其在体外抗结肠癌领域中的应用[45]。结果证实0.7 T 的外部磁场可以刺激乳液载体释放姜黄素,释放量可达其初始负载量的53.30%,该研究为后续纤维素乳液控释载体的开发奠定了坚实的理论基础。
尽管纤维素乳液在生物活性物质的释放方面表现出优秀的潜力,但相关研究仍处于初级阶段。目前仅有的研究报道大多集中在药物缓释领域,将其应用于功能性食品领域的研究少之又少。针对纤维素与所负载的生物活性物质的构效关系研究及控释系统中响应性纤维素材料开发鲜有报道。同时,纤维素乳液体系在食品呈味物质的包埋、不良风味的掩盖以及热敏性食物组分的加工等方面仍有很大的挖掘空间。因此,为实现针对特定功能因子的体系定制化设计,纤维素乳液体系中生物活性物质的释放机制仍需进一步研究。
5 结论与展望
为了积极响应国家建设资源节约型、环境友好型社会的奋斗目标,公众对于自然、环保和可持续食品的需求日益增长。纤维素基乳液载体因其高度的稳定性、负载能力和控释功能,已被广泛用于多种生物活性物质的包封和递送,以期改善食品中功能组分活性及其与食物基质的相容性。综合当前的研究报道,纤维素乳液有望成为生物活性物质递送体系的理想载体。研究表明,纤维素稳定的乳液载体可以在改善活性组分的分散性及氧化稳定性的同时,控制其负载功能因子的释放,进一步提高活性组分的生物利用度。当前,关于纤维素基乳液作为生物活性物质载体的理论研究方兴未艾,在取得大量研究成果的同时,也存在一定的局限性。在乳液的相关研究领域,阐明生物活性物质的释放机制,并评价其在食品体系中的安全性等方面还存在广阔的研究空间。未来的研究应侧重于乳液载体构建的产业化,以弥合实验室与市场之间的差距,为相关食品、药品及包装材料的不断发展提供科技支撑。

