玉米ZmBT2b 基因在抵抗禾谷镰孢侵染中的功能研究
周 帆,杨 喆,崔婷茹,刘鹏飞,王永桂,曹宏哲,张 康,邢继红,董金皋
(1.河北省植物生理与分子病理学重点实验室/河北农业大学 生命科学学院,河北 保定 071000;2.保定市农业农村局,河北 保定 071000;3.河北省保定市气象局,河北 保定 071000)
近年来,随着农业结构模式的调整以及全球气候等外界因素的变化,玉米茎腐病的发生也持续加重[1]。玉米茎腐病的主要病原菌为禾谷镰孢(Fusarium graminearum),该病原菌主要侵染玉米的茎基部,引起玉米根系、茎基部软腐,果穗下垂,严重时整株枯黄倒伏[2-3]。玉米茎腐病是世界玉米产区普遍发生的一种土传病害[3],在上世纪初首次被美国报道,在2014 年美国和加拿大的安大略省的产量损失就超过了95 亿kg[4]。玉米茎腐病于2013年至2015 年在我国的东北地区广泛传播,黄淮海地区在2014 年和2017 年爆发,2016 年山西北部到甘肃西部的玉米茎腐病十分严重。玉米茎腐病的田间发病率一般在15%~20%,通常会使玉米减产约10.0%,在严重情况下减产可达到30.0%~50.0%[5]。因此,挖掘抗病基因,明确其在玉米抗病过程中的功能与机制,为玉米抗病育种提供理论依据。
BTB/POZ(BR-C, ttk and bab or pox virus and zinc finger)家族蛋白在植物的生长发育、植物抗病过程中起着非常重要的调控作用[4]。BTB-TAZ蛋白的N 端具有BTB/POZ 结构域,C 末端具有CaMBD 结构域和TAZ 结构域[6]。其中,BTB 结构域在进化上高度保守,广泛存在于从酵母到人类的各个物种中,在胞质分裂、维持细胞骨架功能和细胞周期调控等重要生理过程中都起着重要作用[7]。拟南芥BTB-TAZ 蛋白AtBT1、AtBT2、AtBT4 在拟南芥生长发育以及应激反应中发挥重要调控作用[4],其中AtBT2 能够介导拟南芥对各种激素、胁迫和代谢条件的响应,AtBT4 参与SA 和JA/ET 信号途径的调控,在拟南芥对灰葡萄孢(Botrytis cinerea)和丁香假单胞菌(Pst.DC3000)的抗性过程中发挥重要作用。甘薯BTB-TAZ 蛋白IbBT4 通过增强BR信号通路和脯氨酸生物合成以及激活ROS 清除系统,进而增强转基因拟南芥的抗旱性。苹果BTBTAZ 蛋白MdBT2 通过调节MYC2 和JAZ2 的稳定性来负调控JA,触发叶片衰老[8]。
目前,玉米BTB-TAZ 蛋白的功能与调控机制研究尚未见报道。本研究拟利用生物信息学技术,对玉米BTB-TAZ 蛋白ZmBT2b 进行系统分析,明确其在在玉米不同组织、不同发育阶段以及响应生物和非生物胁迫下的表达规律。构建ZmBT2b基因过表达的拟南芥突变体ZmBT2b-OE,通过检测突变体ZmBT2b-OE 对灰葡萄孢和Pst.DC3000 的抗病性,分析其在植物抗病过程中的功能,获得了玉米ZmBT2b突变体,通过检测突变体对禾谷镰孢的抗性,明确其在玉米抵抗禾谷镰孢侵染过程中的功能,为阐明玉米BTB-TAZ 蛋白在玉米抗病过程中的功能及其调控机制奠定基础,并为玉米抗病育种提供了基因资源。
1 材料和方法
1.1 试验材料
玉米(Zea mays)自交系B73 种子、拟南芥Col-0 野生型(Arabidopsis thaliana)、拟南芥突变体Atbt2(SALK_151981C)、禾谷镰孢(Fusarium graminearum)菌株PH-1、Pst.DC300、灰葡萄孢(Botrytis cinerea)由河北省植物生理与分子病理学重点实验室保存并提供。玉米ZmBT2b的EMS 突变体购买于中国农业科学院生物技术研究所。
1.2 玉米ZmBT2b 基因的鉴定
在MaizeGDB 数 据 库(https://www.maizegdb.org/)获得玉米ZmBT2b基因的DNA 序列和氨基 酸 序 列;利 用NCBI Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对ZmBT2b的 氨 基 酸 序 列进行比对,获得13 个不同物种的氨基酸序列;使用Clustal X 软件对氨基酸序列进行比对[9];利用软件MEGA 7.0 进行序列比对,并使用邻近法(Neighbor-joiningmethod,NJ)进行系统进化分析,bootstrap 设 为1000;利 用SMART(http://smart.embl-heidelberg.de/)进行结构域的组成分析;利用geneDoc2.7(https://genedoc.software.informer.com/2.7)进行基因同源性绘制。
1.3 玉米ZmBT2b 基因的表达规律分析
利用NCBI(https://www.ncbi.nlm.nih.gov/)中的SRA 数据库(Sequence Read Archive),下载玉米的不同组织(根、茎、叶、雄穗、花药、花粉、穗轴、花柱、胚珠、胚、胚乳、种子)、禾谷镰孢(Fusarium graminearum)侵染的RNA-seq 数据,将RNA-seq序列比对到玉米的参考基因组上;使用Cufflinks(http://cole-trapnell-lab.github.io/cufflinks/)软件,通过基因长度和读取数量标准化参数计算基因的表达值FPKM(Fragments Per Kilobase of exon per Million fragments mapped reads);最后绘制系统进化树、保守结构域和基因组织表达分析图。
1.4 玉米ZmBT2b 过表达拟南芥植株的构建
利用Gateway 技术,构建ZmBT2b-103 表达载体;利用农杆菌介导的遗传转化方法,将ZmBT2b-103载体转化拟南芥野生型Col-0,获得纯合的ZmBT2b-OE 株系。利用PCR 和qRT-PCR 对转基因植株进行鉴定,qRT-PCR 按照2× M5 HiPer SYBR Premix EsTaq 说明书配置,内参为Tublin4。qRT-PCR 按照2× M5 HiPer SYBR Premix EsTaq 说明书配置,内参为Tubulin。PCR 反应 体 系:Template DNA 2 µL;2×M5 HiPer SYBR Premix EsTaq(with Tli RNaseH)10 µL;Primer 1(10 μmol/L)0.4 µL;Primer 2(10 μmol/L)0.4 µL;ROX Reference Dye(50×)or ROX Reference Dye II(50×)0.4 µL;ddH2O 6.8 µL。程序设置为95 ℃ 15 s,56 ℃ 20 s,72 ℃ 45 s,42 个循环。每个qRT-PCR 单独重复3 次。
1.5 玉米ZmBT2b 过表达拟南芥植株的抗病性分析
选取长势一致的拟南芥野生型(WT)、突变体Atbt2(SALK_151981C)和 过 表 达(ZmBT2b-OE)植株,分别接种灰葡萄孢的分生孢子悬浮液(2×105个/mL)和Pst.DC3000(OD600=0.01),接种后黑暗保湿培养24 h,观察叶片的发病情况。使 用ImageJ 软 件(https://imagej.nih.gov/ij/)对 灰葡萄孢的病斑面积进行分析,接种Pst.DC3000 的叶片进行病原菌CFU 值的分析,试验重复3 次,使用GraphPadPrism9 软 件(https://www.graphpad.com/)计算重复的标准差(standard deviation,SD),并进 行t检 验(Student’s t-test)分 析,当P<0.05 时具有统计学差异)。
1.6 玉米Zmbt2b 突变体的鉴定
利用EMS 诱变的玉米B73 全基因组突变体 库(Maize EMS induced Mutant Database,MEMD),获得了ZmBT2b基因的突变体EMS3-03b810(Zmbt2b-1)、EMS3-03b813(Zmbt2b-2)。以玉米自交系B73 和ZmBT2b突变体的DNA 为模板,利用基因特异性引物进行DNA 水平鉴定。选取玉米自交系B73 和纯合突变体植株,提取RNA 并反转录合成cDNA,使用基因特异性引物(表1),对突变植株进行RNA 水平鉴定。

表1 引物列表Table 1 Primers list
1.7 玉米Zmbt2b 突变体的抗病性分析
待玉米B73 及突变体生长至10 叶期时,在茎杆节间处进行穿刺接种禾谷镰孢的分生孢子悬浮液(106个/mL),每个节间注射接种100 µL,接种处理的植株黑暗保湿24 h 后,正常条件下培养。使用ImageJ 进行病斑面积的测量。试验重复3 次,使用GraphPadPrism9 软件计算重复的标准差(Standard deviation,SD),并进行t检验(Student’s t-test)分析,当P<0.05 时认为具有统计学差异。
1.8 玉米Zmbt2b 突变体接种禾谷镰孢后ZmLOXs和ZmPRs 表达分析
提取被禾谷镰孢菌侵染后0 和72 h 的6 叶期B73 和纯合突变体玉米植株茎秆样品的总RNA,使用M5 Sprint qPCR RT kit with gDNA remover 进行反转录合成cDNA。使用ZmLOXs、ZmPRs特异性引物(表1),以禾谷镰孢侵染后的自交系B73 和玉米ZmBT2bEMS 突变体植株的cDNA 为模板,检测JA 合成途径相关基因ZmLOXs的相对表达量。qRT-PCR 按照 2× M5 HiPer SYBR Premix EsTaq 说明书配置,内参为UBQ1。
2 结果与分析
2.1 玉米ZmBT2b 基因的生物信息学鉴定
将ZmBT2b的氨基酸序列与13 个物种的同源氨基酸序列进行系统进化分析发现,玉米ZmBT2b与拟南芥AtBT2 同源,与SbBT1 和AhBT1 的亲缘关系最近(图1A)。ZmBT2b及其同源蛋白都含有BTB 和TAZ 结构域(图1A)。通过对同源基因进行序列比对,发现它们具有较高的同源性(图1B)。

图1 ZmBT2b 的系统进化分析Fig.1 Phylogenetic analysis of ZmBT2b
2.2 玉米ZmBT2b 基因的表达规律分析
为了探究玉米ZmBT2b在玉米生长发育以及抵抗生物和非生物胁迫中的功能,本研究利用SRA数据库对ZmBT2b基因在玉米31 个组织中的表达量、非生物胁迫和生物胁迫(禾谷镰孢侵染)下的表达规律进行了分析。结果发现,ZmBT2b基因在不同组织中呈现出不同的表达规律,具有一定的时序性和特异性,在V9 期的8 叶和13 叶期表达水平较高,其他的生长发育时期表达水平普遍较低(图2A)。ZmBT2b在不同胁迫条件下表达水平表现明显的差异,在紫外线胁迫中表达量最高,在盐胁迫下表达量最低(图2B)。禾谷镰孢侵染后,玉米ZmBT2b基因表达水平呈上调趋势(图2C),说明玉米ZmBT2b基因有可能在玉米抵抗病原菌侵染中发挥调控作用。

图2 ZmBT2b 的表达规律分析Fig.2 Analysis of the expression pattern of ZmBT2b
2.3 ZmBT2b 过表达拟南芥对灰葡萄孢和Pst.DC3000 的抗性
为了探讨ZmBT2b基因在植物抗病过程中的功能,本研究获得了拟南芥AtBT2 基因的T-DNA 插入突变体Atbt2(SALK_151981C),并构建了玉米ZmBT2b基因的拟南芥过表达植株ZmBT2b-OE(图3A、B)。对拟南芥WT、突变体Atbt2和ZmBT2b-OE 植株接种灰葡萄孢和Pst.DC3000,结果发现,接种灰葡萄孢后所有接菌叶片均出现水渍状态感病病斑,其中,ZmBT2b-OE 植株的病斑面积最小,突变体Atbt2的病斑面积最大(图3C、D)。接种Pst.DC3000 后突变体Atbt2的症状较为明显,而WT 和ZmBT2b-OE 植株植株的症状较轻(图3E)。对接菌叶片进行病原菌CFU 值的测定,发现突变体Atbt2的病原菌含量最高,而ZmBT2b-OE 植株的值最低(图3F)。这些结果表明玉米ZmBT2b基因的表达提高了拟南芥对灰葡萄孢和Pst.DC3000 的抗性。
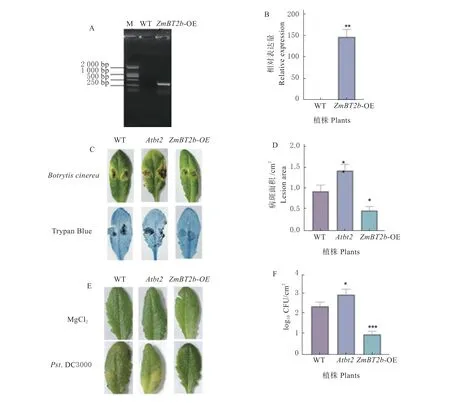
图3 ZmBT2b 拟南芥过表达植株的构建及抗病性鉴定Fig.3 Construction of ZmBT2b Arabidopsis overexpression plants and identification of disease resistance
2.4 玉米Zmbt2b 突变体对禾谷镰孢侵染的抗性降低
为进一步验证ZmBT2b基因在玉米抵抗病原菌侵染过程中的功能,本研究从中国农科院玉米EMS 诱变突变体库中获得了ZmBT2b基因的EMS突 变 体Zmbt2b-1 和Zmbt2b-2,突 变 体Zmbt2b-1和Zmbt2b-2 均是BTB 结构域上的点突变,其中Zmbt2b-1 中甘氨酸GCC 变为丙氨酸ACC,Zmbt2b-2 中精氨酸CGG 突变为色氨酸TGG。突变体Zmbt2b-1 和Zmbt2b-2 中ZmBT2b基因的表达水平显著低于野生型B73(图4A、B)。对玉米自交系B73 和突变体Zmbt2b-1、Zmbt2b-2 的茎部接种禾谷镰孢。结果发现,突变体接种禾谷镰孢后的症状明显重于野生型,病斑面积显著大于野生型B73(图4)。表明ZmBT2b基因突变体对禾谷镰孢的敏感性增强,说明ZmBT2b基因在玉米抵抗禾谷镰孢侵染过程中发挥重要的作用。
2.5 玉米Zmbt2b 突变体中ZmLOXs 和ZmPRs 的表达分析
利用qRT-PCR 技术,对突变体Zmbt2b-1 和Zmbt2b-2 以及野生型B73 在禾谷镰孢侵染过程中ZmLOXs和ZmPRs基因的表达水平进行分析。结果发现,在接菌0 h 时,ZmLOXs基因的表达量均明显高于野生型B73,随着病菌的侵染,ZmLOXs基因的表达量均显著低于野生型B73(图5)。
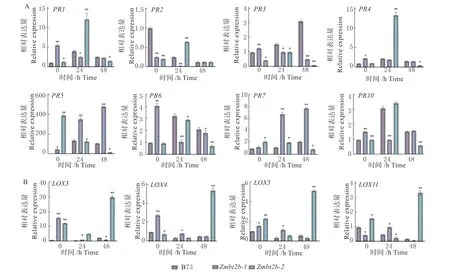
图5 Zmbt2b-1 和Zmbt2b-2 接种禾谷镰孢后抗病相关基因表达量分析Fig.5 Expression analysis of disease resistance related in genes in Zmbt2b-1 and Zmbt2b-2 after inoculation of Fusarium graminearum
在接种禾谷镰孢0 h 时,Zmbt2b突变体中ZmPR5、ZmPR6、ZmPR10表达水平显著高于野生型B73,其余所有的ZmPRs表达水平均低于B73。在接种禾谷镰孢24 和72 h 后,突变体Zmbt2b-1和Zmbt2b-2 中大部分ZmPRs表达水平显著低于野生型。这一结果说明玉米ZmBT2b基因突变影响了ZmLOXs和ZmPRs基因的表达。
3 结论与讨论
BTB-TAZ 亚家族作为植物特有的转录因子,目前已经发现在拟南芥、水稻、大豆和苹果的生长发育以及抗逆过程中发挥重要作用。然而,ZmBT2b基因在玉米中的功能尚未见相关研究报道。本研究采用生物信息学方法确定了玉米ZmBT2b具有BTB和TAZ 结构域,与拟南芥AtBT2 同源,ZmBT2b基因在禾谷镰孢侵染过程中上调表达,推测其与玉米抵抗病原菌侵染过程中具有功能。本研究发现,ZmBT2b基因过表达拟南芥对灰葡萄孢和Pst.DC3000 的抗性增强,玉米Zmbt2b突变体对禾谷镰孢侵染的抗性降低,表明ZmBT2b基因在抗病过程中发挥重要作用。
在植物体内具有多条抗病通路,可以通过不同的病原物激活相应的反应信号,进而调控对应的抗病途径[10]。病程相关蛋白(PRs)是一类与植物过敏反应、信号转导和植物系统获得性抗性关系十分密切的一类蛋白,是植物天然防御系统的重要组成[11-12]。大部分PRs 蛋白都有共同的抗真菌活性[13-14]。通常在未侵染的组织中存在的含量极低,当病原菌侵染植物时,植株体内PRs基因表达大量上调抵御病原菌的侵染,在感染组织中极易被检测到[15],从而维持植物的正常生长发育。水杨酸(SA)是植物体内产生的酚类化合物中的一种,参与多种调节代谢途径,其最重要作用是植物防御病原菌侵染,SA 的生物合成是病程相关蛋白发挥作用和植物自身获得抗性不可缺少的[16]。脂氧合酶(Lipoxygenase,LOX)属于氧化还原酶,是JA合成途径中的关键酶,广泛参与植物的生长、发育以及应对生物和非生物胁迫,为抵御病虫害的侵染植物会通过提升其体内的JAs 含量激活下游防御基因的表达[17]。番茄被烟草花叶病毒感染后,体内的SlPR-1b基因被强烈激活[18]。花生和可可树的PR10基因对2 种植物抵抗真菌侵染至关重要[19]。AtBT4基因参与拟南芥对丁香假单胞菌(Pst.DC3000)的防卫反应,AtPRs基因的强烈表达大大增强寄主对Pst.DC3000 的免疫力[20]。玉米ZmPRs基因在抵抗病原菌侵染的过程中也发挥十分重要的作用[21]。本研究发现,玉米突变体Zmbt2b-1、Zmbt2b-2 中ZmPRs和ZmLOXs基因在禾谷镰孢侵染过程中显著下调,表明ZmBT2b通过调控JA、SA信号途径关键基因ZmPRs和ZmLOXs表达参与植物抵御病原菌的侵染。

