TCS1等位基因的差异表达参与弄岛野茶低咖啡碱的形成
刘玉飞 庞丹丹 陈春林 田易萍 孙云南 李友勇 陈林波


关键词:弄岛野茶;特异资源;TCS1;生物合成
茶树富含咖啡碱、可可碱、茶叶碱等多种嘌呤生物碱,其中咖啡碱(2.5%~4.5%)是其含量较高并且较常见的嘌呤生物碱[1]。咖啡碱具有兴奋、提高大脑记忆力和识别能力等多种对人体有利的生理功能[2],但过量的摄入会使敏感人群出现失眠[3],并且有可能引起骨质疏松和流产等不利反应[4-5]。因此,低(无)咖啡碱茶以及相关的茶制品(咖啡碱含量低于1%)受到了有特殊需求消费群体的喜爱[6]。目前常用的脱咖啡碱技术主要有溶剂萃取、物理吸附法、生物降解法以及培育低咖啡因茶树品种等[7-8],其中低咖啡碱茶树育种是实现茶叶低(无)咖啡碱最经济、安全和有效的方法[8]。咖啡碱代谢途径的解析以及低咖啡碱特异茶树资源的鉴定有利于茶树低咖啡碱育种工作的开展。
咖啡碱的生物合成途径已经明确,其可以通过从头合成嘌呤环,然后再合成咖啡碱,也可以利用已有的嘌呤类化合物为基础进行合成。NEGISHI等[9]根据同位素示踪研究,提出了茶树咖啡碱生物合成的核心途径,即以黄嘌呤核苷(xanthosine,XR)为底物,经7-甲基黄嘌呤核苷、7-甲基黄嘌呤和可可碱等中间产物而合成,合成途径涉及N-甲基转移酶类(N-methyltransferases,NMTs)、N-甲基核苷酶和S-腺苷-L-甲硫氨酸合成酶(S-adenosyl-L-methioninesynthetase,SAMS)。咖啡碱的合成涉及到多种酶类基因,如SAMS(AB041534)[10]、TIDH(inosine-5'-monophosphatedehydrogenase,EU106658)[11]和咖啡碱合成酶TCS(caffeinesynthase,AB031280)[12]等。
TCS是茶树咖啡碱代谢最为关键的基因,属于NMT家族,KATO等[12]通过克隆获得了茶树第一个NMT,茶树咖啡碱合成酶基因TCS1,接着YONEYAMA等[13]在茶树中克隆与TCS1序列相似大于89%的TCS2(AB031281),随后金基强等[14]根据TCS1序列从茶树基因组中克隆得到4种TCS基因(TCS3~TCS6)。前期的功能鉴定与进化分析结果表明,TCS1是咖啡碱合成途径中的关键基因,对茶树合成咖啡碱最为重要[12-14]。多项研究表明TCS1具有多种等位变异,现已报道8种TCS1的等位基因,分别命名为TCS1a~TCS1g和TCS1i,其中TCS1a、TCS1b、TCS1c与之前克隆的TCS1、ICS1、PCS1序列相同[15-17]。前期的进化分析以及酶学实验表明TCS1的不同等位变异可以分为2类,一类仅具有可可碱合成酶活性(TCS1b、TCS1c、TCS1g和TCS1i);另一类同时具有可可碱和咖啡碱合成酶活性(TCS1a、TCS1d、TCS1e和TCS1f)[15,17]。
本课题组前期从国家大叶茶树资源圃(勐海)筛选获得1份低咖啡碱、高可可碱茶树种质——弄岛野茶(MHLC),然而,MHLC低咖啡碱、高可可碱的形成原因尚不清楚。因此,本研究通过对MHLC和云抗10号(YK10,对照品种)不同季节以及MHLC不同部位嘌呤生物碱的含量进行分析,明确MHLC中的化学成分,并通过基因型鉴定和基因表达量分析初步解析MHLC低咖啡碱的形成机制。
1材料与方法
1.1材料
采摘弄島野茶(MHLC)、云抗10号(YK10)(图1)春、夏、秋的一芽二叶(春季:3月27日;夏季:7月10日;秋季:10月27日),并收集MHLC新梢不同成熟度叶片和茎的样品(采于10月27日),微波固样2min,然后80℃烘至足干,一部分用于生化成分的测定,另一部分液氮固样,并置于–80℃冰箱用于后期RNA的提取。
1.2方法
1.2.1化学组分提取与测定准确称取0.1g(精确到0.001)样品,加入10mL70%的甲醇溶液,摇匀,然后70℃水浴10min,期间摇匀2次,提取结束后7000r/min离心1min,取上清液过0.45μm有机滤膜,用HPLC测定样品中的生物碱,具体方法参见JIN等[15]的研究。
1.2.2实时荧光定量PCR以茶树GAPDH基因作为内参基因测定MHLC和YK10中嘌呤生物碱关键基因SAMS、TIDH和TCS的表达量,其中SAMS、TIDH分别是N-甲基核苷酶和S-腺苷-L-甲硫氨酸合成酶基因、肌苷-5′-单磷酸脱氢酶基因;TCS1-CS、TCS1-TS、TCS1-Total分别是表达蛋白同时具有可可碱、咖啡碱合成酶(caffeinesynthase,CS)活性的等位变异、表达蛋白仅具有可可碱合成酶(theobrominesynthase,TS)活性的等位变异以及TCS1整体表达水平的引物。引物序列来源于JIN等[15]的研究(表1),RT-qPCR具体方法参照PANG等[18]的研究。
1.2.3TCS1等位变异cDNA全长的克隆利用TCS1(TCS1a,AB031280)的序列设计引物克隆不同样品中的TCS1基因,具体的基因克隆方法见PANG等[18]的研究。利用ClustalW(https://www.genome.jp/tools-bin/clustalw)在线软件进行序列比对,并利用EXPASY中的BoxShade(https://embnet.vital-it.ch/software/BOX_form.html)输出同源比对的结果。
2结果与分析
2.1不同季节化学组分含量
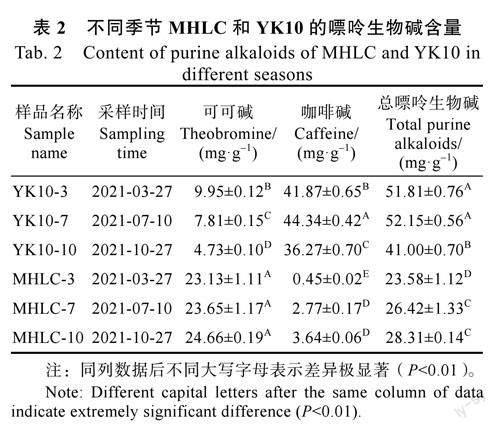
MHLC和对照品种YK10三个季节(春、夏、秋)的可可碱与咖啡碱测定结果显示,MHLC与YK10的嘌呤生物碱的总量和各组分含量均存在显著差异(表2)。MHLC生物碱总量和咖啡碱含量均显著低于YK10,其中咖啡碱含量不足YK10的九分之一,但是其可可碱含量要高于YK10;MHLC中含量最高嘌呤生物碱是可可碱(大于23.00mg/g),其次是咖啡碱(小于4.00mg/g),而YK10与之相反。另外,春季到秋季MHLC中的可可碱和咖啡碱含量均有增加的趋势,但是除春季MHLC的咖啡碱极显著低外,其他差异均未达到极显著水平;而YK10中的可可碱则一直降低,咖啡碱先升高后降低。
2.2MHLC不同组织化学组分含量
为了明确MHLC嘌呤生物碱不同发育阶段的变化规律,本研究测定了MHLC芽(MHLC-B)、不同发育阶段的叶片(芽下第一片叶子用MHLC-1L表示,其它依次类推)和茎(芽至第一片叶子之间的茎用MHLC-1S表示,第一片叶子至第二片叶子之间的茎用MHLC-2S表示,其它依次类推)的嘌呤生物碱。结果显示,MHLC芽中具有最高的可可碱(32.16mg/g)和咖啡碱(6.14mg/g)含量,同一发育阶段叶片中可可碱和咖啡碱含量高于茎,另外,随着叶片和茎成熟度的增加,可可碱、咖啡碱以及嘌呤生物碱总量均逐渐下降(图2)。
2.3咖啡碱合成酶基因的克隆
根据TCS1(TCS1a,AB031280)的基因序列设计引物,成功从MHLC和YK10中克隆得到TCS1基因的编码区全长。在YK10中克隆到1个TCS1的等位变异,命名为YK10_TCS1,其与TCS1a(具有可可碱和咖啡碱合成酶活性)有3个核苷酸的差异,虽然它们引起了编码氨基酸残基的变化,但是均不影响TCS的保守基序和关键活性位点。在MHLC中克隆得到2种TCS1的等位变异,分别命名为MHLC_TCS1b和MHLC_TCS1d。其中MHLC_TCS1b与已经报道的仅具有可可碱合成酶活性的TCS1b(AB056108)虽然有3个核苷酸的差异,但是编码蛋白序列完全相同;MHLC_TCS1d与已经报道的具有可可碱和咖啡碱合成酶活性的TCS1d(KT215399),有1个核苷酸的差异,并且引起编码氨基酸残基的变化,但并不影响TCS的保守基序和关键活性位点(图3)。
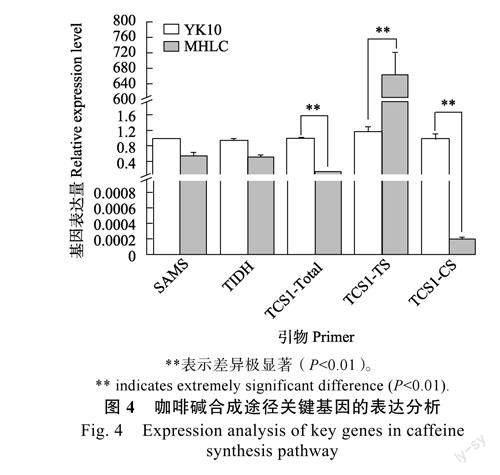
2.4咖啡碱合成途径关键基因的表达分析
3讨论
我国具有丰富的茶树资源,低咖啡碱茶树资源已在广东[19]、福建[16,20]、四川[6]、云南[21-22]等多个省份发现。已报道的云南省低咖啡碱茶树来源于文山壮族苗族自治州[21]、西双版纳傣族自治州[22-23]以及昭通市[24],本研究报道的低咖啡碱(不足4.00mg/g)和高可可碱(大于23.00mg/g)的弄岛野茶(MHLC)来源于云南省德宏傣族景颇族自治州瑞丽市,是该地区首次报道的低咖啡碱茶树资源。瑞丽市MHLC为低(无)咖啡碱茶树育种提供了可利用的亲本材料,并扩大了筛选低咖啡碱茶树资源的区域。
MHLC中可可碱和咖啡碱由春季到秋季均有增加的趋势,但除春季咖啡碱显著低外,可可碱或咖啡碱不同季节间的差异均未达到极显著水平;而YK10中可可碱从春季到秋季则一直降低,咖啡碱先升高后降低。这说明不同茶树种质资源,咖啡碱和可可碱不同季节间的变化趋势有所差异,李金[25]对25个茶树品种的研究结果也指出,不同品种在不同季节咖啡碱和可可碱的变化趋势具有一定的差异,这可能与茶树品种自身的调控和代谢机制相关。茶树中咖啡碱和可可碱主要分布在幼嫩部位,其中在新梢部分的分布最为集中,越老化的叶片含量越少[16,26-27]。MHLC中咖啡碱和可可碱在不同成熟度叶片和茎中的分布规律与之前的结果一致,也是在幼嫩的部位含量较高。
本研究发现,MHLC中含有2种TCS1等位变异基因:MHLC_TCS1b和MHLC_TCS1d。其中MHLC_TCS1b与已经报道的TCS1b[15](AB056108,仅具有可可碱合成酶活性)编码蛋白序列基本完全相同;虽然MHLC_TCS1d与TCS1d[15-16](KT215399,同时具有可可碱和咖啡碱合成酶活性)的编码蛋白序列有1个氨基酸残基的差异,但是并不影响NMT保守基序和TCS的关键活性位点,推测MHLC_TCS1d与TCS1d具有相似的功能。以上分析可知,MHLC同时具有TS活性和CS活性的TCS1等位变异。基因表达量分析发现,MHLC_TCS1b在MHLC中的表達量很高,这与MHLC相比YK10在芽叶中积累较多的可可碱相符;而MHLC_TCS1d在MHLC中表达量极低(不足YK10中TCS1d基因表达量的1/4800),很可能是MHLC低咖啡碱含量的一个主要原因。JIN等[15]和刘玉飞等[28]的研究均表明TCS1不同等位变异的启动子序列存在显著差异,但MHLC_TCS1d的低表达是否由启动子序列变异引起还需进一步研究。

