双重血浆分子吸附系统模式治疗高原慢性肝衰竭患者的效果分析
王博文,彭梦佳,江历恒,方 斐,王宇亮,沈元弟,2
1 西藏军区总医院重症医学中心,拉萨 850000
2 海军特色医学中心急诊科,上海 200000
慢性肝衰竭(chronic liver failure,CHF)是指在各种原因导致的肝硬化的基础上,以反复出现腹水和肝性脑病为临床特点的严重肝功能失代偿综合征[1-2]。CHF 患者肝功能严重受损,体内积聚的胆红素和中大分子毒素引发的全身多脏器损伤是造成其高死亡率的重要因素之一[3-4]。肝移植是CHF 最重要的治疗方法,但是受到供体数量,医疗成本以及技术要求的限制,很难在临床上广泛开展[5]。人工肝通过体外循环装置,暂时性部分替代肝脏功能,从而达到协助治疗CHF的目的。人工肝在肝衰竭的治疗中已经取得了肯定的疗效[6]。目前临床上常用的人工肝模式包括血浆置换、血液灌流和双重血浆分子吸附系统(double plasma molecular absorption system,DPMAS)等[7-8]。
高原地区具有海拔高、气压低、氧含量低的气候特点。移居高原人群的血流动力学和心肝肺功能均会出现不同程度的生理改变以实现高原习服[9-10]。因此,对于移居高原的CHF患者可能会受到高原环境和肝衰竭的双重打击,从而进一步加重肝脏负担,降低DPMAS 的治疗效果[11]。然而,目前尚没有关于DPMAS 治疗移居高原CHF患者临床效果的研究。本研究旨在比较世居高原患者和移居高原患者的基线资料、DPMAS治疗前后的临床特征,以及生存率,为高原CHF的治疗提供数据支持。
1 资料与方法
1.1 研究对象 收集2016 年1 月—2021 年12 月于西藏军区总医院重症监护室接受DPMAS 治疗的CHF 患者的临床资料。根据患者的旅居史将患者分为世居高原组和移居高原组:世居高原组定义为患者出生地海拔超过3 000 米,每年居住在海拔3 000 米以上高原不少于10 个月,且近6 个月内无海拔3 000 米以下旅居史;移居高原组定义为患者出生地海拔低于1 000 米,每年海拔3 000 米以上居住史不超过2 个月,近6 个月内移居海拔3 000 米以上高原且移居后无海拔3 000 米以下旅居史。CHF诊断标准参照《肝衰竭诊治指南(2018年版)》[1]。接受DPMAS治疗患者的适应证符合《人工肝血液净化技术临床应用专家共识(2022年版)》[7]。纳入标准:(1)年龄18~80 岁;(2)临床诊断为CHF;(3)患者进行DPMAS 治疗。排除标准:(1)有严重出血倾向;(2)对治疗过程中使用的肝素和鱼精蛋白等严重过敏;(3)疑诊或确诊肝癌;(4)合并其他恶性肿瘤;(5)合并其他脏器严重疾病;(6)失访或数据不全。
1.2 检测方法 门静脉内径和门静脉血流速度采用彩色多普勒超声诊断仪(GE LOGIQ)进行检测。肝硬度采用FibroScan检测仪进行检测,检测结果以“kPa”表示。
1.3 DPMAS 治疗方法 所有患者采用DPMAS 模式进行人工肝治疗。DPMAS 治疗机器选择费森尤斯透析机(德国费森尤斯集团),患者血液通过血浆分离器(德国费森尤斯集团,PUS2S),依次经过血浆胆红素吸附器(德国费森尤斯集团,BS330)和血液灌流器(德国费森尤斯集团,HA330-Ⅱ),与血细胞混合后回输患者体内。所有管路使用前排净空气并用肝素钠溶液预冲管路。治疗过程中血流速度设置为120~150 mL/min,分浆比设置为25%~30%;血浆分离速度设置为30~45 mL/min。根据患者的严重程度进行1~10次DPMAS治疗。
1.4 统计学方法 所有数据采用R 4.1.0 进行统计分析。数据的正态性检验采用Kolmogorov-Smirnov 检验。符合正态分布的计量资料采用表示,组间比较采用成组t检验;组内治疗前与治疗后比较采用配对t检验。非正态分布计量资料采用M(P25~P75)表示,组间比较采用Mann-WhitneyU检验;组内治疗前后比较采用Wilcoxon 符号秩和检验。计数资料组间比较采用χ2检验。Kaplan-Meier 法绘制生存曲线,死亡风险比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究共收集世居高原组患者29例和移居高原组患者34 例。移居高原组汉族比例明显多于世居高原组(P<0.001);世居高原组患者最近一次高原连续居住时间明显长于移居高原组(P<0.001);MELD评分、肝性脑病、肝肾综合征和消化道出血发生率均较世居高原组明显增高(P值均<0.05)(表1)。

表1 世居高原组和移居高原组的基线资料对比Table 1 Comparison of baseline between the high altitude native patients group and migrated patients group
2.2 两组患者DPMAS治疗前后临床数据比较 DPMAS治疗前后两组患者的PLT、HGB、ALT、AST、Alb、TBil、DBil、LDH、Cr、INR 比较差异均有统计学意义(P值均<0.05)。DPMAS 治疗前,移居高原组ALT、AST、TBil、DBil、LDH、Cr、BUN 和INR 均较世居高原组高(P值均<0.05),HGB较世居高原组低(P<0.05);DPMAS 治疗后,移居高原组患者PLT 和HGB 数量下降较世居高原组更为显著(P值均<0.05),但ALT、AST、TBil、DBil、LDH、BUN 和INR 均仍较世居高原组高(P值均<0.05)(表2)。
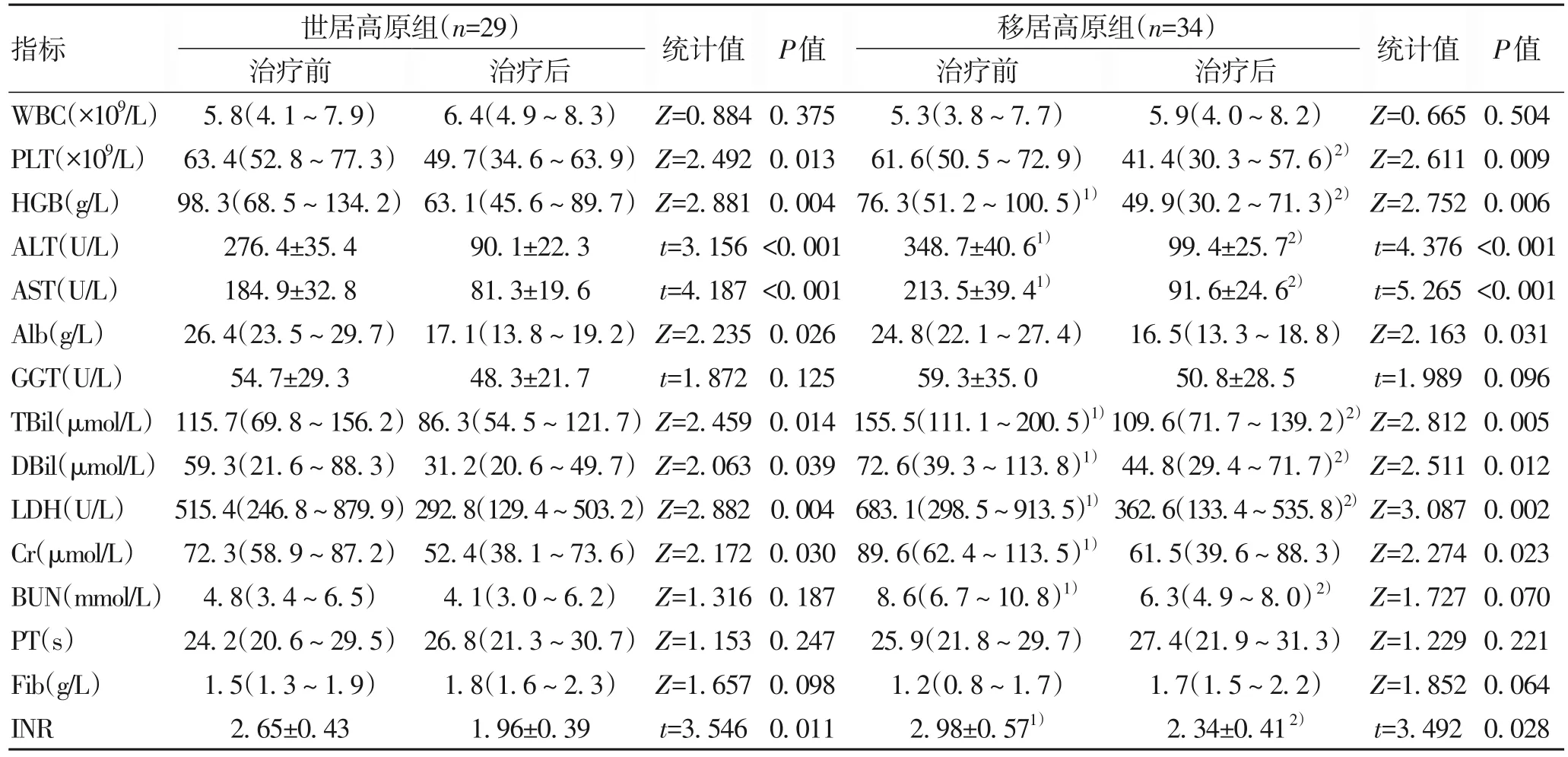
表2 世居高原组和移居高原组DPMAS治疗前后的临床特征对比Table 2 Comparison of clinical characteristics before and after DPMAS treatment between the high altitude native patients group and migrated patients group
2.3 两组患者生存曲线比较 经校正后,世居高原组和移居高原组患者接受DPMAS 治疗后60 天病死率分别为52.5%(95%CI:41.7~63.8)和81.3%(95%CI:77.9~85.6)。相比于世居高原组(HR=0.47,95%CI:0.23~0.95),移居高原组患者60天死亡风险(HR=2.14,95%CI:1.06~4.32)明显增加(P=0.039)(图1)。
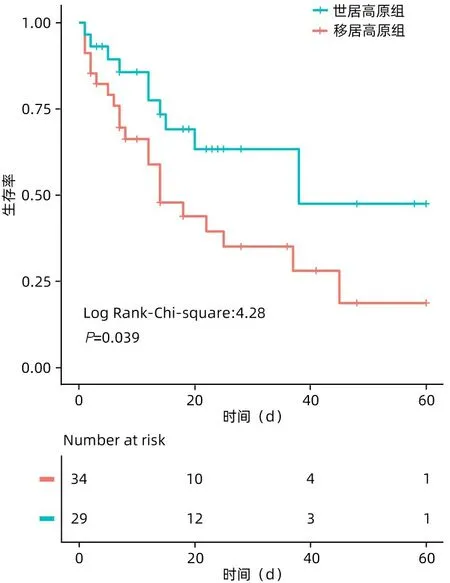
图1 世居高原组和移居高原组患者接受DPMAS治疗后的生存曲线Figure 1 Survival curves of high altitude native patients and migrated patients after receiving DPMAS treatment
3 讨论
CHF 是重症监护室常见的严重肝脏疾病,病死率极高[12]。CHF导致的高胆红素血症、肝性脑病和消化道出血等并发症,如果得不到及时有效救治可能直接威胁患者生命[13]。有研究[14]指出,TBil 水平是影响CHF 患者预后的独立危险因素。因此,快速清除体内淤积的胆红素可能是治疗CHF 的有效措施之一。人工肝系统通过将血液引流至生物膜,利用生物膜的化学吸附作用,将患者体内的有害物质清除,从而达到治疗目的[6,15]。DPMAS 系统将患者血浆依次通过血浆阴离子树脂胆红素吸附柱和中性大孔树脂吸附柱,清除血浆内大部分的胆红素和炎症介质,同时调节全身水电解质和酸碱平衡[6,16]。既往的研究[17]表明,DPMAS 比常规血浆置换对血浆中的胆红素吸附作用更强。本研究中,DPMAS治疗后,两组患者的胆红素水平和其他肝肾功能指标都有明显好转。因此应用DPMAS 作为CHF 患者降低血浆胆红素和炎症因子的姑息治疗策略值得推广。然而本研究也观察到,治疗后患者血常规指标进一步恶化,凝血水平无明显改善,这可能和DPMAS 系统无法及时补充新鲜血浆有关。前期的研究[18-20]发现,DPMAS 序贯血浆置换,既能明显改善患者凝血功能,又可以有效吸附胆红素,但是目前尚无高原治疗的循证医学证据。
高原高海拔环境严重影响肝脏功能。有研究[21]表明,高原缺氧环境可以诱发大鼠肝脏氧化产物代谢异常,从而导致肝功能代谢异常。长期的高原暴露影响肝脏细胞的脂肪代谢,引发血脂升高[22]。原大鼠肝脏会发生氧化应激反应而导致肝脏凝血因子合成受损和诱发出血[23]。高原移居汉族的门静脉直径和血流速度明显高于高原世居藏族[24]。本研究发现,相比于高原世居人群,移居高原CHF 患者的肝肾功能损伤更为严重。DPMAS 治疗后,肝肾功能指标改善程度依旧较高原世居人群更低。这些数据表明,患者的肝脏功能在高原氧习服和CHF 的“双重打击”下,肝脏负荷更重,也可能是导致高原移居患者高死亡率的原因之一。本研究发现两组患者治疗前均有不同程度的贫血,一方面患者前期长期的肝硬化和门静脉高压导致脾功能亢进,引起贫血;另一方面,部分患者合并消化道出血,慢性失血导致贫血。同时,观察到世居高原组在治疗前和治疗后Hb 指标均较移居高原组升高,这可能和世居高原组长期居住高原导致的高原红细胞增多相关[22,25]。
本研究所有入组患者整体病死率为49.2%。即使是积极进行综合的内科治疗,高原CHF 患者的病死率一直处于较高水平。研究[12]发现,出现CHF的重症患者28天病死率可以达到40%~60%,1年的病死率可以达到75%。截止目前,病毒性肝炎感染仍然是造成CHF 的主要病因[14]。有报道[14,26]指出,在我国和日本,HBV 感染作为主要病因引起肝衰竭的比例分别为41.5%和79.8%。同时,HBV感染引起的CHF病死率较其他病因明显增高[3]。在本研究中,HBV引起的CHF比例为69.8%。高原地区乙型肝炎高发可能和整体死亡率高有直接关系[27]。此外,本研究提示移居高原CHF患者的病死率明显高于世居高原人群,这也说明移居高原可能是高原地区CHF患者死亡的独立影响因素。因此,临床医护人员需要加强对移居高原人群的关注,采取更为积极的临床治疗措施,才能有效降低这类患者的死亡率。
目前非生物型人工肝的治疗模式有很多,DPMAS最大的特点在于可以快速清除患者体内的各种毒物、毒素,在一定程度上缩短病程,有效防止并发症的出现。相比于世居高原CHF 患者,移居高原CHF 患者产生的TBil等有毒代谢产物和TNF-α、IL-1 等炎症介质,进而增加了患者的病死率。DPMAS 可以吸附这些毒素和炎症因子,防止或者延缓全身炎症反应综合征和多器官功能障碍的发生[4,28]。
综上所述,与世居高原慢性肝衰竭患者相比,移居高原患者的肝损伤更重,DPMAS治疗后肝功能改善程度较弱,同时病死率更高。临床医护人员需要加强对移居高原慢性肝衰竭患者的重视,尽可能提高患者生存率。
伦理学声明:本研究经西藏军区总医院伦理委员会审查批准,批号:[2022]02-005。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:王博文、彭梦佳参与数据的收集分析和论文的撰写;江历恒、方斐参与数据的统计和分析;王宇亮、沈元弟参与研究的设计和论文的修改。

