多物质联用对磷石膏中磷的固定效果与机理分析
张晨燕,付甫刚,谭文超,杨艺琳,柳听义
1.天津师范大学,天津市水资源与水环境重点实验室
2.天津师范大学地理与环境科学学院
3.中国电建集团贵阳勘测设计研究院有限公司
在湿法磷酸的工业制备中,产生大量的固体副产物磷石膏,大部分磷石膏废渣仍采用堆存方法处理[1]。据不完全统计,2022 年我国磷石膏产量约7 300 万t[2],每年新增堆存量在4 500 万t 左右[3]。磷石膏随意堆放,一方面占用了大量土地资源[4];另一方面,长时间露天堆放,磷石膏中的可溶性磷等物质会被淋溶、浸泡出来[5],导致附近土壤和水环境遭受污染[6]。因此,解决堆场磷石膏废渣引发的环境问题已迫在眉睫。目前,对于磷石膏中磷的去除,传统方法主要有水洗净化、石灰中和、酸浸和煅烧等工艺[7],但这些方法存在诸多缺陷,如磷利用率低、环境风险大。生物除磷则利用聚磷菌和固磷植物的新陈代谢作用进行更新换代,不需要重复投加,并将磷以磷酸盐形式储存于生物体内,避免了二次污染。因此,相比传统方法,生物除磷具有较好的成本效益,且在原位应用方面存在较大优势[8]。虽然在高浓度含磷废水中,单一的微生物除磷效果较差,但结合其他方法能够提高磷的去除率。生石灰能够快速且有效地去除含磷废液中的磷,其作用机理是形成磷酸钙沉淀。除了去除工艺,磷石膏本身富含钙、磷和硫酸盐等元素[9],也可以通过添加其他微量元素制成专用复合肥,发挥其潜在价值[10],近年来以磷石膏制成的农业肥料已广泛应用于全球多个地区[11]。另一方面,在磷石膏堆场上,采取植被覆盖也是一种可行的修复方法[12],该方法有助于避免陈旧磷石膏粉尘造成的空气污染,也为磷石膏资源化提供了更为便捷的途径。
综上所述,笔者利用磷石膏的类土特性,提出了一种植物-微生物联合处理磷石膏的新方法。将适量的改性剂生石灰和土壤混合到磷石膏中,进行初步改性以中和其酸度并降低毒性,从而使其具备维持生物存活的适宜特性;通过在磷石膏堆场附近土壤中筛选富集的聚磷菌株与耐酸植物根部的协同作用,实现固磷效果,从而减弱堆场排放废水的酸性,最终解决磷石膏堆积区磷浸出浓度超标的问题。此外,以磷石膏为主体的原位处理效率大大提高,有助于改善传统处理方法的低效和潜在的环境风险,为磷石膏堆场生态复绿提供有效的解决途径。
1 材料与方法
1.1 试验材料
实验室土壤样品取自贵阳龙井湾磷石膏渣场,采样地原生土壤为亚热带酸性黄壤,在磷石膏的作用下土壤的理化性质及土壤微生物存活条件发生变化,自然筛选出具有固磷能力的微生物。
试验所用的菌种为磷石膏堆场土壤样品中富集筛选的4 种菌,即假单胞菌(Pseudomonassp.)、恶臭假单胞菌(Pseudomonas putida)、枯草芽孢杆菌(Bacillus subtilis)和伯克霍尔德菌(Burkholderia contaminans)。利用专有的富集培养基,对原始土样中的细菌进行富集筛选后,采用稀释涂布法对富集的菌种进行分离纯化。然后在纯化固体培养基上挑取单菌落加入到液体富磷培养基中,恒温(30 ℃、120 r/min)培养24 h,培养至菌种生长到对数期后,各取1 mL 的混合菌悬液加入含蛭石的富集培养基中,使菌种附着于载体上,在相同条件下培养48 h,保存备用。
有机肥采用动物粪便(主要为鸡粪和羊粪)与破碎处理的作物秸秆加水混合发酵,每3 d 翻动松料1 次,15 d 后发酵完成,保存备用。有效营养成分:总养分(氮+五氧化二磷+氧化钾)的质量分数(以烘干基计)为3.4%,有机质的质量分数(以烘干基计)为27.1%,挥发性有机酸浓度为37.5 cmol/kg。
生石灰购自天津汇之优实验设备有限公司,有效CaO 质量分数大于80%,干燥保存备用。
1.2 微生物筛选试验
称取土样3 g,过0.3 mm 筛,倒入含100 mL 富集培养基的三角瓶中[13],在30 ℃、120 r/min 的条件下振荡培养1~3 d,从浑浊的培养基中吸取8 mL 培养液,转移至另一个富集培养基中,振荡培养1~3 d,重复上述操作4 次,转移量分别为4、2、1、0.5 mL,且每次适当增加液体培养基中KH2PO4的量[14],依次为10、15、20、25、30、35 mg。将最终富集的菌悬液稀释1×102、1×103、1×104倍,在分离培养基中均匀涂布0.1 mL 不同稀释梯度的菌悬液,30 ℃恒温培养箱内培养2~3 d,对富集的菌种进行多次分离纯化,最后鉴定菌种的类型。
对富集的菌株进行除磷试验,测定菌种对磷石膏中磷的固定效果。配置磷石膏合成废液培养基,培养基成分:CH3COONa,0.68 g;蛋白胨,0.1 g;NaHCO3,0.01 g;Na2CO3,0.075 g;NaCl,0.05 g;MgSO4,0.075 g;CaCl2,0.025 g[15];去离子水1 000 mL。培养基采用高压蒸汽灭菌锅在120 ℃下灭菌20 min。分别将质量分数为1%、3%、6%、12%和18%的磷石膏加入灭菌培养基中充分混合,配置成磷石膏合成废液培养基,最后添加质量分数为3%的单菌液摇匀,30 ℃、120 r/min 条件下反应24 h。取上清液过0.45 μm 滤膜后测定总磷浓度,对比分析不同菌株的固磷率,选定具有高效固磷能力的菌种。
1.3 植物筛选试验
根据实际工程修复要求,在几种渣场生长良好的植物中选择羊茅属植物高羊茅为例进行试验,植物种子前期进行育种试验,观察茎叶长势、根系的发育情况及生长周期。试验前将干燥的种子浸泡在蒸馏水中于室温通风条件下水培24 h,播种深度为0.5 cm。
1.4 土柱中磷石膏、土、生石灰和有机肥的质量比试验
将3 份不同部位采集的湿润磷石膏样品离心,用注射器抽取磷石膏上清液10 mL,通过pH 计重复测量3 次,最后得出磷石膏浸出液pH 为1.4~1.6。将经过前处理的磷石膏与实地采集的土样混合,混合质量比分别为10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、0∶10,按比例称取土壤和磷石膏,倒入50 mL 离心管中摇匀,加入去离子水30 mL,恒温振荡1 h,3 000 r/min 离心5 min,注射器抽取上清液测pH。最后,确定磷石膏和土壤混合的几组优势组合后,再加入适量生石灰,在相同条件下振荡离心后抽取上清液测pH。将其pH 调至5~7。
在进行渗滤试验前,先进行试种试验,设置磷石膏∶土∶生石灰∶有机肥质量比分别为7∶3∶0.1∶0、7∶3∶0.1∶0.2、7∶3∶0.1∶0.4、7∶3∶0.2∶0、7∶3∶0.2∶0.2、7∶3∶0.2∶0.4、8∶2∶0.1∶0、8∶2∶0.1∶0.2、8∶2∶0.1∶0.4、8∶2∶0.2∶0、8∶2∶0.2∶0.2、8∶2∶0.2∶0.4,共12 组。每组均匀种植2 g 高羊茅种子,每24 h 加水20 mL,室温下观察高羊茅长势,根据高羊茅发芽率和平均株高选出几组优势组,确定最终渗滤土柱试验的混合比例。
1.5 渗滤土柱试验
磷石膏、土以及生石灰按一定质量比称取混合后,与已经配置的有机肥-微生物液体菌剂均匀混合(表1),放入高15 cm 的定制亚克力渗滤土柱装置中,其中所用菌种均为2 种聚磷菌1∶1 混合菌剂。高羊茅草籽均匀撒在每个渗滤土柱表层约0.5 cm 深处,保持基质水分为60%~80%。混合后首次浇水2 000~2 200 mL,水分缓慢渗透防止渗滤不均匀,之后日浇水量为50~100 mL,渗滤土柱底部设有渗滤口,用来收集渗滤液,每隔24 h 取样5~10 mL,过0.45 μm 滤膜后密封保存待测。在试验过程中,每间隔3 d 收集不经过滤的渗滤液和不同深度土样于离心管中,加入10 mL 蒸馏水振荡1 h 充分混合,3 000 r/min 离心5 min 后,取上层清液1 mL 稀释一定倍数,涂布于聚磷培养基上生长3 d,进行平板计数,统计试验过程中的活菌数。
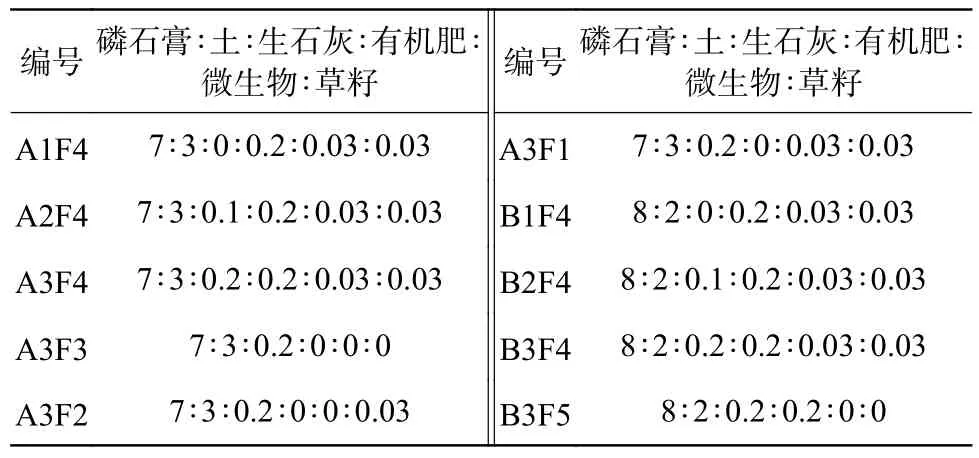
表1 磷石膏、土、生石灰、有机肥、微生物和草籽的混合质量比对照Table 1 Comparison of mixed mass ratio of phosphogypsum,soil,quicklime,organic fertilizer,microorganism and grass seeds
1.6 测定方法
采用HJ 670—2013《水质 磷酸盐和总磷的测定连续流动-钼酸铵分光光度法》[16]测定收集的渗滤液中总磷浓度,在AutoAnalyzer 3 连续流动化学分析仪上进行分析。
经过多次纯化的单菌落固体培养基样品送至北京六合华大基因科技有限公司进行菌种鉴定。使用细菌基因组DNA 提取试剂盒对待测菌株DNA 进行提取并扩增16S rDNA 序列片段[17]。用扩增出的单片段进行测序,在BLAST 数据库中比对分析确定序列来源,选取同源性比对结果中序列相似度在99%以上的相关属种[18],在MEGA 11 软件中构建系统发育进化树,确定细菌属种。
2 结果与分析
2.1 磷石膏、土壤、生石灰和有机肥的质量比确定
不同磷石膏与土壤质量比的试验组pH 如表2所示。从表2 可以看出7∶3、6∶4、5∶5 3 组pH 均在3.5 左右,可以初步提高磷石膏的pH,虽然6∶4、5∶5 2 组pH 在适宜范围,但在保证微生物和植物适宜存活的pH 下,尽可能选择磷石膏的质量比例高的组,来提高磷石膏的利用率,因此选择7∶3 组作为最优配比。8∶2 组pH 为2.7,略低于7∶3 组,但是单次处理的磷石膏量增加了10%,处理效率和成本更低,所以将8∶2 组作为对照组进行下一步试验。如表3 所示,磷石膏、土壤以及生石灰混合比例为7∶3∶0.1、7∶3∶0.2、8∶2∶0.1、8∶2∶0.2 的试验组,其pH 较为适宜(5~6)。选择上述4 种混合比例用作后续的渗滤土柱试验。

表2 不同比例磷石膏与土壤混合试验的pHTable 2 pH of a mixture test with different proportions of phosphogypsum and soil
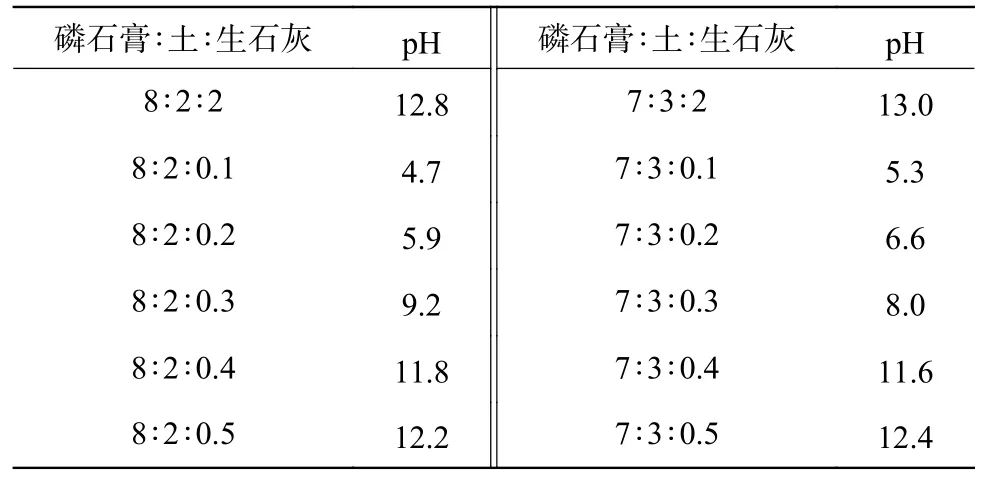
表3 不同比例磷石膏、土壤和生石灰混合试验的pHTable 3 pH of a mixture test with different proportions of phosphogypsum,soil and quicklime
2.2 菌种筛选
对磷石膏堆场的土壤富集驯化后,成功筛选出4 种聚磷菌,对基因测序结果进行NCBI-BLAST 比对,采用邻接法(neighbor-joining)构建系统发育进化树[19],将No.of Bootstrap Replications 参数设置为1 000 次,结果如图1~图4 所示。

图1 菌种P1 系统发育进化树Fig.1 Phylogenetic tree of strain P1
图2 菌种P2 系统发育进化树Fig.2 Phylogenetic tree of strain P2

图3 菌种P3 系统发育进化树Fig.3 Phylogenetic tree of strain P3

图4 菌种P4 系统发育进化树Fig.4 Phylogenetic tree of strain P4
如图5 所示,菌种P1 固体培养基的单菌落呈半透明态,表面光滑,圆形湿润,经鉴定是一种好氧聚磷菌——假单胞菌(Pseudomonassp.),属于革兰氏阴性杆菌,能够分解利用有机物作为能量来源。菌种P2 可存活的温度为4~42 ℃,最适生长温度为25~30 ℃,其陈旧培养物有腥臭味。通过菌种形态观察和系统发育进化树,菌种P2 鉴定为恶臭假单胞菌(Pseudomonas putida)。
菌种P3 菌落表面粗糙不透明,灰白色或黄色,菌落生长后期在固体培养基中呈干燥褶皱状。在系统发育树中与枯草芽孢杆菌(Bacillus subtilis)亲缘关系最近。菌种P4 菌落表面光滑,圆形凸起,呈淡黄色,通过系统发育进化树分析属于伯克霍尔德菌(Burkholderia contaminans)。
将4 种菌株进行除磷试验后发现所筛菌种均具有固磷能力,平均固磷率为80%,磷石膏添加量会影响到菌种对磷的固定程度。添加磷石膏质量分数为6%时,除枯草芽孢杆菌外其他菌种的固磷率达到了峰值。其中假单胞菌和恶臭假单胞菌的固磷率可达93.2%和94.3%(图6)。从整体的固磷率来看,假单胞菌和恶臭假单胞菌的固磷能力优于伯克霍尔德菌和枯草芽孢杆菌。经研究发现,从城市污水处理厂好氧池的活性污泥中分离出的一株恶臭假单胞菌GM6,其具有厌氧释磷、好氧吸磷的高效聚磷特性[20],在合成废水好氧条件下固磷率高达96.6%,充分证明了恶臭假单胞菌属具有较强的除磷特性,可作为优势菌种用于磷石膏中磷的固定。

图6 不同菌种的固磷率对比Fig.6 Comparison of phosphorus fixation rates among different strains
对渗滤土柱试验中不同时间段的渗滤液及土壤中聚磷菌数量的统计见表4。本试验筛选的菌株在混合土壤中存活量最高可达6.4×106cfu/mL,土壤中活菌数量整体比渗滤液高出2 个数量级且随时间呈稳定存活状态,在试验前期(0~3 d)、中期(4~9 d)、后期(10~12 d)3 个阶段中,每组渗滤液中活菌数量保持稳定或缓慢增长趋势。对比渗滤液活菌数发现,A 组的菌种存活数量整体高于B 组,说明磷石膏与土比例为7∶3 的组更利于菌种生长,经过前期富磷筛选后,聚磷菌对磷石膏的适应性较强,能够在土柱中稳定发挥固磷作用。

表4 土壤和渗滤液中活菌数量对比Table 4 Comparison of viable bacteria quantity in leachate and soil cfu/mL
2.3 植物筛选
通过育种试验发现,高羊茅室温下发芽时间为2~3 d,且根系发达,成活率高(图7)。通过调查研究发现结缕草、香根草也具有固磷能力,将高羊茅、结缕草和香根草种植在相同比例的土柱中观察三者长势,高羊茅在土柱中的长势更好且发芽率维持在90%以上,更适宜用于磷石膏中磷的去除。有研究表明,高羊茅覆盖的地下渗滤系统处理含磷废水过程中,高羊茅植株内含有的总磷浓度在4.6~5.9 g/kg,地下渗滤系统中其对磷的去除率可达30%[21]。一些菌类能帮助高羊茅有效利用土壤中难溶态磷(如Ca-P、A1-P)或矿化有机磷[22],从而促进植物对难溶态磷的吸收和利用,如丛枝菌根、内生真菌等。内生真菌可促进高羊茅对可溶性磷的利用,在水溶性磷条件下菌种对高羊茅地上部生长具有一定贡献。高羊茅还可作为降解植物与微生物联合修复柴油污染土壤[23]。结合育种分析,在本试验中高羊茅生长周期短、适应能力强、根系旺盛,可以作为磷超标土壤的修复植物。

图7 固磷植物长势对比Fig.7 Comparison of growth of phosphorus fixation plants
2.4 磷固定化效果
如图8 所示,随着生石灰的质量比增加,A1F4、A2F4、A3F4 这3 组磷的浸出浓度有较大幅度的下降,说明本试验中生石灰除了有调节pH 的作用外还有较好的固磷效果。当生石灰的质量比为2%时,A 组磷的浸出浓度均在4 mg/L 以下,达到了GB 18918—2002《城镇污水处理厂污染物排放标准》[24]中的三级标准,与未添加菌液的A3F3 和A3F2 组相比,添加液体菌剂的A3F4 和A3F1 组磷的浸出浓度更低,均在1 mg/L以下,达到了一级A 类标准,且效果更加稳定。从A3F4 和A3F1 2 组0~10 d 的数据来看,有机肥对微生物-植物的固磷能力影响不大,但从第10 天开始,添加有机肥后的磷浸出浓度更低,说明有机肥提供营养元素,维持微生物-植物长期稳定生长、固磷。而从整体上看,种植高羊茅会使磷的浸出浓度略有下降。

图8 磷石膏与土质量比为7∶3 组的磷浸出浓度对比Fig.8 Comparison of phosphorus leaching concentration in phosphogypsum to soil ratio 7∶3 group
从B 组的4 组试验(图9)分析得出,土柱中生石灰的质量比从0%增加到2%时,磷浸出浓度的降幅可达70 mg/L,由于生石灰能促进可溶磷转化为难溶物质,加入改性剂生石灰后,磷石膏中可溶磷得到有效降低,混合土柱的磷浸出浓度随着生石灰用量的增加而降低[25]。对试验数据进行线性拟合,发现当添加1%的生石灰时,磷浸出浓度的降幅最大且在后期可以降至10 mg/L 左右,可以作为初步处理方案。未添加微生物菌剂和植物的B3F5 组,磷的浸出浓度会随着时间推移而上升,说明单纯添加生石灰改良磷石膏,在长期处理中效果不好,处理不当可能对环境造成二次污染。
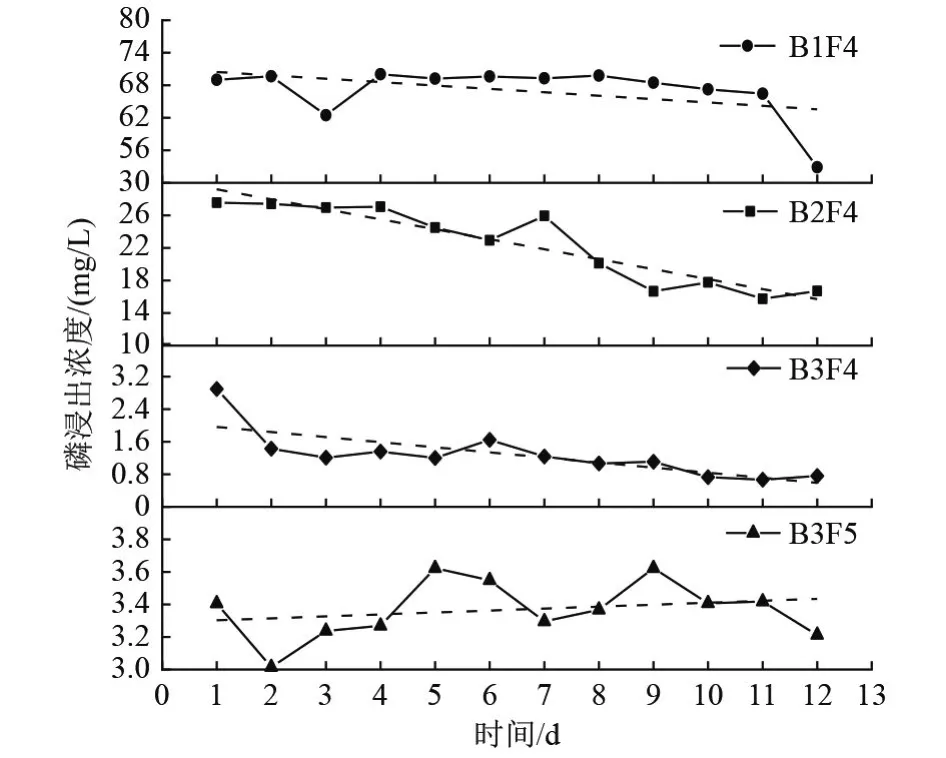
图9 磷石膏与土质量比为8∶2 组的磷浸出浓度对比Fig.9 Comparison of phosphorus leaching concentration in phosphogypsum to soil ratio 8∶2 group
为了更好地分析不同菌种在混合土柱中的作用效果,在混合最优比例A3F4 组中,投加4 种不同的菌种配比,分别是P1 与P2 混合(M1)、P2(M2)、P3 与P4 混合(M3)、P1 与P3 混合(M4),磷浸出浓度如图10 所示。随着时间的推移,4 组试验磷的浸出浓度整体呈下降趋势。M1 的磷浸出浓度低于其他3 组,说明聚磷菌有明显的摄磷能力。M3 组磷浸出浓度明显高于其他3 组,原因是在伯克霍尔德菌和枯草芽孢杆菌2 种菌的协同作用下,土柱中一部分磷的形态发生了变化,从难溶性磷转化为可溶磷浸出。但是在聚磷植物对有效态磷的吸收利用以及秸秆有机肥吸附的共同作用下,土柱中浸出的磷浓度依然下降到10 mg/L 以下,说明微生物在低浓度磷的去除中起到关键作用。M4 组磷浸出浓度略低于M2 组,该过程聚磷菌会过量吸收解磷菌释放的磷酸盐并储存于体内,使得浸出液中磷浓度降低。
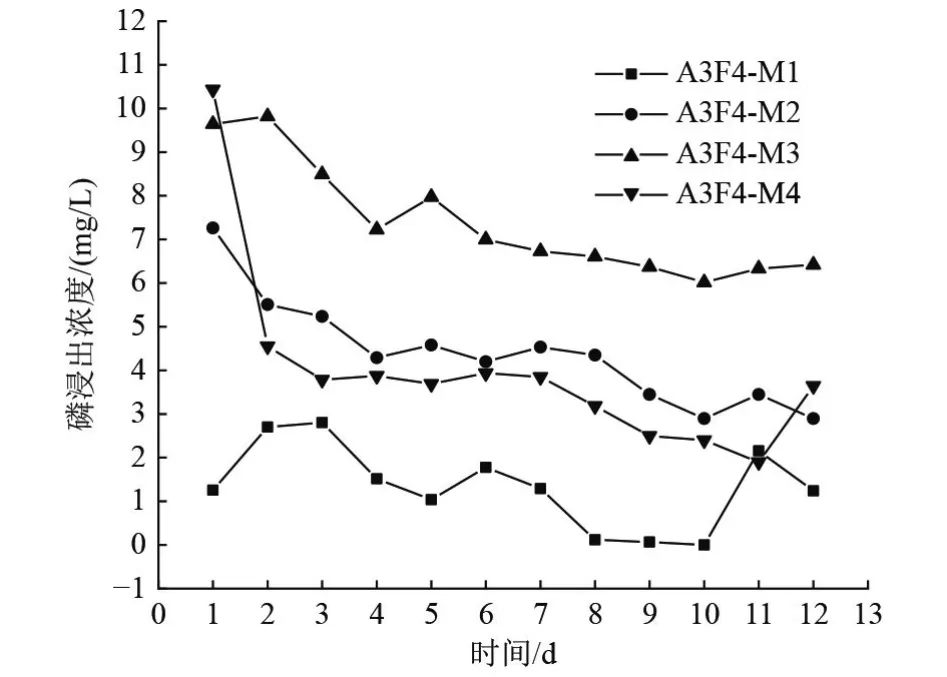
图10 A3F4 组中投加不同菌种后磷浸出浓度对比Fig.10 Comparison of phosphorus leaching concentration in A3F4 group after adding different strains
如图11 所示,当混合配比为磷石膏∶土∶生石灰∶有机肥∶微生物∶草籽质量比为8∶2∶0.2∶0.2∶0.03∶0.03的对照条件下B3F4-M1 组投加假单胞菌和恶臭假单胞菌混合菌种磷浸出浓度最低,聚磷效果最好。假单胞菌与伯克霍尔德菌混合的B3F4-M4 组,浸出液磷浓度的下降速度最快。从整体固磷效果看,磷石膏与土壤按7∶3 比例混合时,相比8∶2 的比例,其磷的浸出浓度更低,因此磷石膏∶土壤为7∶3 更加有利于固磷。

图11 B3F4 组中投加不同菌种后磷浸出浓度对比Fig.11 Comparison of phosphorus leaching concentration in B3F4 group after adding different strains
经测定,磷石膏浸出液初始浓度为633.9 mg/L,与土壤、生石灰、微生物、有机肥和高羊茅植物混合后,定期浇灌模拟自然渗透,收集渗滤液测定总磷浓度,一段时间后磷浸出浓度基本稳定在3 mg/L以下。其中A 组中最优比例A3F4 菌液组磷浸出浓度整体稳定在1 mg/L 以下,达到GB 18918—2002《城镇污水处理厂污染物排放标准》中的一级A 类标准,B 组中最优组B3F4 的磷浸出浓度整体不超过4 mg/L,达到二级标准,所以A 组的混合比例是处理效果最显著、长期处理最稳定的。但是综合考虑成本效益,可以考虑B 组的混合比例处理。添加微生物同时种植高羊茅植物后磷浸出浓度低于未添加组,微生物在固磷的同时可以钝化土壤磷石膏中其他有害重金属并与植物协同改善土壤生态系统,所以微生物和植物协同处理效果更为明显并且实现了磷石膏的绿色综合利用。
2.5 微生物除磷机理分析
通过菌种鉴定试验发现,所筛的菌种P1 和P2 都属于聚磷菌(PAOs)。混合土柱中PAOs 通过与高羊茅根系的相互协同作用实现高效固磷。如图12 所示,PAOs交替暴露于富碳厌氧和缺碳好氧土柱条件下,其吸收大量磷并在细胞内累积多聚磷酸盐[26]。PAOs 利用胞内多聚磷酸盐(Poly-P)[27]、糖原(Gly)[28]的水解获得的能量,吸收介质中挥发性脂肪酸(VFAs)作为碳源[29],并将其转化为聚羟基脂肪酸(PHAs)储存在细胞内[30],同时在多聚磷酸盐降解过程中少量无机磷酸盐(Pi)被释放到细胞外[31];有氧条件下,PAOs 氧化分解PHAs获得能量以维持细胞的运转[32],产生的能量用于ADP 结合磷酸盐合成Poly-P 和三磷酸腺苷(ATP)[33],从而使介质中的大部分可溶Pi 被聚磷菌超量摄取储存[34]。一般来说,细菌体内的含磷量仅占细胞干重的2%左右,但聚磷菌在好氧条件下从外部介质中吸收过量的磷后,体内的磷可能超过10%,甚至高达30%[35]。Poly-P 一般呈颗粒态溶解于细胞质中或与细胞质中的RNA 等化合物结合[36],在细胞质膜、细胞壁或其他细胞器膜中也分布有Poly-P[37]。研究表明,Poly-P 不仅是一种营养储存成分或可转换的能量源,还维持着细胞内稳态和渗透调节、基因甚至酶活性的调节、参与应激反应[38]以及通过螯合作用对重金属进行解毒[39]。生物体聚磷现象广泛存在于细菌、真菌、原生动物、昆虫、藻类、高等植物甚至哺乳动物中[40]。经证实,假单胞菌中有聚磷颗粒,在EBPR 活性污泥中也曾分离到假单胞菌,其具有吸放磷并积累过量磷的能力[41]。无碳预培养后的假单胞菌在富磷培养基中可产生过量摄磷现象且磷摄入量很快达到峰值,此后逐渐下降,但未出现释磷过程[42]。VFAs是聚磷菌转化和能量储存的必要碳源。系统中含有的VFAs 越多,合成的PHAs 越多[43],厌氧阶段细菌释放磷越彻底,好氧阶段合成的聚磷酸盐越多,整体除磷效果越好[44]。VFAs 是厌氧发酵的中间产物[45]。试验中动物粪便和作物秸秆混合发酵体系可在1~3 d 内迅速启动产酸阶段[46],积累大量VFAs,将富含VFAs 的有机肥投加到土柱中时,假单胞菌以VFAs为底物,在好氧情况下有明显的除磷作用,其效果与厌氧-好氧培养相似[47]。在足够的VFAs时,假单胞菌在直接好氧培养中也能有效除磷[48]。微生物在植物去除和吸收某些营养素方面起着主导作用,植物的根分泌物也为微生物创造了适宜的生存环境[33]。菌根在作物磷营养中起着极其重要的作用。土壤中,尤其是根际土壤中存在大量具有解磷能力的微生物。土壤中的磷可以通过吸附、络合、沉淀及同化到微生物和植物生物质中而被去除[49]。聚磷假单胞菌能抑制植物病原微生物的生长,改善植物营养,促进植物生长。同时,假单胞菌可以降解土壤中的有毒物质,可以开发为生产植物微生态制剂的理想菌株[50]。通过育种发现高羊茅的根系发达,遍布土柱土壤中,可以在土层深处寻找营养物质。根系本身会通过主动运输吸收一部分磷,也会为假单胞菌提供适宜的微环境。聚磷菌在固磷的同时,不仅能够促进植物的吸收利用,还可以帮助分解土壤中的有毒重金属。固磷菌和高羊茅二者通过协同作用可发挥更好的效果。聚磷菌在土柱中的作用是高效而持久的。通过除磷试验发现4 种菌中恶臭假单胞菌属的固磷效果最好,在24 h 内可以去除94.3%磷石膏中的磷,在试验过程中种群数量稳定,有一部分菌种会随着降水浸出,但是土柱中的菌种数量比渗滤液高出2 个数量级,聚磷菌繁殖能力快,不需要重复投加,在土柱中持续发挥作用。在原位应用中聚磷菌可以持续稳定发挥作用。土壤中厌氧与好氧状态交替存在,聚磷菌在厌氧状态释放的有效态磷被富磷植物高羊茅吸收利用,而好氧条件下,聚磷菌发挥固磷作用超量吸磷,通过植物-微生物协同作用实现磷的固定,有效改善磷石膏堆场含磷废水的浸出问题,为磷石膏堆场生态覆绿提供了有效的解决途径。

图12 混合土柱中微生物-植物聚磷机理Fig.12 Mechanism of microbial-plant phosphorus accumulation in mixed soil column
3 结论
(1)在磷石膏堆场土壤中筛选出4 种聚磷菌,经过基因测序并构建系统发育进化树确定菌种为假单胞菌、恶臭假单胞菌、枯草芽孢杆菌和伯克霍尔德菌。土柱试验中投加的假单胞菌存活量最高可达6.4×106cfu/mL,土柱中活菌数量整体比渗滤液中高出2 个数量级且随时间呈稳定存活状态。磷石膏与土壤质量比为7∶3 的组,菌种存活数量整体高于8∶2 的组。添加磷石膏质量分数为6%时,假单胞菌和恶臭假单胞菌的固磷率可达93.2%和94.3%。经过前期富磷筛选后,聚磷菌对磷石膏混合土壤的适应性较好,能有效地固定转化磷石膏中的磷元素。
(2)土柱中添加的生石灰可以调节pH 并初步固磷,提高生石灰的质量比,渗滤液总磷浓度大幅度下降,有效固定了磷石膏中的高浓度磷。在此基础上,生物除磷可以根据实际需要降低总磷浓度。添加液体菌剂和植物后,二者的协同作用使磷的浸出浓度不超过1 mg/L,达到GB 18918—2002 中的一级A类标准,实现无害化稳定固磷。
(3)当磷石膏∶土∶生石灰∶有机肥∶微生物∶草籽质量比分别为7∶3∶0.2∶0.2∶0.03∶0.03、8∶2∶0.2∶0.2∶0.03∶0.03 时,投加假单胞菌和恶臭假单胞菌混合菌种的2 组磷浸出浓度低于其他对照组,其固磷效果最佳。目前虽不能完全脱离生石灰改性磷石膏的前提,但是生物法联用的绿色处理最大程度上减少了生态危害,长期效果稳定,可以作为新的处理方向继续探索。

