哈茨木霉对盐胁迫下波斯菊的促生效应







摘要:为了解哈茨木霉(Trichoderma harzianum)对盐胁迫下波斯菊(Cosmos bipinnata Cav.)的促生效应,采用盆栽播种的方式培育波斯菊种子和幼苗,测定并分析哈茨木霉不同施用方式下种子萌发的相关指标,确定哈茨木霉的最佳施用方式,然后用哈茨木霉最佳施用方式处理盐胁迫下波斯菊幼苗并测定其各项生理指标,分析哈茨木霉对盐胁迫下波斯菊的促生效应。结果表明,与CK相比,哈茨木霉喷施处理能极显著提高波斯菊种子的发芽率和芽长,发芽率提高16.67百分点,芽长增加3.70 cm。盐胁迫条件下,喷施哈茨木霉菌剂后波斯菊幼苗的叶绿素总含量提高了232.11%,电导率下降了24.76百分点,伤害度减少35.49百分点,CAT活性降低了25.86%,POD活性增加了58.13%,可溶性蛋白含量减少3.25%。由此可见,哈茨木霉能够促进波斯菊种子萌发和幼苗生长,还能缓解盐胁迫对波斯菊幼苗的毒害作用,提高波斯菊的耐盐能力,对盐胁迫下波斯菊生长发育具有较好的促生效应。
关键词:哈茨木霉;盐胁迫;耐盐性;波斯菊;种子;幼苗
中图分类号:S682.1+10.1" 文献标志码:A
文章编号:1002-1302(2024)24-0166-07
收稿日期:2023-12-20
基金项目:国家自然科学基金地区基金(编号:32160665);云南省科技厅面上项目(编号:202101AT070779)。
作者简介:杨海艳(1979—),女,云南昆明人,博士,副教授,主要研究方向为植物逆境生理和植物病原真菌病害。E-mail:haiyanyang@cxtc.edu.cn。
通信作者:谢美华,博士,副教授,主要研究方向为真菌控制植物线虫病害。E-mail:xiemeihua@cxtc.edu.cn。
随着全球气候变暖、降水量减少及不当灌溉情况的发生,干旱和半干旱地区的土壤盐渍化越来越严重。经粗略统计,世界土地盐渍化面积为 9.6亿hm2,我国土地盐渍化面积为9 913万hm2[1]。为了提高栽培植物的生产力、减少经济损失,土壤盐渍化成为了一个亟待解决的世界性问题。
关于土地盐渍化的研究,早期大多集中在水利灌溉工程措施(包括沟-渠相结合的灌溉措施、排水防治土壤盐渍化和灌溉淋盐等)、农业技术措施(包括平整土地、深翻土地、压沙、精耕细作、深翻晒垄、合理灌溉、增施肥料、种植绿肥等)、物理改良措施、化学改良措施、生物改良措施、综合改良措施和建立健全水盐动态监测体系[2-3]。目前土地盐渍化的研究已经从调节外界环境条件转向研究植物自身的耐盐能力,以及通过提高植物的耐盐性来解决土地盐渍化问题。研究表明,植物自身的调节机制可以响应盐胁迫,植物细胞会合成可溶性糖、可溶性蛋白、脯氨酸等物质来调节细胞之间的渗透压,还能通过改变自身过氧化氢酶活性、过氧化物酶活性以及丙二醛含量等途径来缓解外界胁迫[4]。研究表明,施加给植物一个外来因子,提高植物的耐盐能力,能有效缓解植株的盐害作用,如施加适宜浓度的外源钙给盐胁迫下的单叶蔷薇,促进了蔷薇种子萌发和幼苗生长,有效缓解了盐胁迫对蔷薇的影响[5]。外源硅、NO、SA等都能提高植物的耐盐性,而植物促生菌也能对盐胁迫下的水稻、西瓜、燕麦、玉米等植物起促生作用[6-12]。
波斯菊(Cosmos bipinnata Cav.)属菊科秋英属,是一种观赏强、生长周期短且具有药用价值的植物,在我国栽培甚广,被种植于道路、边坡、小区、公园等城市园林绿化[13]。然而,因为自然与人为破坏等多种因素,土地盐渍化面积正在不断增加,严重影响了波斯菊的生长。研究表明,波斯菊幼苗对盐胁迫较为敏感,低浓度会抑制种子萌发,影响幼苗株高、根长,高浓度则可使波斯菊出现停止生长的趋势[14]。这种情况制约了波斯菊的种植范围与面积,所以合理开发和改造利用土壤盐渍化土地,以及提高波斯菊的耐盐能力是当前需要解决的问题。
木霉(Trichoderma spp.)属于半知菌门丝孢目木霉属,是一类分布广泛的土壤习居菌,在田野甚至于工地石块上也能找到木霉菌[15]。而除个别为弱病原菌外,大多数木霉对植物病菌均具有拮抗作用[16],对多种土传病害具有很好的防治效果,已经有多种木霉菌被广泛应用于多种植物真菌病害的防治并作为可推广应用的生物菌剂[16-17]。其中国内外最常见的生物制剂主要有哈茨木霉、多孢木霉、绿色木霉[18]。经研究发现,哈茨木霉(Trichoderma harzianum)具有多种生物作用,如拮抗作用、促生作用、诱导抗性作用等[19]。哈茨木霉在田间施用可以有效促进植物种子萌发和植株根系生长,且通过根系土壤中的营养物质及根系分泌物进行快速生长并在植物根系中快速定殖[20]。前人关于T28哈茨木霉的研究发现,哈茨木霉对NaCl有较好的耐盐性;可以增加椒样薄荷(Mentha×piperita)、蔬菜种子和幼苗、大麦(Hordeum vulgare L.)、黄瓜(Cucumis sativus L.)的耐盐性[21-25]。哈茨木霉能否提高波斯菊的耐盐性还有待研究。
本试验选用白色矮秆波斯菊为研究材料,通过测定不同处理后波斯菊光合特性和抗逆性相关指标,初步探究哈茨木霉对盐胁迫下波斯菊的促生效应,为进一步探究哈茨木霉在波斯菊中的生产应用提供理论基础。
1 材料与方法
1.1 试验材料
以矮秆白色波斯菊(Cosmos bipinnata Cav.)为试材,种子购买于沭阳花之茵种业有限公司。
试验用哈茨木霉菌剂为有效孢子数达到5×109 CFU/g的可湿性粉剂,购买于山东木鱼石生物科技有限公司。试验于2022年在楚雄师范学院完成。
1.2 试验方法
1.2.1 哈茨木霉施用方式确定
分别用喷施、浸种、包衣、拌土4种处理方式对经过24 h催芽处理的波斯菊种子进行试验,以清水处理波斯菊作为对照组,各处理重复3次,每次每盆撒播30粒波斯菊种子。播种7 d后测定种子的发芽率、发芽势,30 d后测量波斯菊幼苗的芽长和根长来确定哈茨木霉的最佳施用方式。
1.2.2 哈茨木霉对盐胁迫下波斯菊的影响
用0.67 mol/L NaCl溶液(半致死浓度)模拟盐胁迫环境[26]。将哈茨木霉菌剂与无菌水按照说明书上的比例(1 g ∶300 mL)配制成哈茨木霉菌剂孢子混合液。其中一组用0.67 mol/L NaCl溶液对波斯菊进行喷施处理,另外一组用NaCl溶液加哈茨木霉菌剂孢子混合液进行喷施,以清水和哈茨木霉喷施作为对照,每23 d喷施1次,每个处理重复3次。
1.3 相关生理指标的测定
用分光光度法测定波斯菊中叶绿素含量及过氧化物酶(POD)活性;采用TCA法测定MDA含量;采用紫外吸收法测定过氧化氢酶(CAT)活性;采用考马斯亮蓝法测定可溶性蛋白含量;用电导率仪测定电导率,并计算出相对电导率以及伤害度[27]。
伤害度=(E-ECK)/(1-ECK)×100%。
式中:E为处理组的相对电导率;ECK为对照的相对电导率。
1.4 数据处理
用SPSS 26.0进行方差分析。
2 结果与分析
2.1 哈茨木霉不同施用方式对波斯菊种子萌发及幼苗生长的影响
2.1.1 对波斯菊种子萌发的影响
由图1可知,哈茨木霉的不同施用方式对波斯菊种子萌发的影响不同。与CK相比,哈茨木霉菌剂处理后对波斯菊种子发芽率有促进作用。其中,波斯菊种子用哈茨木霉菌剂喷施后,发芽率提高了16.67百分点,差异极显著;用哈茨木霉浸种和拌土处理波斯菊种子,发芽率分别提高了8.89、3.33百分点,但差异并不显著;用哈茨木霉菌剂包衣处理的波斯菊种子发芽率没有提高,即哈茨木霉包衣对波斯菊种子萌发没有促进作用。以上方法中,哈茨木霉菌剂喷施处理对波斯菊发芽率促进作用最明显。
由图2可知,与CK相比,用哈茨木霉菌剂喷施处理波斯菊种子时,发芽势提高了13.33百分点;用哈茨木霉菌剂浸种和拌土处理时,发芽势均提高了6.66百分点;用哈茨木霉包衣处理时,波斯菊种子发芽势提高了4.44百分点。虽然每个处理相较于CK都提高了发芽势,但是差异均不显著。哈茨木霉不同施用方式对波斯菊种子发芽势影响不大。
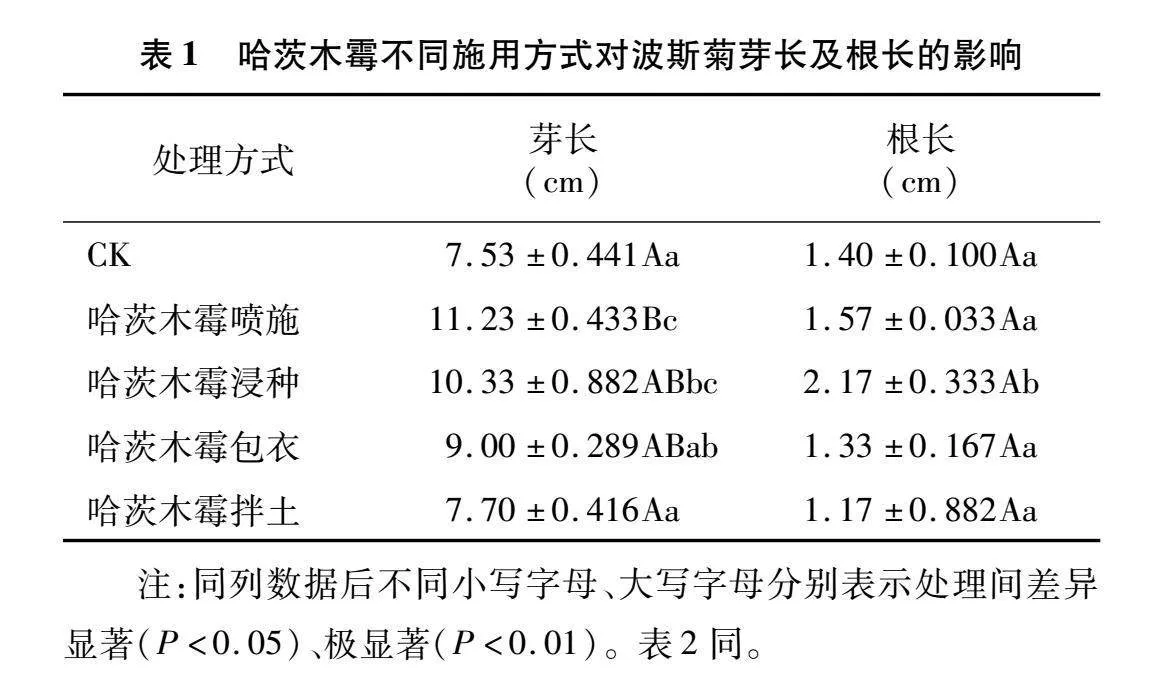
2.1.2 对波斯菊幼苗生长的影响
由表1可知,与CK相比,哈茨木霉菌剂施用方式不同对波斯菊幼苗生长影响程度不同。其中,哈茨木霉菌剂喷施处理对波斯菊的芽长有极显著的促进作用,对根长的促进作用不显著;哈茨木霉菌剂浸种处理对波斯菊芽长和根长均有显著的促进作用;哈茨木霉菌剂包衣处理的波斯菊幼苗芽长较CK长了1.47 cm,促进作用不显著,且抑制了根长;而哈茨木霉菌剂拌土处理对波斯菊的芽长和根长影响都不显著。
同时,通过图3可以看出,用哈茨木霉处理后的波斯菊幼苗茎比CK更粗,促进作用分别是哈茨木霉浸种gt;哈茨木霉喷施gt;哈茨木霉包衣gt;哈茨木霉拌土gt;CK,而通过哈茨木霉处理后波斯菊根部同样长出很多须根,须根数量关系分别是哈茨木霉浸种gt;哈茨木霉喷施gt;哈茨木霉拌土gt;哈茨木霉包衣gt;CK。图中可以明显看出,生长情况最好的是经过哈茨木霉菌剂浸种和哈茨木霉菌剂喷施的幼苗。
结合图1至图3和表1可知,施用哈茨木霉菌剂能促进波斯菊种子萌发和幼苗生长。其中哈茨木霉菌剂喷施处理对波斯菊促生效应最大,其次是哈茨木霉菌剂浸种处理,而哈茨木霉菌剂拌土处理和包衣处理促生效应相差不大。所以,选用哈茨木霉喷施处理波斯菊种子进行盐胁迫条件下的生长试验。
2.2 哈茨木霉对盐胁迫下波斯菊幼苗生理特性的影响
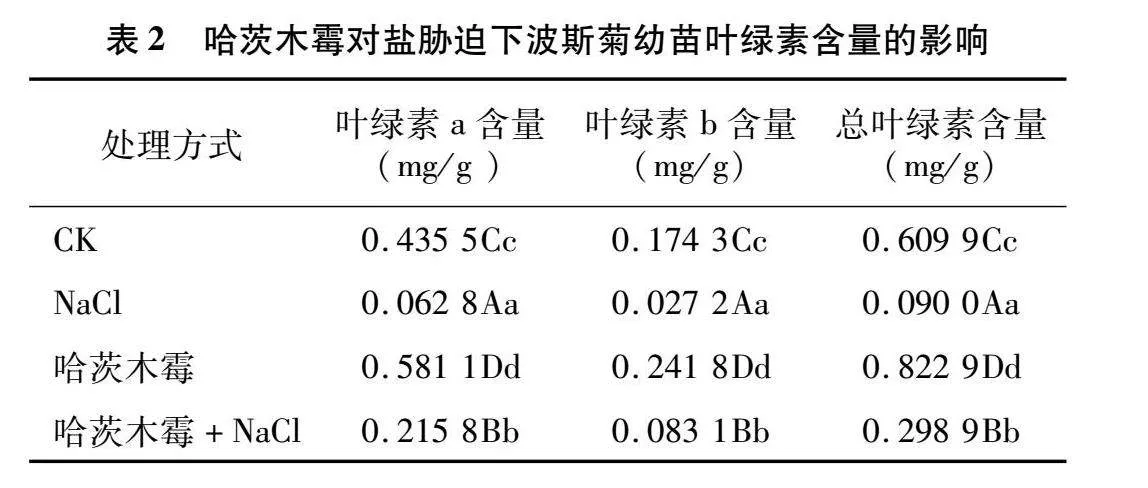
2.2.1 对波斯菊幼苗叶绿素含量的影响
由表2可知,NaCl溶液处理下的波斯菊与CK相比,叶绿素含量极显著下降,其中叶绿素a含量下降了85.58%,叶绿素b含量下降了84.39%,叶绿素总含量下降了85.24%;施加了哈茨木霉菌剂的波斯菊的叶绿素含量极显著增加,其中叶绿素a含量增加了33.43%,叶绿素b含量增加了38.73%,叶绿素总含量增加了34.92%。在盐胁迫下施加了哈茨木霉菌剂的波斯菊相比CK的叶绿素含量极显著下降,其中叶绿素a含量下降了50.45%,叶绿素b含量下降了52.32%,叶绿素总含量下降了50.99%;但是在盐胁迫下施加哈茨木霉菌剂的波斯菊相比盐胁迫下波斯菊的叶绿素含量极显著增加,其中叶绿素a含量增加了243.63%,叶绿素b含量增加了205.51%,叶绿素总含量增加了232.11%。由此可见,施用哈茨木霉菌剂能有效缓解盐胁迫条件下波斯菊叶绿素含量的下降。
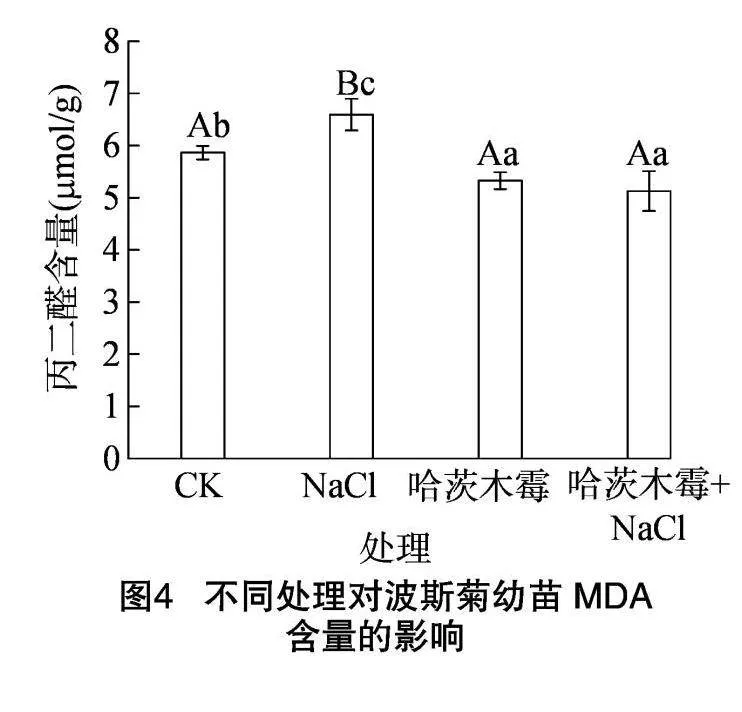
2.2.2 对波斯菊幼苗丙二醛(MDA)含量的影响
由图4可知,与CK相比,盐胁迫下波斯菊的MDA含量增加了12.43%,有极显著差异;施用哈茨木霉菌剂的波斯菊MDA含量减少了9.17%,有显著差异;而在盐胁迫下施加了哈茨木霉菌剂的波斯菊MDA含量减少了12.56%,两者之间也有显著差异。而相较于单独的盐胁迫处理,在盐胁迫条件下施用哈茨木霉菌剂,波斯菊的MDA含量减少了22.23%,有极显著差异。由此可见,哈茨木霉菌剂能有效缓解盐胁迫条件下波斯菊MDA含量的增加。
2.2.3 对波斯菊幼苗相对电导率的影响
由图5可知,盐胁迫下波斯菊的相对电导率为74.81%,与CK相比,盐胁迫对植株的伤害度为63.90%,与对照组有极显著差异;施用哈茨木霉菌剂的波斯菊相对电导率为31.68%,对植株的伤害度为2.08%,与对照组基本相同;盐胁迫下的波斯菊施用了哈茨木霉菌剂后,相对电导率为50.05%,对植株的伤害度为28.41%,较盐胁迫组下降了35.49百分点,二者有极显著差异。由上可知,哈茨木霉菌剂的施用降低了盐胁迫对波斯菊的伤害度和植株的相对电导率。
2.2.4 对波斯菊幼苗过氧化氢酶(CAT)活性的影响
由图6可知,不同处理对波斯菊幼苗的CAT活性影响较大,其中盐胁迫下的波斯菊幼苗CAT活性与CK相比增加了42.09%,有极显著差异;施加了哈茨木霉菌剂的波斯菊幼苗CAT活性较CK增加了11.25%,有极显著差异;而对盐胁迫下的波斯菊施加了哈茨木霉菌剂后,波斯菊的CAT活性较CK增加了5.34%,差异不显著,而与盐胁迫单独处理的波斯菊相比,活性则极显著降低了25.86%。由此可见,哈茨木霉菌剂的施加极大缓解了盐胁迫下波斯菊CAT活性的上升。
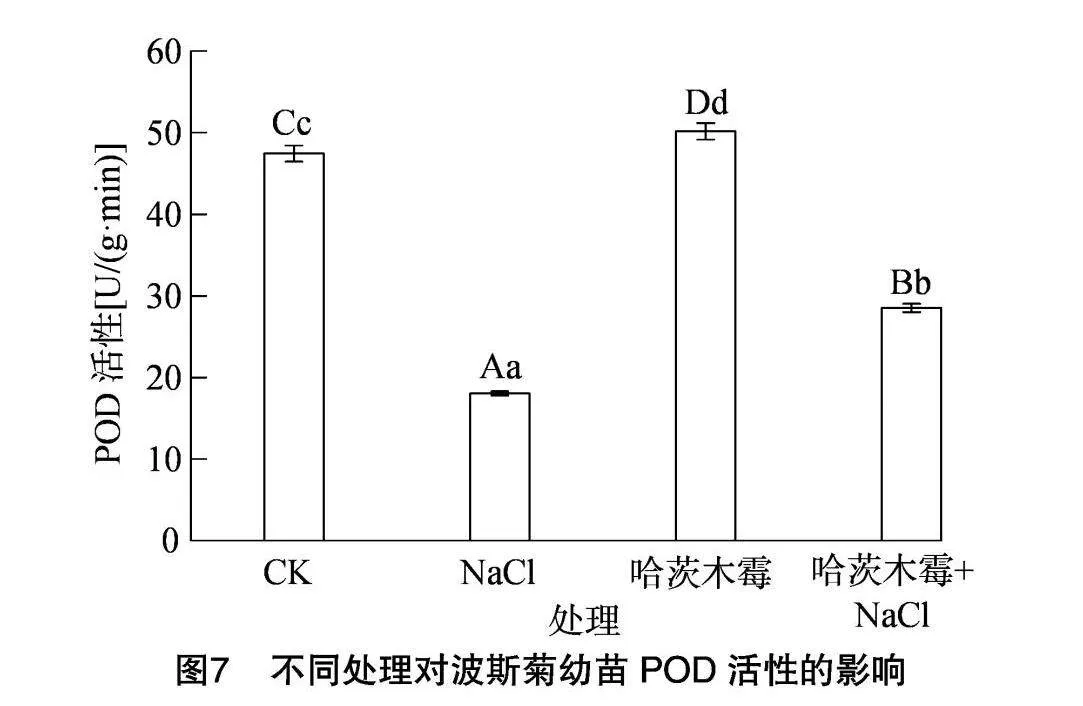
2.2.5 对波斯菊幼苗过氧化物酶(POD)活性的影响
由图7可知,与CK相比,盐胁迫下波斯菊幼苗的POD活性极显著下降,降低了61.98%;施加了哈茨木霉菌剂的波斯菊幼苗POD活性极显著升高,较对照组增加了5.75%;而对盐胁迫下的波斯菊幼苗施加哈茨木霉菌剂,处理后的POD活性与盐胁迫下的波斯菊相比极显著增加,增加了58.13%。由此可得,哈茨木霉菌剂的施用能减轻波斯菊的盐胁迫作用。
2.2.6 对波斯菊幼苗可溶性蛋白含量的影响
由图8可知,盐胁迫下波斯菊幼苗的可溶性蛋白含量较CK显著增加了4.08%;施加了哈茨木霉菌剂的波斯菊幼苗的可溶性蛋白含量较CK显著增加了3.85%;而对盐胁迫下波斯菊幼苗施加哈茨木霉菌剂后,波斯菊的可溶性蛋白含量显著降低3.25%,与CK含量基本相同。由此可得,施加哈茨木霉菌剂有助于缓解盐胁迫下波斯菊幼苗的可溶性蛋白含量增加。
通过对表2及图4至图8的分析可以得出,哈茨木霉菌剂的施用对盐胁迫下波斯菊幼苗的光合特性、抗逆性的各项生理指标均有显著影响,能促进波斯菊幼苗在盐胁迫的环境下更好地生长发育。
3 讨论
3.1 哈茨木霉对波斯菊的影响
木霉被认为是最有希望的生物防治因子,而哈茨木霉是木霉属中应用最广泛的菌株,对植物种子活力、发芽率、根系活力、株高等都有较显著的促生效应[28]。哈茨木霉不同的处理方式对波斯菊种子萌发和幼苗生长的影响不同。本研究表明,与CK相比,哈茨木霉菌剂喷施、浸种、包衣、拌土处理对波斯菊种子的发芽率、发芽势、芽长等有不同程度的影响,其中哈茨木霉菌剂喷施处理大大提高了波斯菊种子的发芽率和发芽势,使波斯菊种子的发芽率达到了85.56%,发芽势达到了40.00%,这与木霉菌促进了黄瓜的发芽率和发芽势结果[29]相似。此外,不同哈茨木霉菌剂的施用方式对波斯菊幼苗生长发育效果也存在差异,其中哈茨木霉喷施和浸种处理对波斯菊幼苗根长、芽长有促生效应,均能使幼苗株高明显增加,茎更粗,浸种处理明显增加根长,2种处理方式均能增加波斯菊的须根数,这与谢琳淼等对哈茨木霉促进紫羊茅和草地早熟禾芽长和根长的研究结果[30]相同,也与周晓馥等研究发现黄瓜幼苗施加哈茨木霉后,植株的总根长、总根表面积、根尖数、分支数、总根体积、交叉数等根系各项指标均高于对照组的结果[31]一致。综合分析发现,哈茨木霉喷施处理对波斯菊的生长发育具有较大的促生效应,施用哈茨木霉菌剂后,与对照组(CK)相比,波斯菊的叶绿素含量、CAT活性、POD活性、可溶性蛋白含量都有提高,MDA含量明显下降,相对电导率影响不大。此结果与刘畅等用哈茨木霉对玉米苗期生理指标测定的结果[32]基本一致。综合考虑,对波斯菊而言,采用喷施这种处理方式,效果更好。
3.2 哈茨木霉对盐胁迫下波斯菊幼苗光合特性和可溶性蛋白质含量的影响
盐胁迫能较大程度地抑制植物的光合作用,破坏植株的叶绿体结构,使植物的叶绿素含量不断减少[33]。本研究中,盐胁迫能极显著地降低波斯菊幼苗的叶绿素含量,抑制了波斯菊的光合作用,对盐胁迫下的波斯菊幼苗施加哈茨木霉菌剂后,植株的叶绿素含量有了显著的升高,这与李哲等对盐胁迫下椒样薄荷耐盐生理特性研究中叶绿素含量升高的试验结果[34]相符。经研究发现,木霉能在本氏烟草根系定殖,通过诱导抗生作用促进植物叶绿素合成[35]。也有试验表明,哈茨木霉能促进植物对氮、磷等营养物质的吸收,而氮、磷的吸收有利于植株对叶绿体的合成,进一步来提高植物的光合作用[36]。由此可以推测出,本试验中哈茨木霉可能通过改善波斯菊根系土壤环境,提高了植株对氮、磷等矿物质的吸收,促进了波斯菊合成叶绿素,从而缓解盐胁迫对波斯菊的毒害作用。
盐胁迫下,植物体内可溶性蛋白不断增加,其增加和积累能有效地保护植株的生物膜,提高植物细胞的保水能力,是植物体内重要的渗透调节物质和营养物质[37]。许多研究表明,盐胁迫能引起植物细胞中Na+大量富集、K+缺乏,导致离子失衡,破坏植株渗透压,然后影响植物正常的生长发育[38]。盐胁迫下波斯菊幼苗的可溶性蛋白含量显著增加,与NaCl胁迫下丛枝菌根真菌对紫花苜蓿蛋白质含量变化结果[39]一致:试验中叶片的盐浓度增加,细胞中Na+含量随之增加,K+含量减少,而真菌的加入使紫花苜蓿叶片的Na+含量下降,K+含量升高到正常水平,细胞内渗透压恢复正常,可溶性蛋白含量也随之恢复初始水平。也有研究发现,植株被AM 真菌侵染后,植物根系中的可溶性糖含量显著提升,通过改变根组织中的渗透平衡来减少植物对Na+和 Cl-的吸收,以此来增强植物的抗盐能力[40]。由于哈茨木霉具有竞争作用,能通过分泌大量有利于自身生长的酶来迅速定殖在植株根系,占领周围营养物质和土壤来抑制病原菌的生长[28]。同时向杰等通过对哈茨木霉转录、代谢联合分析得出,在离子转运调节方面,哈茨木霉筛选得到1个上调表达Na+/K+-ATPase相关基因和8个上调表达的ABC转运蛋白,以此来维持胞内盐离子的平衡,调节自身渗透压[41]。在本研究中,对盐胁迫下的波斯菊施用哈茨木霉菌剂后,可溶性蛋白含量显著降低,基本下降到与CK含量相同。这可能是由于哈茨木霉施用后,快速定殖在植物根系上,占领土壤了周围,减缓Na+和Cl-大量进入植物细胞,进而维护了波斯菊细胞内外渗透压平衡,使植株可溶性蛋白含量保持在原始数值,增强了波斯菊对盐胁迫的耐受能力。
3.3 哈茨木霉对盐胁迫下波斯菊幼苗叶片质膜透性的影响
盐胁迫对植物细胞膜造成伤害,使细胞膜透性增加,导致电解质外渗,而外渗的电解质能使溶液的电导率发生变化,可以用溶液变化情况来反映细胞膜受损程度[42]。盐胁迫会影响植物细胞内自由基的产生和消除,增加自由基的积累,引发膜脂过氧化作用,产生大量丙二醛(MDA),进而造成生物膜的破坏[43]。本研究结果显示,NaCl溶液处理的波斯菊幼苗相对电导率和MDA含量均有极显著增加,而对NaCl溶液处理的波斯菊施加哈茨木霉菌剂后,相对电导率和MDA含量都有了极显著下降。经研究发现,哈茨木霉T22可以提高植物在盐胁迫下的种子萌发,通过减少渗透压胁迫或老化的幼苗中脂质过氧化物含量来缓解氧化性损伤[44],对盐胁迫下的植株起到了较好的促生效应。同时赵忠娟等用哈茨木霉对蔬菜种子和幼苗耐盐性的探究也表明哈茨木霉能减轻蔬菜的膜质损伤,以此来降低幼苗相对电导率和MDA含量[23]。本试验中,施用哈茨木霉后,波斯菊幼苗的相对电导率和MDA含量虽没有降低到与CK相同,但较NaCl处理组极显著降低,极大缓解了盐胁迫下两者的增加,保护了波斯菊的质膜透性,提高了波斯菊对盐的耐受能力。
3.4 哈茨木霉对盐胁迫下波斯菊幼苗抗氧化活性的影响
盐胁迫下植物会产生氧自由基(ROS),使植株体核酸功能发生改变、引起基因突变等反应,影响植株正常生长[45]。而植物体内抗氧化酶能起到清除ROS的目的,使ROS维持在一个相对稳定的状态[46]。有研究发现,解盐促生菌可以诱导并加强植物产生的抗氧化酶活性[47]。本研究中,与CK相比,盐胁迫下波斯菊幼苗的CAT活性极显著增加,POD活性极显著下降。与NaCl处理组相比,对盐胁迫下的波斯菊幼苗施加了哈茨木霉菌剂后,波斯菊的CAT活性大幅度降低,POD活性大幅度升高,这说明施用哈茨木霉菌剂加强了波斯菊体内的抗氧化酶活性,清除了盐胁迫下产生的ROS,使波斯菊体内环境保持在一个相对稳定的氧化还原状态,缓解了盐胁迫对波斯菊的毒害作用,即哈茨木霉菌剂提高了波斯菊的耐盐能力。本试验的结果与赵忠娟等对椒样薄荷结果处理后CAT活性和POD活性变化结果[23]大致相同,表明哈茨木霉能对盐胁迫下的波斯菊起到促生效应。
4 结论
本试验先对波斯菊种子分别进行了喷施、浸种、包衣和拌土处理,并以清水作为对照,分析了哈茨木霉不同施用方式对波斯菊种子萌发和幼苗生长的影响,通过对波斯菊种子的发芽率、发芽势、芽长和根长的测定,探讨哈茨木霉不同施用方式对波斯菊种子的促生效应,确定哈茨木霉菌剂对波斯菊的最佳施用方式。经研究发现,哈茨木霉的浸种、喷施、包衣和拌土都能在一定程度上影响种子萌发相关指标,其中哈茨木霉喷施处理明显提高了种子的发芽率、芽长和茎粗,促进须根生长,对波斯菊种子起到了较好的促生效应。
通过测定不同处理下波斯菊幼苗的光合指标、可溶性蛋白、相对电导率、MDA含量、POD活性和CAT活性来探究哈茨木霉对盐胁迫下波斯菊种子的促生效应。经研究发现,盐胁迫下波斯菊的叶绿素总含量和POD活性较CK分别极显著降低了85.24%、61.98%,相对电导率极显著升高,为74.81%,MDA含量和CAT活性分别极显著增加了12.43%、42.09%,可溶性蛋白含量显著增加了4.08%;而对盐胁迫下的波斯菊幼苗施用哈茨木霉菌剂后,哈茨木霉快速定殖在植物根系上,占领波斯菊周围土壤和营养物质,进而改善波斯菊根系土壤环境,提高植株对氮磷等矿物质的吸收,减缓Na+和Cl-大量进入植物细胞,进而维护了波斯菊细胞内外渗透压平衡,保护了波斯菊的质膜透性。氮、磷的吸收有助于波斯菊提高叶绿素含量。而哈茨木霉维护波斯菊细胞的渗透压平衡,能有效保护细胞生物膜,使其可溶性蛋白含量恢复原始数值。此外,哈茨木霉减轻了波斯菊的膜质损伤,加强了波斯菊体内的抗氧化酶活性,清除了盐胁迫下产生的ROS,使波斯菊体内环境保持在相对稳定的氧化还原状态。与NaCl处理组相比,施用了哈茨木霉的波斯菊幼苗的相对电导率下降了35.49百分点,CAT活性降低了25.86%,MDA含量减少了22.23%,POD活性提高了58.13%,叶绿素总含量增加了232.11%。由此可见,哈茨木霉对盐胁迫下的波斯菊有较好的促生效应,能提高波斯菊的耐盐能力,缓解盐胁迫对波斯菊的毒害作用。
参考文献:
[1]毛 恋,芦建国,江海燕. 植物响应盐碱胁迫的机制[J]. 分子植物育种,2020,18(10):3441-3448.
[2]韩 明. 河西地区土地盐渍化现状分析及改善措施[D]. 兰州:兰州大学,2017.
[3]闵首军,崔松山,陈沁利. 土壤盐渍化及其治理措施研究综述[J]. 中国农业信息,2016(5):108,110.
[4]李俊伟,刘景辉,赵宝平,等. 燕麦苗期耐盐性评价及鉴定指标筛选[J/OL]. 吉林农业大学学报,2024:1-8(2022-05-05)[2023-12-20]. https://doi.org/10.13327/j.jjlau.2021.1623.
[5]闫 振,李 进,阿丽努尔·阿卜来提,等. 外源钙对盐胁迫下单叶蔷薇种子萌发和幼苗生长的影响[J]. 草地学报,2022,30 (5):1185-1193.
[6]缑天韵. 外源硅提高黄瓜耐盐性的生理机理探讨[D]. 杨凌:西北农林科技大学,2020.
[7]杨 璞,高彩红. 外源NO对盐胁迫条件下植物伤害的缓解效应[J]. 安徽农业科学,2020,48(12):46-48.
[8]赵 丹,纪 鹏,何晓蕾,等. SA对盐胁迫下草本植物种子萌发及幼苗生理特性影响的研究进展[J]. 黑龙江八一农垦大学学报,2020,32(3):7-12.
[9]辛树权,王 贵,高 扬. 植物生长促生菌对盐胁迫下水稻种子萌发及幼苗生长的影响[J]. 湖北农业科学,2012,51(3):490-492,496.
[10]陈 昆,张正亮,高 磊. 碱蓬内生菌对盐胁迫西瓜幼苗形态建成及生理特性的影响[J]. 江苏农业科学,2022,50(9):116-122.
[11]张银翠,姚 拓,赵桂琴,等. 耐盐促生菌筛选鉴定及对盐胁迫燕麦生长的影响[J]. 草地学报,2021,29(12):2645-2652.
[12]袁 海,何鹏飞,吴毅歆,等. 盐胁迫下益生菌对玉米的促生效应研究[J]. 玉米科学,2019,27(1):69-74.
[13]姜云天,闫中雪,袁 浩,等. Na2CO3胁迫对波斯菊种子萌发的影响[J]. 现代园艺,2014(21):12-13.
[14]杜 艳,裴 蕾,高志英,等. 盐胁迫对2种基因型波斯菊种子萌发和幼苗生长的影响[J]. 江苏农业科学,2018,46(3):128-131.
[15]苏胜荣. 木霉菌生防机制及分类的研究进展[J]. 黄山学院学报,2007,9(3):97-102.
[16]Howell C R. Mechanisms employed by Trichoderma species in the biological control of plant diseases:the history and evolution of current concepts[J]. Plant Disease,2003,87(1):4-10.
[17]郭润芳,刘晓光,高克祥,等. 拮抗木霉菌在生物防治中的应用与研究进展[J]. 中国生物防治,2002,18(4):180-184.
[18]辛雅芬,商金杰,高克祥. 拮抗木霉菌的生防机制研究进展[J]. 东北林业大学学报,2005,33(4):88-91.
[19]黄 竹,姚艳平. 8株木霉菌挥发性代谢产物对玉米种子的促生作用研究[J]. 种子科技,2019,37(4):143-145.
[20]刘 峰,阮盈盈. 哈茨木霉菌剂对玉米苗期生长和土壤肥力的影响[J]. 浙江农业科学,2021,62(8):1507-1510.
[21]尹大川,邓 勋,郑 宇,等. 盐碱胁迫对哈茨木霉T28的生长及营养代谢的影响[J]. 北京林业大学学报,2014,36(5):109-116.
[22]赵忠娟,杨 凯,扈进冬,等. 盐胁迫条件下哈茨木霉ST02对椒样薄荷生长及根区土壤理化性质的影响[J]. 生物技术通报,2022,38(7):224-235.
[23]赵忠娟,扈进冬,吴晓青,等. 哈茨木霉LTR-2对蔬菜种子和幼苗耐盐性的影响及其作用机制[J]. 山东科学,2015,28(5):27-34.
[24]Gupta S,Smith P M C,Boughton B A,et al. Inoculation of barley with Trichoderma harzianum T-22 modifies lipids and metabolites to improve salt tolerance[J]. Journal of Experimental Botany,2021,72(20):7229-7246.
[25]李舒依,李方乐,王颖杰,等. NaCl胁迫下哈茨木霉对黄瓜种子萌发的影响[J]. 科学技术与工程,2016,16(9):164-166.
[26]徐小玉,张凤银,曾庆微. NaCl和Na2SO4盐胁迫对波斯菊种子萌发的影响[J]. 东北农业大学学报,2014,45(4):55-59.
[27]郑秋玲. 温度胁迫对葡萄生长的影响及叶面肥喷布效应[D]. 泰安:山东农业大学,2010:22.
[28]吕 黎,许丽媛,罗志威,等. 哈茨木霉生物防治研究进展[J]. 湖南农业科学,2013(17):92-95.
[29]赵诗杰,梁 松,邱新月,等. 康氏木霉对小麦和黄瓜种子发芽的影响[J]. 山西农业科学,2022,50(7):1043-1049.
[30]谢琳淼,常春丽,姚志红,等. 哈茨木霉对紫羊茅和草地早熟禾的促生及抗性诱导作用[J]. 草业科学,2018,35(9):2079-2086.
[31]周晓馥,张欣玥,蔡汶妤,等. 哈茨木霉对黄瓜幼苗促生作用的影响[J]. 吉林师范大学学报(自然科学版),2020,41(3):93-99.
[32]刘 畅,张欣玥,蔡汶妤,等. 绿色木霉与哈茨木霉对黄瓜幼苗促生作用机理的研究[J]. 江苏农业科学,2020,48(16):156-160.
[33]朱新广,张其德. NaCl对光合作用影响的研究进展[J]. 植物学通报,1999,16(4):332.
[34]李 哲,郭 凯,吴晓青,等. 哈茨木霉LTR-2对椒样薄荷耐盐生理特性的影响[J]. 山东科学,2014,27(4):17-24,41.
[35]李一晗,庄文化,曾 玥,等. 接种木霉对本氏烟草生长及营养吸收的影响[J]. 安徽农学通报,2022,28(7):36-39.
[36]Yue H T,Mo W P,Li C,et al. The salt stress relief and growth promotion effect of Rs-5 on cotton[J]. Plant and Soil,2007,297(1/2):139-145.
[37]刘燕敏,陈宇聪,吕 睿,等. 甜瓜幼苗对逆境胁迫的生理响应及抗逆性分析[J]. 农业灾害研究,2021,11(8):132-133.
[38]杨冬爽. 基于代谢组学的野大豆(Glycine soja)耐盐机理研究[D]. 长春:东北师范大学,2017:3-6.
[39]张永志,高文俊,郭艳妮,等. 丛枝菌根真菌对NaCl胁迫下紫花苜蓿的生理指标及光合参数的影响[J]. 草原与草坪,2018,38(4):26-34.
[40]Feng G,Zhang F,Li X,et al. Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots[J]. Mycorrhiza,2002,12(4):185-190.
[41]向 杰,陈敬师,夏鑫鑫,等. 基于转录-代谢联合分析哈茨木霉ACCC32527 对NaCl胁迫的分子调节[J]. 中国农业科学,2019,52(12):2079-2091.
[42]McKay H M,Mason W L. Physiological indicators of tolerance to cold storage in Sitka spruce and Douglas-fir seedlings[J]. Canadian Journal of Forest Research,1991,21(6):890-901.
[43]孙国荣,关 旸,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J]. 草地学报,2001,9(1):34-38.
[44]Mastouri F,Bjrkman T,Harman G E. Seed treatment with Trichoderma harzianum alleviates biotic,abiotic,and physiological stresses in germinating seeds and seedlings[J]. Phytopathology,2010,100(11):1213-1221.
[45]Choudhury S,Panda P,Sahoo L,et al. Reactive oxygen species signaling in plants under abiotic stress[J]. Plant Signaling amp; Behavior,2013,8(4):e23681.
[46]Ahmad P,Jaleel C A,Salem M A,et al. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress[J]. Critical Reviews in Biotechnology,2010,30(3):161-175.
[47]Mittler R.Oxidative stress,antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405-410.

