不同种植方式对土壤细菌群落结构及魔芋生长的影响





摘要:【目的】揭示不同种植方式对土壤细菌群落结构及下茬魔芋生长的影响,为合理利用种植方式改善土壤微生态环境及维持魔芋的可持续种植提供科学依据。【方法】利用高通量测序技术分析未种植过魔芋(N)、前茬作物为魔芋(R)、种植魔芋后轮作1茬玉米(L1)和种植魔芋后轮作2茬玉米(L2)4种种植方式下土壤细菌群落结构和多样性的差异;种植下茬魔芋前采集土壤样品测定土壤理化性质,调查测定魔芋出苗率、株高、叶长、存苗率和单株块茎鲜重,探究不同种植方式形成的土壤微生态对下茬魔芋生长的影响。【结果】R处理的土壤电导率、有机质、碱解氮和速效钾含量显著高于N和L2处理(Plt;0.05,下同),pH则显著低于N和L2处理。4种种植方式土壤细菌群落的Sobs指数、ACE指数和Shannon指数均为N处理gt;L2处理gt;L1处理gt;R处理。主坐标分析结果显示R和L1处理的土壤细菌群落结构较相似,与N和L2处理的土壤细菌群落结构存在明显差异。N处理的变形菌门(Proteobacteria)、黏球菌门(Myxo‐coccota)和芽单胞菌门(Gemmatimonadota)相对丰度显著高于R处理,绿弯菌门(Chloroflexi)相对丰度则显著低于R处理;但这4个优势细菌门的相对丰度在N和L2处理间差异均不显著(Pgt;0.05,下同)。相关分析结果显示,土壤pH、电导率及有机质、碱解氮、有效磷和速效钾含量与芽孢杆菌属(Bacillus)、盖亚菌属(Gaiella)、土壤红杆菌属(Solirubrobacter)、MND1和斯科曼氏球菌属(Skermanella)等土壤优势细菌属的相对丰度呈显著或极显著(Plt;0.01,Plt;0.001)相关。N处理与L2处理的下茬魔芋出苗率、存苗率、株高、叶长和单株块茎鲜重差异均不显著,但均显著高于R处理。【结论】种植魔芋后轮作2茬玉米的种植方式能通过调控土壤微生态来恢复土壤健康、促进下茬魔芋生长,有效缓解魔芋连作障碍的危害。
关键词:魔芋;连作障碍;种植方式;细菌群落结构;生长指标;相关分析
中图分类号:S632.3;S154.36 文献标志码:A 文章编号:2095-1191(2024)11-3255-10
Effects of different cropping systems on bacterial community structure in soil and growth of Amorphophallus konjac
WANG Wen-peng1, YE Chang-huan2, HUANG Zhen-yi2, HE Qiu-feng2,QU Kai-xing1*, WANG Zhu-hua2*
(1Academy of Science and Technology, Chuxiong Normal University, Chuxiong, Yunnan 675000, China; 2School of Resources Environment and Chemistry, Chuxiong Normal University, Chuxiong, Yunnan 675000, China)
Abstract:【Objective】To explore the effects of different cropping systems on soil bacterial community structure and growth of Amorphophallus konjac in the next crop,so as to provide scientific basis for improving soil microecological en‐vironment by rational cropping systems,and maintaining sustainable planting of A. konjac.【 Method】The high-throughput sequencing technology was used to analyze the differences of soil bacterial community structure and diversity under the cropping systems: A. konjac has never been cultivated( N),A. konjac was planted as the previous crop( R),maize was planted for 1 year after A. konjac has been harvested (L1),and maize was planted for 2 years after A. konjac has been harvested( L2). The effects of soil microecology formed under different planting systems on the growth of A. konjac in the next crop were studied by analyzing the physical and chemical properties of soil before planting A. konjac in the next crop,and the seed germination rate,seedling survival rate,plant height,leaf length,fresh weight of tuber per plant of A. konjac. 【Result】The electrical conductivity, contents of organic matter,alkali hydrolyzed nitrogen,available potassium in the soil sample of R were significantly higher than those in the soil samples of N and L2( Plt;0.05,the same below). While pH in the soil sample of R was significantly lower than that in the soil samples of N and L2. The Sobs index,ACE index and Shannon index of soil bacterial communities in the 4 different cropping systems were Ngt;L2gt;L1gt;R. Principal coordinates analysis(PCoA) showed that the bacterial community structures of R and L1 treatments were similar,and were both greatly different from those of N and L2 treatments. The relative abundance of Proteobacteria,Myxococcota and Gemmati‐monadota in the soil sample of N treatment was significantly higher than that in R treatment,but the relative abundance of Chloroflexi in the soil sample of N treatment was significantly lower than that in R treatment. However,the relative abun‐dance of these 4 dominant bacterial phyla did not differ significantly between N and L2 treatments (Pgt;0.05,the same below). Correlation analysis showed that soil pH,electrical conductivity,organic matter content,alkali hydrolytic nitrogen content,available phosphorus content and available potassium content were significantly or extremely significantly(Plt;0.01,Plt;0.001) correlated with the relative abundance of dominant bacterial genera in soils such as Bacillus,Gaiella,Solirubrobacter,MND1 and Skermanella. There were no significant differences in the seed germination rate,seedling survival rate,plant height,leaf length and fresh weight of tuber per plant of A. konjac in the next crop between N and L2,and they were both significantly greater than those of R treatment. 【Conclusion】The cropping system of maize being planted for 2 years after harvesting A. konjac can restore soil health,promote the growth of A. konjac in the next crop, and effectively alleviate the continuous cropping obstacle of A. konjac by regulating soil microecology.
Key words: Amorphophallus konjac; continuous cropping obstacle; cropping systems; bacterial community struc‐ture; growth indicators; correlation analysis
Foundation items: Yunnan Fundamental Research Plan Projec(t 202201AU070193);Joint Special Project for Basic Research of Local Undergraduate Universities in Yunnan(202101BA070001-058);Chuxiong Normal University Doctoral Research Projec(t BSQD2103)
0 引言
【研究意义】魔芋(Amorphophallus konjac)为天南星科魔芋属多年生草本植物,是已知自然界中能大量提供葡甘聚糖的重要经济作物,具有较高的商业价值(何斐等,2020)。随着魔芋产品的不断开发,魔芋产业已成为陕西、四川、贵州、云南等地山区的支柱产业,也是近年来乡村振兴重点推广种植的作物之一(何斐等,2022)。然而,魔芋种植过程中存在严重的连作障碍问题,限制了魔芋产业的持续发展(He et al.,2023)。土壤微生物在维持作物健康生长方面发挥着重要作用,其群落结构组成和多样性是土壤生态环境的重要指标(杨敏等,2018)。细菌在土壤微生物中占比最大,是土壤中最活跃的因素,也是土壤健康的重要指标,在促进作物生长方面发挥关键作用(He et al.,2023)。不同种植方式会对土壤细菌的群落结构和多样性产生影响(苏燕等,2020),土壤细菌群落结构变化也常被用于揭示不同种植方式对土壤微生态环境产生的影响(洪洁等,2019)。连作对下茬作物生长所造成的消极影响与土壤微生态环境的变化有较大关系,而合理的种植方式能有效调控土壤微生物群落,改善土壤性质,提高作物种植效益(韩芳等,2021),是缓解连作负面影响的有效方法(姚姿婷等,2021)。因此,探明不同种植方式对土壤细菌群落结构及下茬魔芋生长的影响,能更好地掌握魔芋种植系统中土壤的健康状况,对选择合适的种植方式来缓解魔芋连作障碍危害及实现魔芋产业的健康发展具有重要意义。【前人研究进展】轮作栽培具有改善土壤微生态环境、减轻作物病害及充分利用农业资源等优势,是目前公认的缓解连作障碍最经济有效的措施(王天乐等,2022),但需在考虑种植效益的基础上合理选择换茬作物以及具体的种植方式(金鑫等,2022)。有研究表明,魔芋—玉米轮作栽培能有效降低魔芋软腐病的发病率和植株死亡率,是生产上应用较广泛的魔芋种植方式(张红骥等,2012);魔芋和湖北贝母一年两熟的周年轮作栽培模式对防控魔芋病害无明显影响,但能增加魔芋种植的经济效益(刘二喜等,2014);珠芽魔芋与羊肚菌的周年轮作模式也能促进魔芋植株的生长发育,降低魔芋病害的发病率(冉滨竭,2023)。土壤微生物群落结构变化是造成作物连作障碍的重要因子之一(Wang et al.,2020;Luo et al.,2021),而不同种植方式会通过影响土壤性质进而调控土壤细菌群落结构。刘株秀等(2019)利用高通量测序技术对不同种植方式下大豆土壤细菌群落结构进行分析,发现轮作5年和13年长期连作均显著增加了土壤的pH和养分含量,提高了细菌群落的Chao1指数和Shannon指数,认为土壤理化性质是细菌群落结构发生变化的主要驱动因子;苏燕等(2020)研究表明,种植模式是影响土壤细菌群落变化的主要因素,水旱轮作模式可提高土壤细菌群落的多样性;宋秀丽等(2022)研究发现,休耕—大豆轮作和小麦—大豆轮作有利于土壤细菌群落丰度和多样性的形成,不同种植方式下土壤化学性质的差异影响着土壤细菌群落结构;王天乐等(2022)研究了甘蓝、菜豆和玉米3种作物组合成的10种轮作模式下土壤细菌群落结构和多样性的变化及其对作物产量的影响,发现菜豆—菜豆—玉米轮作方式对作物产量和土壤富营养优势细菌的综合影响最好;阳圣莹等(2022)研究发现,草莓—苜蓿轮作增加了土壤细菌的丰富度和多样性。【本研究切入点】目前,关于不同种植方式改善土壤性质、调控土壤微生物群落结构、促进作物生长的研究报道已较多(周岚等,2013;郭丰源等,2018;宋秀丽等,2022;王天乐等,2022),但针对魔芋种植系统中不同种植方式调控土壤微生态环境、缓解魔芋连作障碍的相关研究较少。【拟解决的关键问题】采用田间试验,比较不同种植方式下土壤细菌群落结构和多样性的差异,并与土壤理化性质指标进行关联分析,揭示不同种植方式形成的土壤微生态对下茬魔芋生长的影响,为合理利用种植方式改善土壤微生态环境及维持魔芋的可持续种植提供科学依据。
1 材料与方法
1. 1 试验地点及试验材料
试验地位于云南省楚雄彝族自治州大姚县铁锁乡铁锁社区(26°7′20″N,100°57′17″E,海拔1832.7 m),年平均气温16.0 ℃,无霜期275 d,年平均降水量667.50 mm。试验区内近3年栽培的玉米品种均为红单6号,供试魔芋为当地主栽品种花魔芋。
1. 2 试验方法
1. 2. 1 试验设计 选取地域相邻、田间管理措施相似但种植方式不同的4个田块,分别为从未种植过魔芋(N)、前茬作物为魔芋(R)、种植魔芋后轮作1茬玉米(L1)和种植魔芋后轮作2茬玉米(L2)。分别将各田块划分为3个重复小区,每小区面积为1.80 m×5.00 m。于2023年4月选择顶芽健康露白的种芋(50±5 g),按40 cm×40 cm的株行距统一垄作栽培下茬魔芋,每小区60株;同常规大田魔芋生产,统一田间水肥管理。魔芋出苗后,分别调查各小区魔芋出苗率;魔芋展叶后,在株高恒定的情况下测定各处理植株的叶长和株高;魔芋收获期,调查各小区魔芋存苗率后,将魔芋块茎完整挖出,去掉泥土,称量统计单株块茎鲜重。
1. 2. 2 土壤样品采集 于2023年4月,在种植下茬魔芋前采集土壤样品,采用五点采样法分别采集4个田块的耕层(0~20 cm)土壤;将5个点的样品混匀合为1个样品后装入干净的无菌自封袋中,每个田块重复3次形成3个生物学重复。采集到的12份土壤样品运回实验室后,剔除植物残体和石块等杂物。将每个土壤样品分为2份:第1份放入5 mL离心管中于-80 ℃冰箱保存,用于土壤微生物DNA提取和高通量测序分析;第2份在室温下自然风干后保存于自封袋中,用于土壤理化性质测定。
1. 2. 3 土壤理化性质测定 参照鲍士旦(2000)的方法,测定分析各土样的理化性质:土壤碱解氮含量采用NaOH碱解扩散法测定,土壤有效磷含量采用NaHCO3浸提—钼锑抗显色法测定,土壤速效钾含量采用NH4OAc浸提—火焰光度法测定,土壤有机质含量采用外加热重铬酸钾氧化—容量法测定;按水土比2.5∶1进行前处理后用酸度计测定土壤pH,按水土比5∶1进行前处理后用电导仪测定土壤电导率。
1. 2. 4 土壤微生物总DNA提取及16S rRNA基因高通量测序 使用E.Z.N.A.® Soil DNA Kit土壤DNA提取试剂盒(Omega Bio-Tek,USA)提取各土壤样品的总基因组DNA,利用超微量紫外分光光度计NanoDrop 2000检测DNA纯度和浓度,通过1% 琼脂糖凝胶电泳检测DNA完整性(电压5 V/cm,时间为20 min)。以提取的各土壤样品总基因组DNA为模板,选择特异引物对338F(5'-ACTCCTACGGGA GGCAGCAG-3')/806R(5'-GGACTACHVGGGTWT CTAAT-3')扩增细菌16S rRNA基因的V3~V4区,每个样本3个PCR重复。使用上海美吉生物医药科技有限公司的Miseq PE300平台进行上机测序。根据Cutadapt质量控制流程对原始数据进行质量过滤,使用UCHIME算法检测并删除嵌合序列。使用Uparse v7.0.1001进行序列分析,将相似度≥97%的序列归属为相同的操作分类单元(OTU),并注释筛选出具有代表性的序列。为得到代表性序列的分类学信息,使用Silva数据库(Version132)基于Mothur算法对16S rRNA基因进行注释。基于样本中的最小测序数据量,对每个样本的数据进行归一化处理。根据标准化的OTUs丰度信息对土壤微生物的群落结构和多样性进行分析。
1. 3 统计分析
采用Excel 2019整理数据,使用SPSS 20.0对不同处理间的差异显著性进行单因素方差分析。利用主坐标分析(PCoA)和相似性分析(ANOSIM)展示各土壤样品中细菌群落结构的差异,构建柱状图用于分析和展示土壤细菌群落的相对丰度;结合土壤理化性质分析结果,用Spearman相关分析和Average聚类分析揭示土壤理化性质与土壤微生物群落结构的相关性。
2 结果与分析
2. 1 不同种植方式土壤理化性质分析
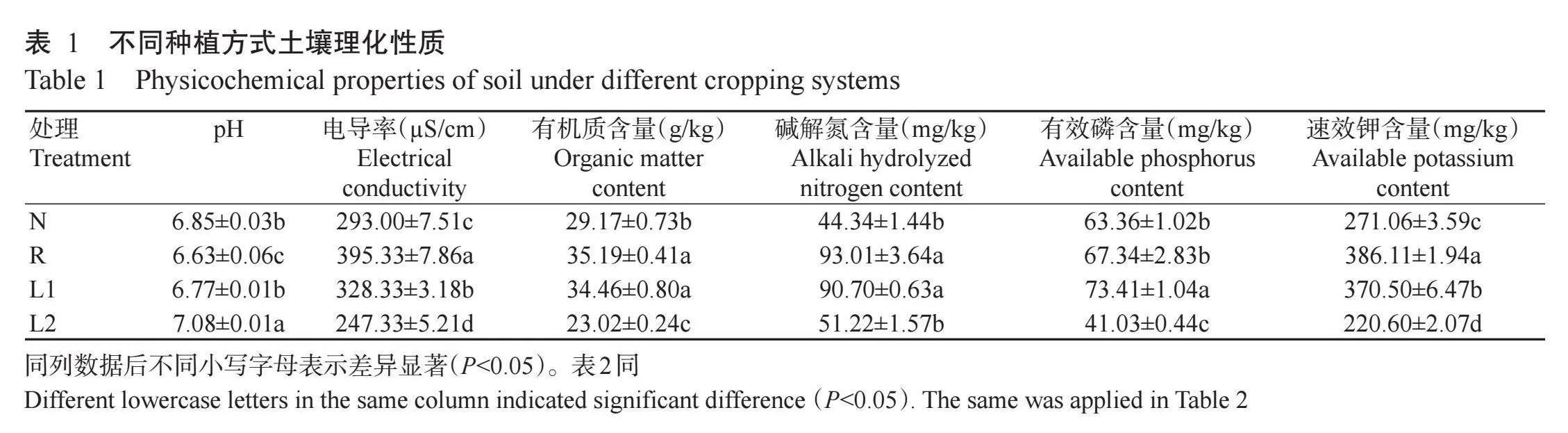
对4种不同种植方式土壤样品的理化性质进行分析,结果(表1)表明,N处理碱解氮含量最低,与L2处理差异不显著(Pgt;0.05,下同),但二者均显著低于R和L1处理(Plt;0.05,下同);R处理的土壤pH最低,与其他处理差异显著,而电导率和速效钾含量则显著高于其他处理,有机质和碱解氮含量显著高于N和L2处理;L1处理的土壤有效磷含量最高,显著高于其他处理。L2处理的土壤pH显著高于其他处理,而电导率及有机质、有效磷和速效钾含量均显著低于其他处理。
2. 2 不同种植方式土壤细菌群落多样性分析
通过高通量测序,从12个土壤样品中共生成746747条有效序列;在97%序列相似度水平上,共得到21141个OTUs;每个处理的覆盖率均在97.00%以上,表明本次测序数据量足够,测序深度可真实反映土壤细菌群落结构的实际情况,测序结果可靠。对土壤细菌群落的Alpha多样性进行分析,结果(表2)显示,土壤细菌群落的Sobs指数、ACE指数和Shan‐non指数均表现为N处理gt;L2处理gt;L1处理gt;R处理;表明种植方式会影响土壤细菌群落多样性,种植魔芋后土壤细菌群落物种组成的丰富度和多样性均降低,轮作玉米则能在一定程度上恢复土壤的细菌群落多样性。
2. 3 不同种植方式土壤细菌群落结构分析
将4个不同处理的16S rRNA基因高通量测序数据在OTU水平进行PCoA分析和ANOSIM分析,探究种植方式对土壤细菌群落结构的影响(图1)。ANOSIM分析结果显示,不同种植方式对土壤细菌群落结构具有显著影响(R=0.7716,P=0.0010)。PCoA分析结果显示,4个处理的土壤细菌群落结构被显著分开形成3簇;R和L1处理的土壤细菌群落结构之间无明显界限,聚成一簇,且均与N和L2处理的土壤细菌群落结构距离较远。表明前茬作物为魔芋的土壤和种植魔芋后轮作1茬玉米的土壤具有相似的细菌群落结构,且与未种植过魔芋及种植魔芋后轮作2茬玉米的土壤细菌群落结构存在明显差异。
2. 4 不同种植方式土壤细菌群落组成分析
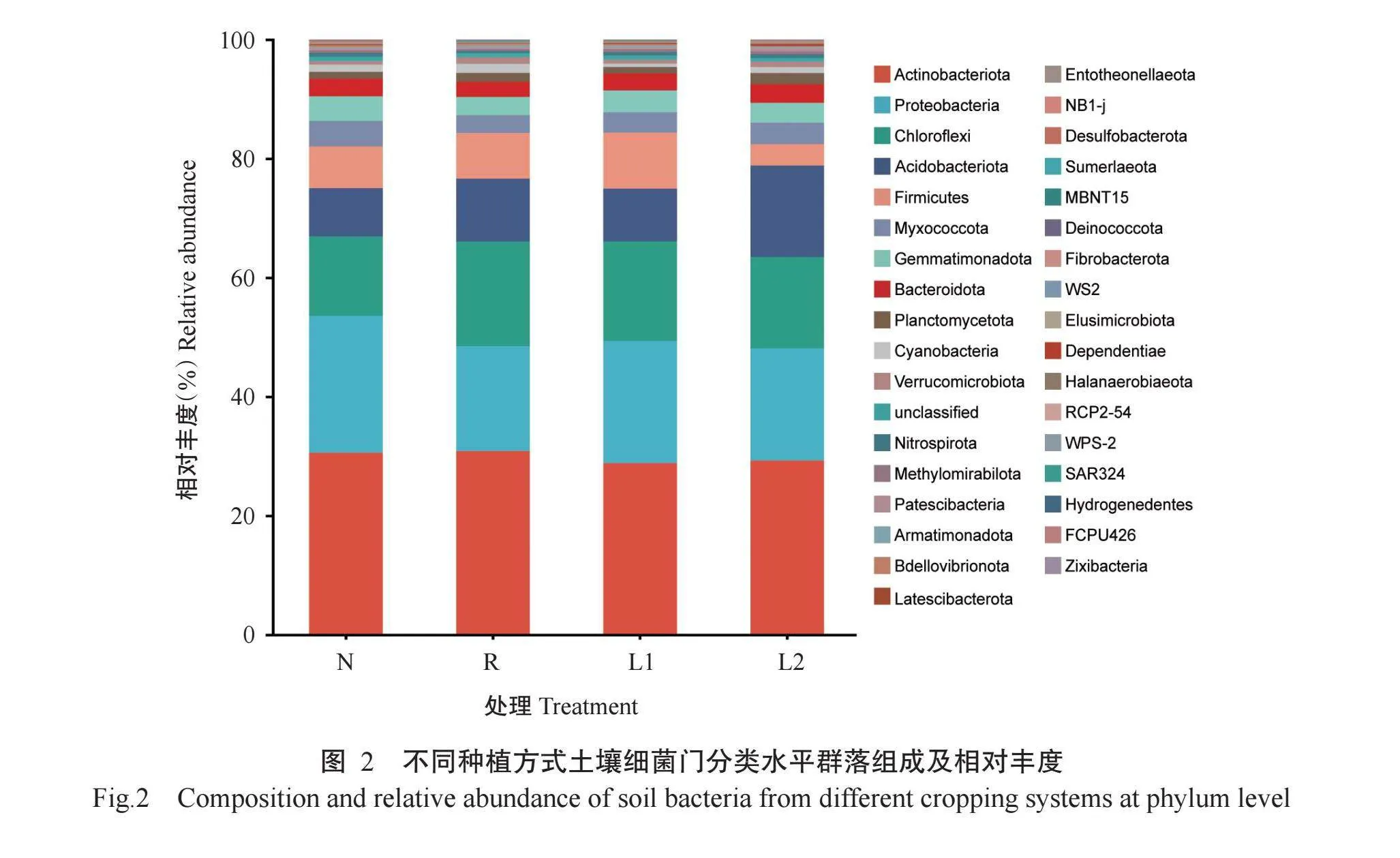
2. 4. 1 土壤细菌群落在门分类水平上相对丰度的差异分析 如图2所示,在门分类水平上,从12个土壤样品中检测到的细菌均归类到35个门类。不同土壤优势细菌门的构成较相似,在不同处理土壤中相对丰度均gt;1%的优势门有9个,分别为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)、黏球菌门(Myxococcota)、芽单胞菌门(Gemmatimonadota)、拟杆菌门(Bacteroidota)和浮霉菌门(Planctomycetota)。此外,N处理土壤中蓝藻门(Cyanobacteria)的相对丰度及R处理土壤中蓝藻门和疣微菌门(Verrucomicrobiota)的相对丰度也均gt;1%。
如图3所示,在相对丰度gt;1%的11个优势细菌门中,放线菌门、拟杆菌门、浮霉菌门、蓝藻门和疣微菌门的相对丰度在各处理间差异均不显著。变形菌门、黏球菌门和芽单胞菌门的相对丰度均在N处理中最大,在R处理中最小;且N处理中变形菌门和芽单胞菌门的相对丰度均显著高于R处理,黏球菌门在N处理中的相对丰度显著高于R和L1处理。绿弯菌门的相对丰度则是N处理最小,且显著低于R处理。变形菌门、黏球菌门、芽单胞菌门和绿弯菌门的相对丰度在N和L2处理间的差异均不显著。酸杆菌门相对丰度以L2处理最大,显著大于N和L1处理。厚壁菌门相对丰度在L2处理中最小,且与其他处理差异显著。以上结果表明,种植方式能改变土壤中细菌优势门类的相对丰度,进而影响土壤细菌群落结构的组成。
2. 4. 2 土壤细菌群落在属分类水平上相对丰度的差异分析 由表3可知,在属分类水平上,相对丰度gt;1%的优势细菌属共有13个。其中,9个属隶属于放线菌门,3个属隶属于变形菌门,1个属隶属于厚壁菌门。N处理中有12个相对丰度gt;1%的优势细菌属,R和L2处理中均有10个相对丰度gt;1%的优势细菌属,L1处理中有9个相对丰度gt;1%的优势细菌属。在13个优势细菌属中,类诺卡氏菌属(Nocar-dioides)、芽殖球菌属(Blastococcus)、小单胞菌属(Micromonospora)、火山岩海球菌属(Marmoricola)、鞘氨醇单胞菌属(Sphingomonas)和MND1的相对丰度在4个处理间差异不显著;节杆菌属(Arthrobacter)在L1处理中的相对丰度显著大于在N和R处理中的相对丰度,在N处理中的相对丰度显著小于在L1和L2处理中的相对丰度;链霉菌属(Streptomyces)在R处理中的相对丰度显著大于在L2处理中的相对丰度;盖亚菌属(Gaiella)在N处理中的相对丰度显著大于在L2、R和L1处理中的相对丰度,在L1处理中的相对丰度显著小于在N和L2处理中的相对丰度;土壤红杆菌属(Solirubrobacter)在N处理中的相对丰度显著大于在L1处理中的相对丰度;白蚁菌属(Isoptericola)在R处理中的相对丰度显著大于在N、L2和L1处理中的相对丰度;微枝形杆菌属(Microvirga)在N处理中的相对丰度显著大于在L2处理中的相对丰度;芽孢杆菌属(Bacillus)在L1处理中的相对丰度显著大于在N和L2处理中的相对丰度,在L2处理中的相对丰度显著小于在N、R和L1处理中的相对丰度。
2. 4. 3 土壤细菌群落组成与土壤理化性质的相关分析 对不同种植方式土壤的理化性质与土壤中优势细菌属(相对丰度为Top15)进行Spearman相关分析和Average聚类(图4),发现土壤理化性质大致分为3类:碱解氮和有效磷为一类,电导率、有机质和速效钾为一类,土壤pH为一类。其中,碱解氮含量与芽孢杆菌属呈显著正相关,与土壤红杆菌属和盖亚菌属呈显著或极显著(Plt;0.001)负相关;有效磷含量与芽孢杆菌属呈极显著(Plt;0.001)正相关,与盖亚菌属和土壤红杆菌属呈显著或极显著(Plt;0.01)负相关;电导率、有机质含量和速效钾含量与芽孢杆菌属呈显著或极显著(Plt;0.01)正相关,速效钾含量还与盖亚菌属和MND1呈显著负相关;土壤pH与盖亚菌属、MND1和斯科曼氏球菌属(Skermanella)呈显著正相关,与芽孢杆菌属呈极显著(Plt;0.01)负相关;而类诺卡氏菌属、节杆菌属、链霉菌属、白蚁菌属、小单胞菌属、火山岩海球菌属、鞘氨醇单胞菌属、微枝形杆菌属、芽殖球菌属和壤霉菌属(Agromyces)与土壤理化性质的相关性均不显著。可见,不同细菌群落受土壤理化性质影响的情况存在较大差异,土壤pH、电导率、有机质含量、碱解氮含量、有效磷含量和速效钾含量主要与芽孢杆菌属、盖亚菌属、土壤红杆菌属、MND1和斯科曼氏球菌属等土壤中优势细菌属的相对丰度呈显著或极显著相关。
2. 5 不同种植方式对魔芋生长的影响
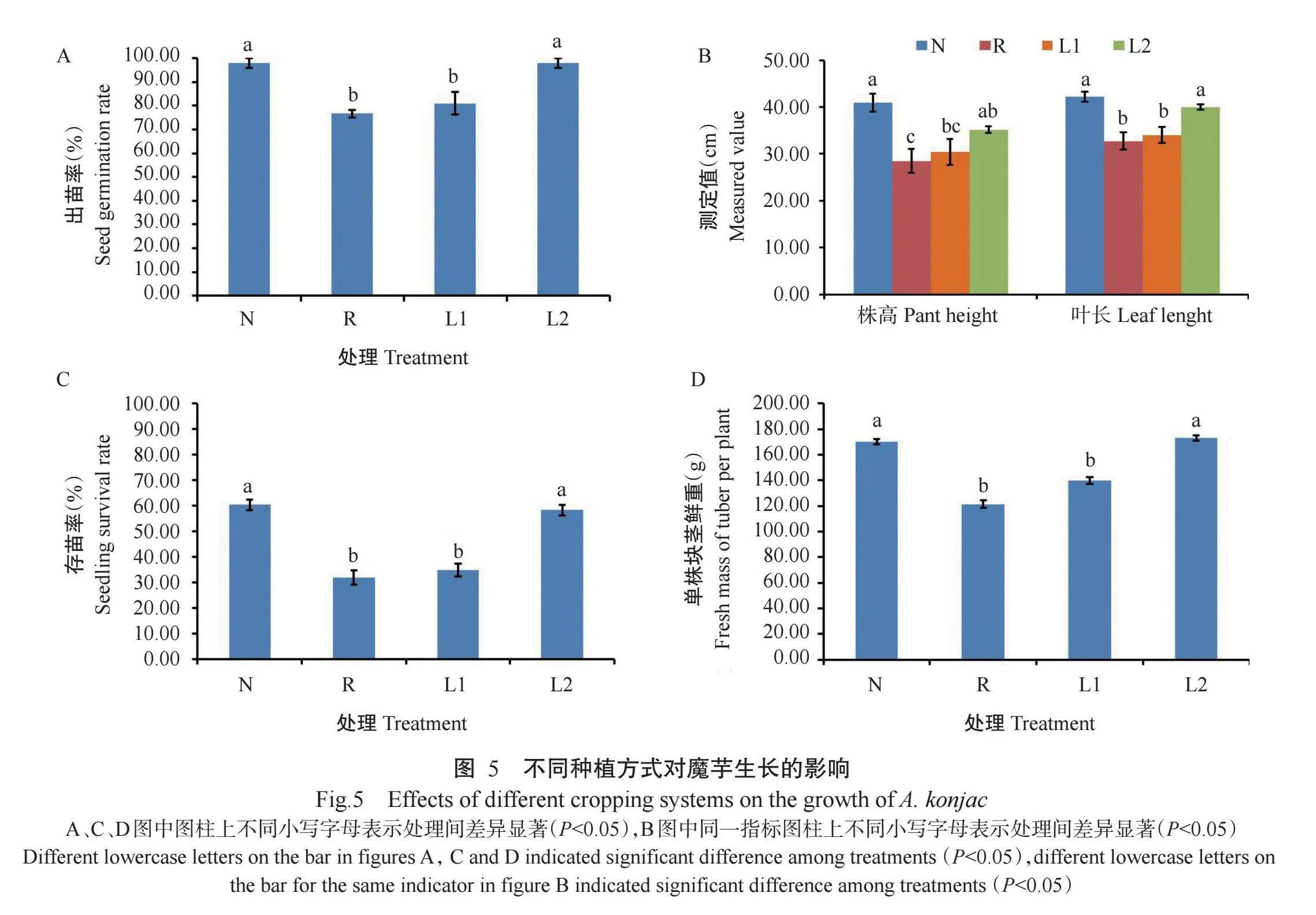
分析不同种植方式对下茬魔芋生长的影响,结果如图5所示,下茬魔芋的出苗率、存苗率、株高、叶长和单株块茎鲜重均为N处理最高,R处理最低;L1处理的魔芋各项生长指标与R处理均无显著差异,L2处理的魔芋各项生长指标与N处理差异不显著;但N和L2处理的魔芋出苗率、存苗率、叶长和单株块茎鲜重均显著高于R和L1处理,株高显著高于R处理。
3 讨论
连作障碍问题在魔芋种植地区较常见,了解土壤理化性质及土壤微生物群落结构的变化有助于更好地掌握魔芋种植系统中土壤的健康状况。前人研究发现,随着魔芋连作年限的延长,土壤养分含量增加,土壤pH、魔芋生物量和根系活性降低,推测土壤养分含量变化与魔芋生长条件变化有关(He et al.,2023)。在同一地块长期种植相同作物可能会导致土壤性质恶化、养分失调(刘株秀等,2019;宋秀丽等,2022)。本研究中,前茬种植作物为魔芋的土壤电导率及有机质、碱解氮和速效钾含量均显著高于未种植过魔芋的土壤,pH则显著低于未种植过魔芋的土壤。种植魔芋后土壤养分增加可能与过量施用化肥有关(Xiong et al.,2015),而植株化感物质的积累和氮肥的施用则可能是导致土壤酸化的关键因素(He et al.,2023)。土壤环境的变化会影响微生物群落的种类、分布和活性,不同种植方式则会改变土壤环境(姚姿婷等,2021)。据报道,番茄—水稻轮作能缓解土壤酸化、降低土壤盐分含量(王克磊等,2017);大豆连作显著增加了土壤有机质、有效氮、有效钾、有效锌和有效铁含量,轮作栽培则消耗了土壤中有机质、有效氮、有效铁和有效锰等多种养分(宋秀丽等,2022)。土壤中营养元素的利用和转化效率在不同作物的种植方式下存在较大差异,这可能是种植方式引起土壤性质发生改变的主要因素(宋秀丽等,2022)。种植魔芋后轮作2茬玉米的土壤pH显著高于前茬种植作物为魔芋的土壤pH,而电导率及有机质、碱解氮、有效磷和速效钾含量均显著低于前茬种植作物为魔芋的土壤,表明轮作玉米能有效
缓解土壤养分失调和土壤酸化问题。
土壤微生物群落结构与土壤环境密切相关,种植方式会引起土壤理化性质的变化,进而改变微生物群落结构(宋秀丽等,2022)。连作会降低土壤质量、影响土壤微生物群落,不利于植株生长(Huang et al.,2013;韩芳等,2021)。细菌群落多样性通常被认为是土壤维持生态系统平衡及恢复生态功能的重要指标(阳圣莹等,2022)。魔芋连作会破坏土壤细菌群落多样性,细菌群落多样性指数随着连作时间的增加而下降(He et al.,2023)。本研究结果也表明种植魔芋后土壤细菌群落多样性降低,轮作玉米则在一定程度上恢复了土壤细菌群落多样性。通过轮作方式可改善土壤性质、定向调节土壤微生物群落,优化土壤微生态环境(韩芳等,2021)。本研究中,前茬作物为魔芋的土壤细菌群落结构与未种植过魔芋的土壤细菌群落结构之间存在显著差异,表明种植魔芋会引起土壤细菌群落结构的变化;前茬作物为魔芋的土壤与轮作1茬玉米后的土壤细菌群落结构之间无明显差异,但与轮作2茬玉米后的土壤细菌群落结构存在显著差异,表明种植1茬魔芋后至少要轮作2茬玉米才会起到调控土壤细菌群落结构的作用。此外,本研究中放线菌门、变形菌门、绿弯菌门、酸杆菌门、厚壁菌门、黏球菌门、芽单胞菌门等均为土壤中的优势细菌门,与前人研究结果相似(He et al.,2023;何斐等,2024)。不同种植方式会改变农田土壤优势细菌类群的相对丰度,进而影响细菌群落结构的组成(宋秀丽等,2022)。种植魔芋降低了土壤中变形菌门、黏球菌门和芽单胞菌门3个优势门的相对丰度,增加了绿弯菌门的相对丰度;而轮作2茬玉米后,这4个优势细菌门的相对丰度恢复到与未种植过魔芋的土壤同一水平。种植不同作物会改变土壤的理化性质进而影响微生物的生存环境,利用不同种植方式能改变土壤中优势细菌的相对丰度,进而影响土壤中细菌群落结构(韩芳等,2021)。土壤微生物群落在土壤养分循环中起至关重要的作用,土壤微生物生物量或群落组成的变化会导致土壤质量的变化(He et al.,2023)。土壤性质对土壤微生物群落同样有显著影响,土壤pH被认为是土壤细菌群落组成的主要驱动因素(Wu et al.,2017)。也有研究表明土壤有机质、有效磷、有效铜、有效锰等养分含量与土壤细菌群落相关性更大(宋秀丽等,2022)。据报道,土壤有机质和有效氮含量增加会促进细菌多样性的形成(Li et al.,2018),土壤养分的积累会增加变形菌门的相对丰度(Zeng et al.,2017),土壤中有效磷含量与变形菌门和拟杆菌门相对丰度显著相关,有机质含量与放线菌门和酸杆菌门相对丰度均显著相关(宋秀丽等,2022)。本研究通过相关分析发现,土壤pH与盖亚菌属、MND1、斯科曼氏球菌属和芽孢杆菌属显著或极显著相关,碱解氮和有效磷含量与芽孢杆菌属、盖亚菌属和土壤红杆菌属显著或极显著相关,速效钾含量与盖亚菌属、MND1和芽孢杆菌属显著或极显著相关,电导率和有机质含量与芽孢杆菌属极显著相关。推测不同种植方式主要是通过引起土壤理化性质的变化进而调控土壤微生物的群落结构和多样性。种植方式、土壤性质和土壤微生物群落结构之间具有相关性,且不同种植方式对土壤理化性质、各类土壤细菌群落的影响均不一致(宋秀丽等,2022)。
土壤微生物直接影响着植物对水分、养分的吸收,与植物的生长发育密不可分,是反映土壤活性和土壤健康的重要指标(He et al.,2023)。有研究证实,魔芋连作会改变土壤肥力状况和微生物区系,进而形成连作障碍,影响魔芋的正常生长(杨敏等,2018)。与前人研究相似,本研究发现连作降低了魔芋的出苗率、存苗率、株高、叶长和单株块茎鲜重,严重影响魔芋植株的生长。这可能是由长期种植魔芋导致土壤酸度增加、养分失衡、微生物区系发生改变所引起。据报道,连作会降低土壤中潜在有益菌的相对丰度,增加潜在有害细菌的相对丰度,这可能是造成魔芋植株生长不良的重要因素(He et al.,2023)。轮作体系中前茬作物能显著影响土壤性质、改善根际微生物群落结构,进而影响土壤的微生态环境;魔芋与玉米轮作是控制魔芋病害的主要措施,可显著降低魔芋植株的死亡率(张红骥等,2012)。本研究中,与魔芋连作相比,种植魔芋后轮作1茬玉米的种植方式对下茬魔芋的生长无显著影响,但种植魔芋后轮作2茬玉米的种植方式提高了下茬魔芋的出苗率、存苗率、株高、叶长和单株块茎鲜重。基于研究结果,为维持土壤健康,促进魔芋产业的持续发展,种植魔芋后需至少轮作2茬玉米才能恢复土壤的微生态环境,缓解连作障碍的危害,保障下茬魔芋的正常生长。
4 结论
不同种植方式会引起土壤理化性质和微生物群落结构的变化,进而影响下茬作物的生长。种植魔芋增加了土壤电导率及有机质、碱解氮和速效钾含量,降低了土壤pH,引起土壤中优势细菌相对丰度的变化,进而改变土壤细菌群落结构,影响下茬魔芋的生长。通过轮作种植的方式可改善土壤性质、定向调节土壤微生物群落,优化土壤微生态环境。种植魔芋后轮作2茬玉米能提高土壤pH、平衡土壤养分、恢复土壤微生物群落结构和多样性,有效缓解连作障碍的危害。
参考文献((References)):
鲍士旦. 2000. 土壤农化分析[M]. 北京:中国农业出版社. [Bao S D. 2000. Soil agrochemical analysis[M]. Beijing:China Agriculture Press.]
郭丰源,王博文,李文鹏,牛秋红. 2018. 小麦—玉米轮作体系中土壤细菌菌群结构及多样性分析[J]. 麦类作物学报,38(5):623-630.[ Guo F Y,Wang B W,Li W P,Niu Q H. 2018. Structure and diversity analysis of bacterial commu‐nities in the wheat-maize rotation field soi[l J]. Journal of Triticeae Crops,38(5):623-630.] doi:10.7606/j.issn.1009-1041.2018.05.17.
韩芳,包媛媛,刘项宇,张新永,韦灯会,张浩然,田清龙. 2021. 不同轮作方式对马铃薯根际土壤真菌群落结构的影响[J]. 生态环境学报,30(7):1412-1419.[ Han F,Bao Y Y,Liu X Y,Zhang X Y,Wei D H,Zhang H R,Tian Q L. 2021. Effects of different potato rotation patterns on fungal community structure in rhizosphere soi[l J]. Ecology and Environmental Sciences,30(7):1412-1419.] doi:10.16258/j.cnki.1674-5906.2021.07.010.
何斐,崔鸣,李川,鲁小东. 2020. 菌剂与钾肥配施对连作魔芋生长、生理代谢和发病率的影响[J]. 西北农业学报,29(7):1095-1105. [He F,Cui M,Li C,Lu X D. 2020. Effects of gent and potassium fertilizer on plant growth,physiological metabolism and disease incidence in continu‐ous cropping of Amorphophallus konjac[J]. Acta Agricul‐turae Boreali-occidentalis Sinica,29(7):1095-1105.] doi:10.7606/j.issn.1004-1389.2020.07.015.
何斐,田孝威,雷雨俊,邵永春,毛洁,卢谢敏,王莹,段园鹏,刘富强. 2022. 连作花魔芋软腐病株与健株根域丛枝菌根真菌群落多样性[J]. 微生物学报,62(8):3092-3108. [He F,Tian X W,Lei Y J,Shao Y C,Mao J,Lu X M,Wang Y,Duan Y P,Liu F Q. 2022. Diversity of arbuscular mycorrhizal fungi in the root zone of Amorphophallus kon‐jac with and without soft rot under continuous cropping[J]. Acta Microbiologica Sinica,62(8):3092-3108.] doi:10.13343/j.cnki.wsxb.20210747.
何斐,刘欢,李川,崔鸣,魏梦琳,丁龙飞,刘斌,段杉. 2024. 间作刺槐对魔芋根际细菌群落结构及软腐病发生的影响[J]. 核农学报,38(4):755-766.[ He F,Liu H,Li C,Cui M,Wei M L,Ding L F,Liu B,Duan S. 2024. Effects of intercropping with robinia pseudoacacia on rhizosphere bacterial community structure and soft rot disease develop‐ment in Amorphophallus konjac[J]. Journal of Nuclear Agricultural Sciences,38(4):755-766.] doi:10.11869/j.issn.1000-8551.2024.04.0755.
洪洁,康建依,刘一倩,高秀芝,易欣欣. 2019. 生菜连作及生菜-菠菜轮作对土壤细菌群落结构的影响[J]. 生物技术通报,35(8):17-26.[ Hong J,Kang J Y,Liu Y Q,Gao X Z,Yi X X. 2019. Effects of continuous cropping of lettuce and rotation of lettuce-spinach on soil bacterial community structure[J]. Biotechnology Bulletin,35(8):17-26.] doi:10.13560/j.cnki.biotech.bull.1985.2019-0182.
金鑫,何翠,曾旭. 2022. 国内魔芋栽培模式研究进展[J]. 农学学报,12(1):65-69.[ Jin X,He C,Zeng X. 2022. Advances on cultivation modes of Amorphophallus konjac in China[J]. Journal of Agriculture,12(1):65-69.] doi:10.11923/j.issn.2095-4050.cjas2021-0095.
刘二喜,杨朝柱,郑小江,陈勇,牟方贵,赵青华,降巧龙. 2014. 花魔芋与湖北贝母一年两熟轮作栽培新模式研究 [J]. 中国农学通报,30(31):186-191.[ Liu E X,Yang C Z,Zheng X J,Chen Y,Mou F G,Zhao Q H,Jiang Q L. 2014. Study on the new two crops a year rotation cultiva‐tion model of konjac and fritillaria[J]. Chinese Agricul‐tural Science Bulletin,30(31):186-191.]
刘株秀,刘俊杰,徐艳霞,张武,米刚,姚钦,王光华. 2019. 不同大豆连作年限对黑土细菌群落结构的影响[J]. 生态学报,39(12):4337-4346.[ Liu Z X,Liu J J,Xu Y X,Zhang W,Mi G,Yao Q,Wang G H. 2019. Effects of continuous cropping years of soybean on the bacterial community structure in black soi[l J]. Acta Ecologica Sinica,39(12):4337-4346.] doi:10.5846/stxb201801270212.
冉滨竭. 2023. 珠芽魔芋与羊肚菌轮作栽培研究初探[D]. 成都:四川农业大学.[ Ran B J. 2023. A preliminary study on the rotation cultivation of Amorphophallus bulbifer and Morchella[D]. Chengdu:Sichuan Agricultural University.] doi:10.27345/d.cnki.gsnyu.2023.000196.
宋秀丽,黄瑞龙,柯彩杰,黄蔚,章武,陶波. 2022. 不同种植方式对连作土壤细菌群落结构和多样性的影响[J]. 生态环境学报,31(3):487-496.[ Song X L,Huang R L,Ke C J,Huang W,Zhang W,Tao B. 2022. Effects of different crop‐ping systems on bacterial community structure and diver‐sity in continuous cropping soil[J]. Ecology and Environ‐mental Sciences,31(3):487-496.] doi:10.16258/j.cnki. 1674-5906.2022.03.007.
苏燕,李婕,曹雪颖,莫宛,郑虚,姚姿婷,邹承武. 2020. 水旱轮作模式下马铃薯根际土壤细菌群落多样性分析[J]. 南方农业学报,51(10):2374-2382.[ Su Y,Li J,Cao X Y,Mo W,Zheng X,Yao Z T,Zou C W. 2020. Diversity analysis of bacterial community in potato rhizosphere soil under the mode of paddy-upland rotation[J]. Journal of Southern Agriculture,51(10):2374-2382.] doi:10.3969/j.issn.2095-1191.2020.10.008.
王克磊,周友和,黄宗安,朱隆静,徐坚. 2017. 水旱轮作对土壤性状及作物产量的影响[J]. 蔬菜,(5):21-23.[ Wang K L,Zhou Y H,Huang Z A,Zhu L J,Xu J. 2017. Effects of paddy-upland rotation on the characteristics of soils and crop yields[J]. Vegetables,(5):21-23.] doi:10.3969/j.issn. 1001-8336.2017.05.010.
王天乐,王晓娟,刘恩科,史向远. 2022. 甘蓝、菜豆和玉米不同轮作组合对淡褐土细菌群落和作物产量的影响[J]. 农业环境科学学报,41(2):375-386.[ Wang T L,Wang X J,Liu E K,Shi X Y. 2022. Effects of different crop rotation combinations of cabbage,kidney bean,and maize on bacte‐rial community and crop yield in light brown soi[l J]. Jour‐nal of Agro-Environment Science,41(2):375-386.] doi:10. 11654/jaes.2021-1258.
杨敏,裴卫华,董家红,潘开华,吴德喜,余磊. 2018. 魔芋连作对根际土壤微生物数量及酶活性的影响[J]. 北方园艺,(23):110-115. [Yang M,Pei W H,Dong J H,Pan K H,Wu D X,Yu L. 2018. Effect of long-term continuous crop‐ping with Amorphophallus konjac on rhizosphere soil microflora and enzyme activities[J]. Northern Horticulture,(23):110-115.] doi:10.11937/bfyy.20181013.
阳圣莹,朱润华,白胜,梁秋屏,李轶骥,夏武奇. 2022. 轮作对设施草莓土壤细菌群落多样性的影响[J]. 山西农业大学学报(自然科学版),42(5):27-36.[ Yang S Y,Zhu R H,Bai S,Liang Q P,Li Y J,Xia W Q. 2022. Effects crop rota‐tion on the diversity of soil bacterial community in the strawberry cultivation facilities[J]. Journal of Shanxi Agri‐cultural University( Natural Science Edition),42(5):27-36.] doi:10.13842/j.cnki.issn1671-8151.202206028.
姚姿婷,杨炎昌,姚潇,何团,郑虚,蒙炎成,邹承武. 2021. 不同轮作模式对马铃薯根际土壤真菌群落的影响[J]. 南方农业学报,52(5):1255-1262.[ Yao Z T,Yang Y C,Yao X,He T,Zheng X,Meng Y C,Zou C W. 2021. Effects of different crop rotation modes on fungal community in potato rhizosphere soi[l J]. Journal of Southern Agriculture,52(5):1255-1262.] doi:10.3969/j.issn.2095-1191.2021.05.015.
张红骥,邵梅,杜鹏,卢俊,何霞红,于德才,朱有勇. 2012. 云南省魔芋与玉米多样性栽培控制魔芋软腐病[J]. 生态学杂志,31(2):332-336.[ Zhang H J,Shao M,Du P,Lu J,He X H,Yu D C,Zhu Y Y. 2012. Effects of diversity culti‐vation of konjac and maize in controlling konjac’s soft rot disease in Yunnan Province,Southwest China[J]. Chinese Journal of Ecology,31(2):332-336.] doi:10.13292/j.1000- 4890.2012.0040.
周岚,杨永,王占海,陈阜,曾昭海. 2013. 玉米—大豆轮作及氮肥施用对土壤细菌群落结构的影响[J]. 作物学报,39(11):2016-2022. [Zhou L,Yang Y,Wang Z H,Chen F,Zeng Z H. 2013. Influence of maize-soybean rotation and N fertilizer on bacterial community composition[J]. Acta Agronomica Sinica,39(11):2016-2022.] doi:10.3724/SP.J.1006.2013.02016.
He F,Li C,Liu L P. 2023. Effect of continuous cropping of kon‐jac(Amorphophallus konjac)on soil bacterial communities as evaluated by Illumina high-throughput sequencing[J]. Archives of Agronomy and Soil Science,69(10):1878-1892. doi:10.1080/03650340.2022.2124405.
Huang L F,Song L X,Xia X J,Mao W H,Shi K,Zhou Y H,Yu J Q. 2013. Plant-soil feedbacks and soil sickness:From mechanisms to application in agriculture[J]. Journal of Chemical Ecology,39(2):232-242. doi:10.1007/s10886-013-0244-9.
Li J,Wen Y C,Li X H,Li Y T,Yang X D,Lin Z,Song Z Z,Cooper J M,Zhao B Q. 2018. Soil labile organic carbon fractions and soil organic carbon stocks as affected by long-term organic and mineral fertilization regimes in the North China Plain[J]. Soil and Tillage Research,175:281-290. doi:10.1016/j.still.2017.08.008.
Luo L F,Wang L T,Deng L M,Mei X Y,Liu Y X,Huang H C,Du F,Zhu S S,Yang M. 2021. Enrichment of Burkholde-ria in the rhizosphere by autotoxic ginsenosides to alle-viate negative plant-soil feedback[J]. Microbiology Spec‐trum,9(3):e0140021. doi:10.1128/Spectrum.01400-21.
Wang W P,Wang Z H,Yang K,Wang P,Wang H L,Guo L W,Zhu S S,Zhu Y Y,He X H. 2020. Biochar application all-eviated negative plant-soil feedback by modifying soil microbiome[J]. Frontiers in Microbiology,11:799. doi:10.3389/fmicb.2020.00799.
Wu J P,Jiao Z B,Guo F L,Zhou J,Qiu Z M,Ding Z L. 2017. Effects of cultivation duration and mode on the microbial diversity of the Amorphophallus konjac rhizosphere[J]. African Journal of Agricultural Research,12(23):1970-1979. doi:10.5897/AJAR2017.12304.
Xiong W,Li Z G,Liu H J,Xue C,Zhang R F,Wu H S,Li R,Shen Q R. 2015. The effect of long-term continuous crop‐ping of black pepper on soil bacterial communities as determined by 454 pyrosequencing[J]. PLoS One,10(8):e0136946. doi:10. 1371/journal.pone.0136946.
Zeng Q C,An S S,Liu Y. 2017. Soil bacterial community response to vegetation succession after fencing in the grass‐land of China[J]. Science of the Total Environment,609:2-10. doi:10.1016/j.scitotenv.2017.07.102.
(责任编辑 王晖)

