人工诱导泥鳅雌核发育的细胞学研究和诱导参数优化
钟汶蓉 陶彬彬* 徐 闻, 谭 娟 罗红瑞宋焱龙 陈 戟 胡 炜, *
(1.大连海洋大学, 大连 116023; 2.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 湖北洪山实验室,武汉 430072; 3.中国科学院大学, 北京 100049; 4.怀化学院, 怀化 418000)
雌核发育(Gynogenesis)是指需要两性亲缘种精子的刺激而促使卵子活化, 导致卵子只依靠雌性原核进行发育的一种特殊生殖方式[1,2]。人工诱导雌核发育技术通常指卵子在遗传灭活的外源精子刺激下, 经染色体加倍过程后完全在母本遗传信息控制下的发育[3], 该技术在鱼类种质纯化和全雌养殖鱼类品种培育等方面发挥了重要作用。通过物理或化学方式进行人工雌核发育研究, 已获得多种淡水、海水鱼类的雌核发育后代, 如鲤(Cyprinus carpio)[4]、黄鳝(Monopterus albus)[5]、草鱼(Ctenopharyngodon idella)[6]、半滑舌鳎(Cynoglossus semilaevis)[7]和牙鲆(Cynoglossus semilaevis)[8]等。
泥鳅(Misgurnus anguillicaudatus)属于鲤形目、鳅科、花鳅亚科的泥鳅属, 对环境具有极强的适应性, 是广泛分布于亚洲地区的重要淡水经济鱼类。泥鳅素有“水中人参”的美誉, 因其肉质细嫩、味道鲜美[9]、营养价值高, 越来越受到消费者的青睐; 近年来, 泥鳅的市场需求量一直维持在较高的水平,2021年我国泥鳅养殖产量达到36.7086万吨[10], 泥鳅具有生长的性别二态性, 雌性个体比雄性更大、生长更快[11], 培育全雌泥鳅养殖新品种具有巨大的市场前景。自然水体中存在着二倍体、三倍体、四倍体、五倍体和六倍体[12]等不同倍性的泥鳅, 染色体倍性操作是泥鳅育种的研究重点之一, 如人工诱导泥鳅雌核发育二倍体[13], 人工诱导四倍体泥鳅雄核发育二倍体[14], 二倍体泥鳅与四倍体泥鳅杂交[15]等。国内外相关研究一般是通过正交实验来获得泥鳅倍性操作的条件[16,17], 缺乏二倍体泥鳅雌核发育的细胞层面的研究。
本研究通过细胞观察追踪减数分裂过程中遗传物质的变化特征, 获得人工诱导泥鳅雌核发育的热休克参数, 利用该参数成功实现泥鳅雌核发育的人工诱导, 并进一步通过核型和流式细胞技术对雌核发育的泥鳅胚胎进行检测分析, 确定其倍性。本研究旨在建立精准的泥鳅雌核发育技术提供指导。
1 材料与方法
1.1 亲本来源及催产方法
野生性成熟泥鳅(雌30尾及雄6尾)购买自湖南省怀化市集贸市场, 性成熟雄性黄河鲤(Cyprinus carpio)来自中国科学院水生生物所官桥养殖基地。泥鳅在实验室暂养1周, 水温26—28℃, 溶氧>5 mg/L, 保证饵料充足。在人工繁殖前1d, 雌泥鳅每尾经腹鳍下注射鲤垂体1 mg, HCG 50 IU, 雄泥鳅剂量减半; 雄鲤每公斤经胸鳍下注射鲤垂体2 mg, HCG 1000 IU。
1.2 异源精子灭活
选一尾雄鲤挤出精液, 按1∶4的比例加入Hanks’ Balanced Salt Solution (C0218, Beyotime)稀释。加水激活精子, 解剖镜下观察精子活力并计时,若雄鲤的精子能快速开始游动且能持续游动50s以上, 则认为具有足够的活力。玻璃皿中加入稀释后的鲤精液1 mL, 厚度约1—2 mm。玻璃皿下垫碎冰降温, 放于上方带有紫外灯的摇床上进行精子灭活。照射前10min打开2支平行30 w紫外灯, 照距25 cm。照射10min后每1min镜检一次并计时, 若大部分雄鲤的精子遇水后呈“醉汉状”游动且只能游动20s以下, 则停止照射, 冰上避光保存。
1.3 人工授精及热休克处理
通过热休克处理二倍体泥鳅与黄河鲤精子自交/杂交受精卵。挤出雄鳅精液, 用hanks保存液稀释备用。雌鳅挤出成熟卵子, 12尾雌鳅卵子各分为5份, 3份分别与200 μL泥鳅精子, 200 μL黄河鲤精子, 200 μL灭活黄河鲤精子人工授精, 两份与200 μL灭活黄河鲤精子人工授精, 混匀后加入少量曝气水。加水后开始计时, 在第2min30s/3min30s将受精卵置于40—41℃进行热休克处理刺激, 热休克持续2min。获得以下5种组合: A组(野生型组, 二倍体泥鳅卵×二倍体泥鳅精子)、B组(杂交组, 二倍体泥鳅卵×黄河鲤精子)、C组(未热休克组, 二倍体泥鳅卵×灭活黄河鲤精子, 不进行热休克)、D1组(雌核发育组, 二倍体泥鳅卵×灭活黄河鲤精子, 2min30s进行热休克)和D2组(雌核发育组, 二倍体泥鳅卵×灭活黄河鲤精子, 3min30s进行热休克)。置于24—26℃水温孵化, 于9h、48h和168h统计受精率、畸形率和存活率, 在25h剥去卵膜进行形态学观察, 50h进行形态学观察。
1.4 受精细胞学观察
以A(野生型组)为对照组, 对B(杂交组)、C(未热休克组)和D2(雌核发育组)的胚胎发育早期过程进行荧光受精细胞学观察。取样时间分别为人工授精后0、1min、2min、3min、4min、5min、6min、7min、8min、9min和10min, 每时间段取卵20—30个。先室温下用4%多聚甲醛溶液固定卵24h, 再用4%多聚甲醛4℃固定48h。在体视显微镜(SZ61, Olympus)下剥去卵膜, 0.1% Triton X-100溶液37℃金属浴3min; 用PBS溶液清洗3次, DAPI(C1006, Beyotime) 染色液避光染色30min, 在抗荧光淬灭剂(BMU104-CN, Abbkine)中保存, 保存时间不超过12h。利用活体光切层照显微镜(SP8 DLS,Leica)进行观察并拍照记录。
1.5 胚胎染色体数目统计
取A(野生型组)、B(杂交组)、C(未热休克组)和D2(雌核发育组)四组受精后24h胚胎各20—30个, 撕去卵膜与卵黄, 用0.08%秋水仙素(C804812, Macklin)处理3h, 1%柠檬酸钠低渗20min,用预冷的卡诺固定液(甲醇∶冰醋酸=3∶1)固定3次,每次20min, 4℃低温过夜。于1.8 m高处滴片, 酒精灯烤干。选择中期分裂相用正置荧光显微镜(DM4B, Leica)拍照并计数。
1.6 DNA含量测定
以二倍体泥鳅体细胞DNA含量作为对照, 利用微流颗粒成像分析系统(CytoFlex S, Beckman)检测以下各试验样品DNA含量。取父母本泥鳅以及黄河鲤尾静脉血1 μL, 用200 μL Sysmex-Partec/CyStain®DNA 1step(05-5004, Merck millipore)染液稀释成一定浓度, 经细胞过滤网过滤后进行测定。取获得的每组受精后48h胚胎各10尾, 用1 mg/mL胶原酶Ⅳ(C8160, Solarbio) 37℃消化4h后, 用200 μL Sysmex-Partec/CyStain®DNA 1step染色, 经细胞过滤网过滤后进行测定。
1.7 数据处理
采用Excel统计, 数据均表示为平均值±标准差。分析均使用GraphPad Prism 9进行。两组数据之间的差异通过独立样本t检验的方法进行检测。在所有统计学比较中,P<0.05为差异显著。
2 结果
2.1 泥鳅卵细胞第二次减数分裂细胞学观察
对四组(野生型组、杂交组、未热休克组和雌核发育组)人工授精后的泥鳅受精卵进行共聚焦3D时序成像。如图1a, 在24—26℃水温条件下, 单个泥鳅精子通过卵子受精孔进入内部, 促使卵子第二次减数分裂完成, 分裂成卵核以及第二极体。0—3min内, 精子逐渐向卵核靠近, 泥鳅卵内染色体聚拢在一起, 整齐地排列在赤道板上, 卵核与第二极体还未分开; 至5min, 观察到染色体已经分开为两份, 向着相反方向移动, 即第二极体已经与卵核分开;8min时, 仍可以观察到有精子还未与卵核结合的情况; 10min时, 可观察到第二极体正远离受精核向外排出。当鲤精子作为异源精子通过受精孔进入卵子, 刺激泥鳅卵完成第二次减数分裂的共聚焦3D时序成像如图1b, 在3—5min内, 泥鳅卵核第二极体分开, 10min内鲤精核与泥鳅卵核并未融合。当灭活的鲤精子通过受精孔进入卵子, 刺激泥鳅卵完成第二次减数分裂的细胞观察时序图如图1c, 在4—6min内, 泥鳅卵核第二极体分开。当灭活的鲤精子通过受精孔进入卵子, 刺激泥鳅卵完成第二次减数分裂,并在人工授精后3min30s进行2min热休克, 细胞观察时序图如图1d, 在3—5min内, 泥鳅卵核第二极体分开, 精核在向卵核靠近时, 第二极体并未向外排出,且10min以后, 未观察到有卵核、第二极体及精核的图像, 表明此时卵核已经向卵子内部移动。

图1 不同处理组受精卵受精细胞学观察Fig.1 Fertilization cytology observation of fertilized eggs in different groups
2.2 确定人工诱导泥鳅减数分裂雌核发育参数
统计野生型、杂交型、单倍体和雌核发育组胚胎9h、48h和168h后的受精率、畸形率、存活率,各组数据进行两两比较的结果如表1。结果显示野生型组(组A)的受精率和存活率最高、畸形率最低,且与其他组有显著性差异(P<0.05); 杂交组(组B)与未热休克组(组C)鱼苗全部发育畸形, 且在开口前(7d内)全部死亡; 对比两个雌核发育组(组D1, 在人工授精后2min30s后热休克; 组D2, 在人工授精后3min30s后热休克)的数据, 发现人工授精后3min30s开始热休克比人工授精后2min30s开始热休克产生的受精率和存活率更高, 畸形率更低, 但是两组间无显著性差异(P>0.05)。

表1 不同处理组胚胎的受精率、畸形率和存活率Tab.1 Fertilization rate, deformity rate, and survival rate of embryos in different groups
人工授精后25h及50h的不同处理组鱼苗的形态观察如图2所示。授精后25h野生型组(图2a) 、授精后50h野生型组(图2e)与授精后25h雌核发育组 (图2d) 、授精后50h雌核发育组(图2h)均为发育正常的鱼苗, 而授精后25h杂交组(图2b) 、授精后50h杂交组(图2f)与授精后25h未热休克组 (图2c) 、授精后50h未热休克组(图2g)的鱼苗发育畸形, 出现身体扭曲, 尾部短且弯曲, 水肿, 围心腔扩大、心血管畸形和黑色素增多等非正常形态。
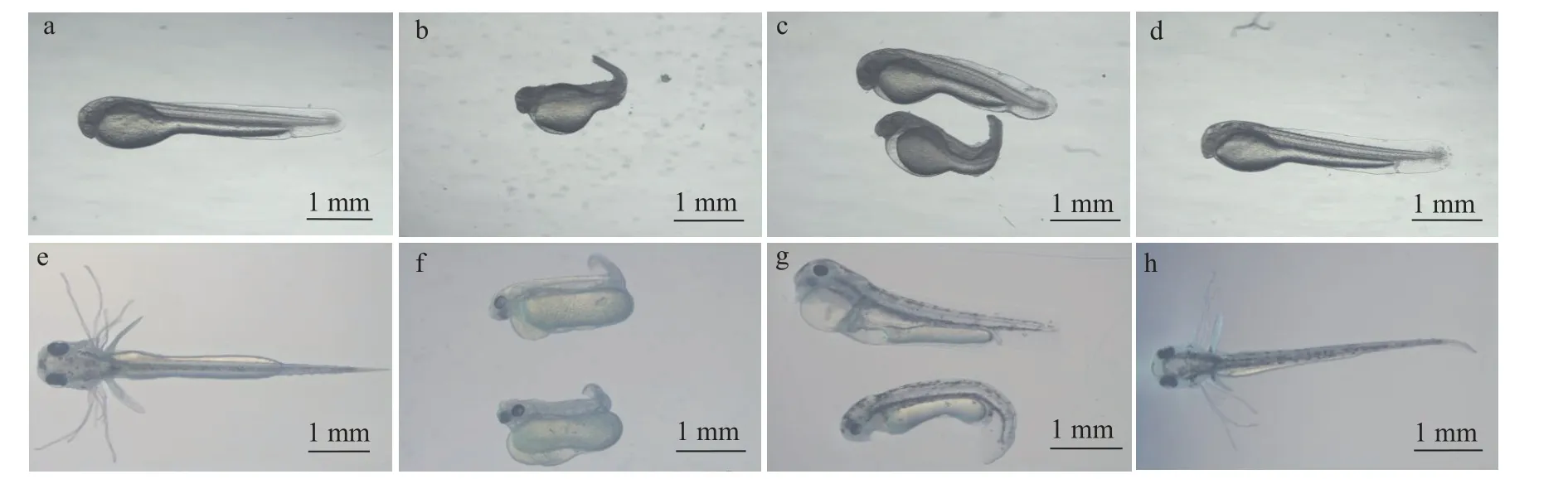
图2 不同处理组幼鱼的形态观察Fig.2 Morphological observation of juvenile fish in different groups
2.3 雌核发育泥鳅的染色体数目分析
通过染色体计数法分析A(野生型组)、B(杂交组)、C(未热休克组)、E(雌核发育组)4个处理组的染色体数目。结果表明, 不同处理组有不同频率的整倍体和非整倍体, 野生型组多为正常二倍体, 染色体数目如图3a (2n=50), 杂交组染色体数目近三倍体, 如图3b (n+n=68), 未热休克组染色体数目为正常单倍体如图3c (n=25), 雌核发育组二倍体染色体数目如图3d (2n=50)。
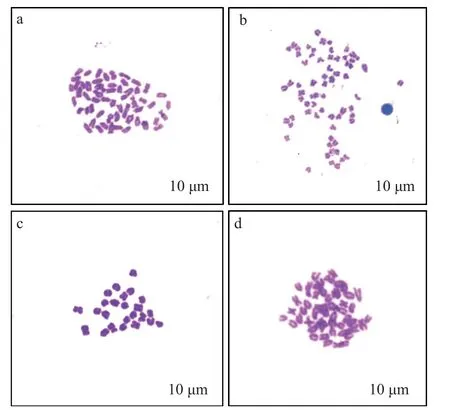
图3 不同处理组胚胎的中期分裂相染色体Fig.3 The metaphase chromosome of embryos in different groups
二倍率最高的是泥鳅精子与泥鳅卵人工授精的野生型组, 众数百分比为96.67%(图4a); 其次是雌核发育组, 二倍体众数(2n=50)百分比为64.71%(图4b); 杂交组出现n+n=75的众数百分比为0, 均不为25的整倍数(图4c); 未热休克组出现单倍体(n=25)的众数百分比为96.97%(图4d)。
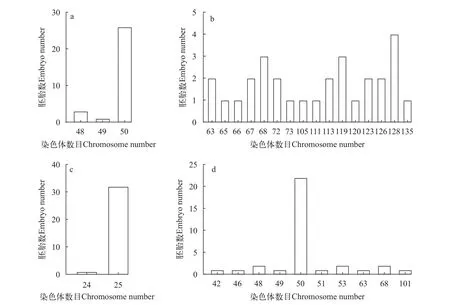
图4 不同处理组染色体数目分布Fig.4 Distribution frequency of the number of chromosome in embryos of different groups
2.4 雌核发育泥鳅的相对DNA含量分析
利用流式细胞仪对父母本二倍体泥鳅、黄河鲤、子代野生型组胚胎、杂交组胚胎、未热休克组胚胎、雌核发育组胚胎的核DNA相对含量进行测定(图5)。因为胚胎早期细胞分裂较为旺盛, 所以出现了几个峰值, 细胞频率高的是处在有丝分裂G0—G1期的细胞。父本泥鳅(图5a)、母本泥鳅(图5b)、黄河鲤(图5c)的DNA相对含量主要峰值在15—16, 野生型胚胎(图5d)的DNA相对含量主要峰值在15—16, 杂交组胚胎(图5e)的DNA相对含量主要在21—22, 单倍体胚胎(图5f)的DNA相对含量主要峰值在8—9, 雌核发育胚胎(图5g)的DNA相对含量主要峰值在15—16。通过比较可以看出, 杂交胚胎细胞的DNA相对含量是二倍体细胞的1.31—1.46倍, 未热休克胚胎细胞的DNA相对含量是二倍体的0.50—0.56倍, 雌核发育胚胎细胞的DNA相对含量与二倍体相差不大。上述结果表明, 杂交组胚胎既不是二倍体, 也不是三倍体, 未热休克胚胎为单倍体, 雌核发育胚胎为二倍体。
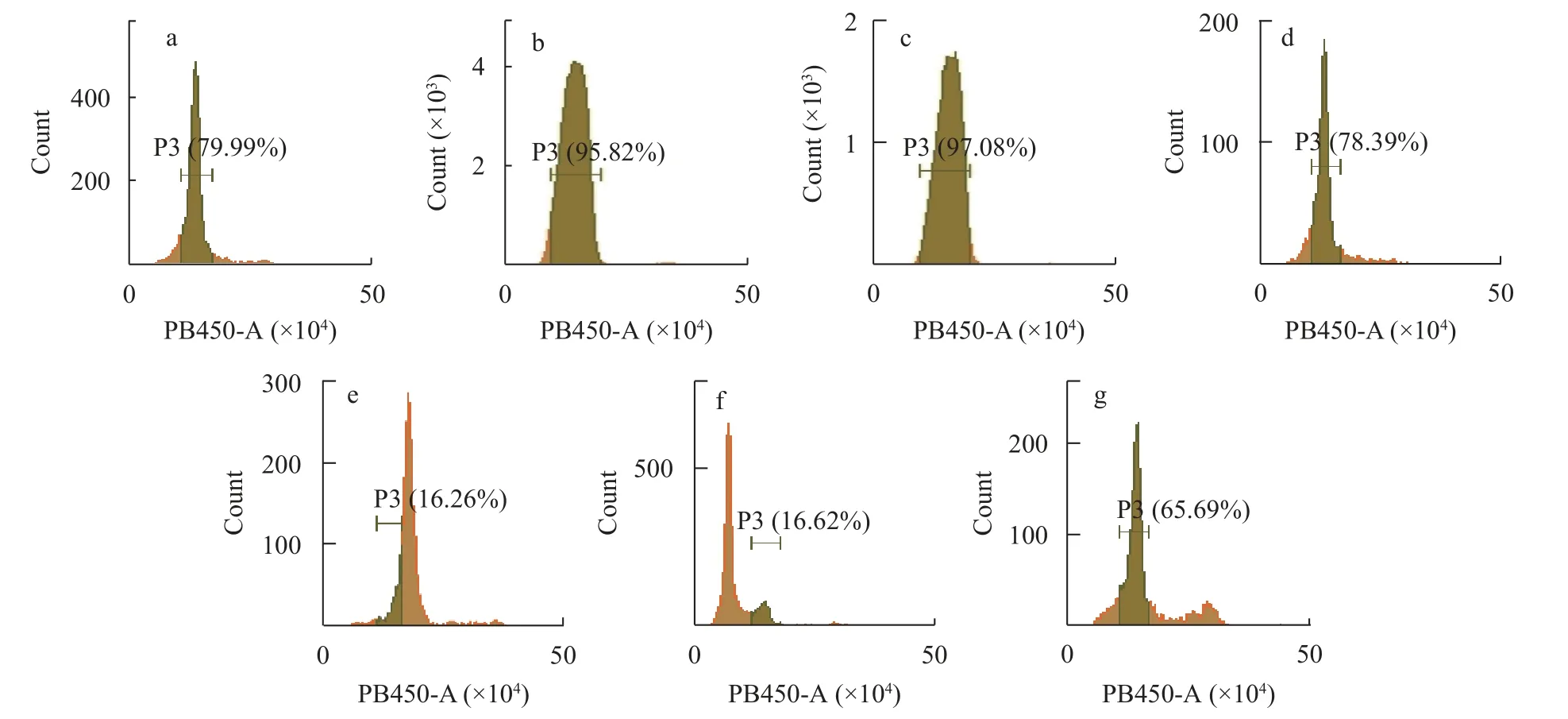
图5 不同处理组胚胎相对DNA含量Fig.5 Relative DNA contents in embryos of different groups
3 讨论
本研究通过共聚焦3D成像分析二倍体泥鳅卵的第二极体与卵核分开的过程, 获得了热休克人工诱导二倍体泥鳅雌核发育的参数。即在水温24—26℃条件下, 二倍体泥鳅卵子与紫外灭活的黄河鲤精子授精3min30s, 于41℃的热水中持续处理2min,常规孵化。利用该诱导参数, 本研究成功实现了人工诱导泥鳅减数分裂雌核发育, 并进一步通过分析实验泥鳅的染色体数目和相对DNA含量, 确定人工诱导的减数分裂雌核发育胚胎为二倍体。
细胞DNA荧光染色与共聚焦3D成像相结合的技术为研究鱼类生殖细胞减数分裂过程提供了新的技术手段, 如Zhang等[18]用了PI (碘化丙啶)红荧光和DAPI蓝荧光, 追踪了异育银鲫减数分裂染色体的动力学过程。本研究通过DAPI荧光染色后,采用光切层共聚焦3D显微成像的方法, 对泥鳅早期胚胎第二次减速分裂中期、第二次减速分裂后期以及精卵融合、第二极体排出的核变化过程进行了时序观察, 获得了二倍体泥鳅卵第二极体染色体与卵染色体分离的时间参数, 该方法与已报道的泥鳅受精过程及第二极体排出过程中细胞学观察法相比有明显的优势。在为数不多的泥鳅受精细胞学观察研究中, 胡雨等[19]通过扫描电镜检测和石蜡切片观察, 观察到二倍体泥鳅的受精后, 精子入卵时受精孔的表面及内部结构变化, 但是步骤较为复杂, 耗时较长。黄松钱等[20]使用了荧光染料DAPI,对诱导三倍体泥鳅受精卵及胚胎早期发育的遗传物质进行了追踪, 但在普通荧光显微镜下的图像可能出现卵表面黏附精子的干扰, 且不易看出卵子与精子空间上的相对位置。本研究通过DAPI染色结合共聚焦3D成像分析, 观察精子及卵子核移动的3D过程, 可以更为清晰地显示染色体的高度螺旋状态,并且排除背景的杂色干扰。研究温度休克处理对卵子的影响, 可以为建立精准的人工诱导雌核发育技术提供细胞学的理论依据。
在已报道的人工诱导泥鳅雌核发育的研究中,初步分析了第二极体形成和温度休克处理的时间点, 但不同学者的研究结果不同。如胡雨等[19]通过组织观察, 发现二倍体泥鳅第二极体形成的时间为授精后6—8min; 黄松钱等观察到二倍体泥鳅授精后5—10min第二极体已形成且未排出; 赵振山等[21]发现大鳞副泥鳅卵与泥鳅精子授精后6—9min时雌核膨胀后向卵子内部移动, 提示此时第二极体已经形成; 何进[22]通过正交实验发现二倍体泥鳅雌核发育授精后3min热休克的处理效果最佳; 林忠乔等[14]发现四倍体泥鳅雄核发育授精后5min冷休克的处理效果最佳。以上研究中, 第二极体形成和温度休克处理时间点的差异可能与卵子状态、干法授精及孵化时的水温、刺激卵子第二次减数分裂的精子来源的不同有关。本研究对比了在24—26℃水温条件下, 泥鳅卵子分别与泥鳅精子、鲤精子及灭活的鲤精子进行人工授精后第二次减数分裂的细胞学过程, 其中使用灭活鲤精子刺激后的泥鳅卵子分别进行热休克和未热休克两种方式处理。本研究观察到灭活的鲤精子刺激泥鳅卵第二极体分开的时间是授精后4—6min, 用未灭活的鲤精子刺激分开的时间是授精后3—5min, 而使用灭活的鲤精子刺激后又热休克, 泥鳅卵子第二极体与卵核分开的时间是授精后3—5min。不同卵子第二极体与卵核分开的时间点略有不同, 这主要受卵子质量的影响。将热休克的起始时间设置在我们观察到的第二极体与卵核最早出现分离后的30s, 即授精后3min30s, 并持续热休克处理2min。在此过程中, 泥鳅卵的第二极体与卵核逐渐开始分离。在热休克结束时, 即授精后5min30s, 基本所有的泥鳅第二极体与卵核已经分离, 使得热休克处理最大程度影响泥鳅第二极体与卵核分开的过程。因此, 本研究将人工诱导泥鳅雌核发育的热休克起始时间点优化为受精后3min30s, 持续热休克处理2min。比较发现, 泥鳅卵在灭活的鲤精子刺激后, 不进行热休克处理的卵子, 其第二极体形成时间相较于热休克处理的卵子稍晚, 精子的种类、精子的灭活和受精卵孵化水温度的变化是否对泥鳅第二次减数分裂过程的快慢有影响还需要进一步研究。
本研究诱导获得的雌核发育胚胎的畸形率为22.24%, 略高于授精3min后持续60min的冷休克畸形率(14.53%)[23]。但是, 本研究基于泥鳅雌核发育胚胎的细胞学特征建立的精准的人工诱导雌核发育技术, 通过热休克得到的胚胎二倍率达64.71%,高于授精后3min后持续2min的热休克(42.79%)、授精后3min后持续20min的冷休克(38.11%)。而且,本研究利用核型分析和流式细胞技术从染色体和DNA水平鉴定雌核发育诱导成功率, 相较于孵化率和正常苗率能更准确反映人工诱导泥鳅雌核发育的二倍化效率。热休克的持续时间通常比冷休克更短[24,25], 因此找到泥鳅减数分裂第二极体形成及排出的精确时间对于泥鳅减数分裂雌核发育的研究具有重要意义。本研究发现第二极体与卵核分离到第二极体完成排出的时间为授精后5—10min,长于本研究中热休克的持续时间2min。那么要对第二极体的排出进行干扰, 相较于在第二极体与卵核分开的早期进行热休克处理, 在第二极体与卵核分开的中后期对受精卵进行热休克处理的诱导效果是否会更好, 尚需要在未来的研究中进行分析。
综上所述, 本研究通过观察泥鳅第二次减数分裂时期卵染色体与第二极体染色体分离的过程, 基于细胞生物学特征, 优化了人工诱导泥鳅减速分裂雌核发育热休克的起始时间, 并利用优化的诱导参数条件, 成功得到雌核发育二倍体泥鳅子代。在核物质层面分析泥鳅减速分裂雌核发育的条件, 为建立精准的人工诱导雌核发育技术快速获得全雌的泥鳅新种质提供了可靠的技术支撑。

