不同功能型沉水植物对溶解氧影响及环境效应
李华歆 殷春雨 杨国梁 蔡 颖 黄晓龙 李宽意 关保华
(1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008; 2.中国科学院大学, 北京 100049;3.上海建桥学院有限责任公司, 上海 201306; 4.江苏省环境工程技术有限公司, 南京 210019)
随着富营养化加剧, 沉水植物大量丧失, 藻类水华频发, 水体呼吸作用增强, 全球淡水湖泊的溶解氧(Dissolved oxygen, DO)呈现明显下降趋势[1,2]。自1960年以来, 将近400个温带淡水湖泊表层水和底层水溶解氧浓度分别下降了0.45和0.42 mg/L,下降率达5.5%和18.6%, 远远超过海洋2%的下降速率[1,3]。此外, 全球变暖使水温升高, 溶解氧饱和度下降, 同时也促进了藻类在表层水中的生长, 大量沉降的藻类残体更加剧了底层水的缺氧状态[4]。溶解氧下降会导致沉积物中氮、磷等营养元素的释放通量增加, 加重湖泊富营养化[5], 促进甲烷和氧化亚氮等温室气体的排放[6]; 缺氧还会引起好氧/厌氧微生物的群落格局发生逆转, 导致鱼类和无脊椎动物大量死亡, 湖泊生物多样性丧失[2]。
恢复沉水植被能够缓解湖泊溶解氧下降的趋势[7]。沉水植物是浅水湖泊沿岸带重要的生境塑造者与功能维持者, 是湖泊从浊水态向清水态转变并维持的关键[8,9]。向湖泊释放氧气是沉水植物的重要功能之一[10]。然而, 由于沉水植物生长形态差异对功能的影响远大于物种多样性, 因此研究功能性状与溶解氧浓度提升之间的关系, 有利于沉水植物群落的构建和管理[11,12]。以往的研究虽然关注了沉水植物功能性状与氮、磷营养盐之间的关系[13—16],但尚未关注功能性状与水体溶解氧的关系。
沉水植物是在水下进行光合作用的[17], 产生的氧气一部分通过植冠释放进入水柱, 一部分通过根系分泌到沉积物中[7,18,19], 植冠和根系的功能性状差异将会影响释放到水柱和沉积物的氧气量和溶解氧的作用范围。底层型沉水植物[20]生物量多贴近沉积物附近, 一般具有相对较多的根; 冠层型沉水植物生物量多集中在水面附近, 植冠大, 一般根较少[21]。本文假设: 底层型沉水植物在沉积物-水界面释放氧气, 提高沉积物溶解氧浓度, 对沉积物理化性质影响较大; 冠层型沉水植物在水柱上层释放氧气, 提高水柱中溶解氧浓度, 对水柱水质影响较大。为验证以上假设, 本研究分别以刺苦草(Vallisneria spinulosaYan)代表底层型沉水植物, 以穗花狐尾藻(Myriophyllum spicatumL.)代表具根的冠层型沉水植物, 以黑藻[Hydrilla verticillata(L.f.)Royle]代表少根的沉水植物, 在相同的生长条件下,测定功能性状差异, 以及水体和沉积物理化性质的变化, 以期深入理解不同功能性状的沉水植物对溶解氧的影响及其环境效应, 为改善富营养化湖泊溶解氧下降问题中沉水植物的群落功能性状配置提供精准指导。
1 材料与方法
1.1 实验设置
实验在中国科学院南京地理与湖泊研究所太湖湖泊生态系统野外观测站东山分站(120°25′17.23″E,31°2′0.75″N)完成, 实验从2021年8月16日开始, 在2021年10月13日结束。实验用沉水植物来自于该站周边池塘。选取带有根系的单株(去掉克隆植株或分枝)刺苦草、黑藻和穗花狐尾藻, 在具有底泥的圆形桶内预培养1周左右。在实验开始时, 从预培养桶内挑选健壮且株高一致的刺苦草[株高(35.10±4.10) cm; 单株鲜重(8.26±0.36) g; 叶片数10.50±1.60;根冠比为0.13]、黑藻[株高(25.60±5.70) cm; 单株鲜重(1.53±0.27) g; 分枝数4.30±1.80; 无根]和穗花狐尾藻[株高(47.50±7.00) cm; 单株鲜重(3.36±0.29) g;无分枝; 根冠比为0.04]进行种植。
实验在东山站户外水泥池中进行, 水泥池长100 m, 宽50 m。水泥池仅作为摆放实验桶的场所并起到一定的降温作用, 其水位维持在50 cm左右,不超过实验桶, 不影响实验结果[22]。在水泥池中心位置(避免水泥池壁遮挡阳光)放入16个大塑料桶,容积为300 L (高84 cm, 上直径74 cm, 下直径60 cm),分两排间隔20 cm放置。抽取周边池塘的水, 经超滤网(80目)过滤后盛入大塑料桶中, 水深保持74 cm,当蒸发导致水位下降时, 补充抽滤后的水。实验用水总氮和总磷的初始值分别为(0.45±0.04) mg/L和(14.51±0.60) μg/L。实验共4个组, 每组4个重复, 分别为空白对照组、刺苦草组、黑藻组和穗花狐尾藻组。为了取样方便, 在大桶中不铺设底泥, 但在每个大桶中分别放置2个塑料小桶(高38 cm, 上直径30 cm, 下直径27 cm, 体积20 L)。实验开始时(2021年8月16日), 采集周边池塘的底泥, 晾晒3d, 加水过筛混匀后铺设10 cm到小塑料桶底部。底泥初始TC含量为(9.44±0.06) mg/g, TN (1.13±0.01) mg/g, TP (0.46±0.01) mg/g, 铝Al(54.97±0.31) mg/g, 铁Fe(30.56±0.35) mg/g, 钙Ca(6.95±0.05) mg/g, 锰Mn(0.54±0.01) mg/g, 锌Zn(0.06±0.00) mg/g。每个小桶种植3株植物, 呈三角形均分小桶空间, 植物下部插入底泥。
1.2 实验方法
实验室测量水中的TN、TP和叶绿素a(Chl.a)浓度。TN经碱性过硫酸钾法测定, TP经钼酸铵法测定, Chl.a运用多段分光光度法测定。选取3个连续晴天(2021年9月3日—9月5日, 水温在28—33℃),使用YSI在凌晨5:00(日出时间5:30左右)至傍晚19:00(日落时间18:30左右)每隔2h测量水中溶解氧、电导率、温度和pH。测量时将YSI (Pro Plus)探头放入水面以下25—30 cm的位置, 稳定1—2min后记录数据。测量溶解氧时, 刺苦草、黑藻和穗花狐尾藻平均生物量(鲜重)分别为680.48、555.25和194.16 g/m2。
在实验结束时, 选择晴天, 在13:00(植物光合作用达到最强时)左右测量沉积物溶解氧。将便携式溶氧仪(JPB-607A型, 上海仪电科学仪器股份有限公司)的探针从植物根际插入沉积物, 从沉积物表层0 cm开始, 每隔2 cm做一次记录。利用带刻度水枪抽取表层沉积物(0—2 cm), 装入50 mL离心管,以4000 r/min转速, 离心20 min, 将上清液经过0.45 μm玻璃纤维膜过滤[23]后获得沉积物间隙水, 用于测量间隙水溶解性总磷(TDP)浓度。另取一部分沉积物冷冻干燥后磨碎, 测定TN、TP和TC及与磷的沉积关系密切多价态金属元素[24]的含量。TN和TC含量通过元素分析仪(Euro Vector-EA3000, 意大利)测定, TP和金属元素含量通过电感耦合等离子体发射光谱仪(Leeman-Prodigy, 美国)测定。
收获植物, 自来水冲洗干净之后, 用慢性滤纸吸取植物表面水分, 测量其株高、根长和生物量(鲜重, 烘干后测干重)等形态指标。 为避免重叠,将植株叶片和根系展开, 利用扫描仪(EPSON Expresslon 12000XL-J331B, 日本精工爱普生株式会社)扫描叶片和根, 利用专业软件WinRHIZO统计植株总叶面积和总根长。使用表1中的公式计算比叶面积、比根长、相对生长速率、根冠比和叶面积指数等指标。
1.3 统计分析
各组间实验结束时水中TN、TP、Chl.a、间隙水TDP和植物各指标, 以及沉积物TN、TP、TC和总Fe均用单因素方差(One-way-ANOVA)分析, 各处理差异性比较用LSD法。1d内不同时段水中溶解氧和不同深度沉积物溶解氧数据利用一般线性模型进行重复测量方差分析(Repeated Measurement ANOVAs)。以上统计分析均使用SPSS.26软件进行处理。在方差分析前, 数据均通过正态分布和方差齐性检验。显著性水平为P<0.05。
2 结果
2.1 植物功能性状差异
植物叶和根特征黑藻的比叶面积(图1A)显著大于刺苦草和穗花狐尾藻(P<0.05), 刺苦草也显著大于穗花狐尾藻(P<0.05)。黑藻叶面积指数(图1B)最高, 刺苦草略低, 二者均显著大于穗花狐尾藻(P<0.05)。黑藻根极少, 无法计算根相关的指标。刺苦草比根长高于穗花狐尾藻但无显著差异(图1C;P>0.05), 但单株总根长显著高于穗花狐尾藻(图1D;P<0.05)。

图1 三种植物在收获时的比叶面积(A)、叶面积指数(B)、比根长(C)和单株总根长(D)Fig.1 Specific leaf area (A), leaf area index (B), specific root length (C) and total root length per individual (D) of the three plants at harvest
植物生长差异三种沉水植物株高之间存在显著差异(图2A;P<0.01), 穗花狐尾藻>黑藻>刺苦草。刺苦草根冠比显著大于穗花狐尾藻(图2B;P<0.05)。初始种植生物量最低的黑藻, 在最终收获时反而净增长最多, 最终的总生物量最高, 刺苦草次之, 穗花狐尾藻的净增长量和总生物量都最低(图2C)。黑藻的相对生长速率(RGR)最高, 显著高于刺苦草和穗花狐尾藻(P<0.05); 穗花狐尾藻相对生长速率也显著高于刺苦草(图2D;P<0.05)。
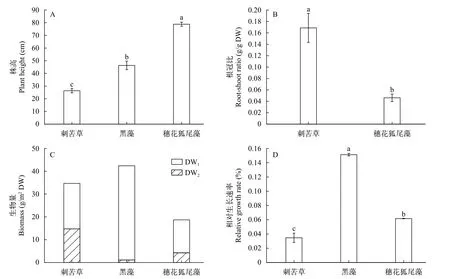
图2 三种植物的株高(A)、根冠比(B)、生物量(C)、和RGR(D, 相对生长速率)Fig.2 Plant height (A), root shoot ratio (B), biomass (C) and relative growth rate (RGR) (D) of the three plants
2.2 不同功能型沉水植物对水柱和沉积物溶解氧的影响
种植3种植物和无植物的对照组, 水中溶解氧浓度均在日出后逐渐增加, 日落时达到高峰, 此后再下降(图3A), 但种植沉水植物的实验组水中溶解氧浓度均显著高于空白对照组(P<0.05)。其中, 黑藻处理组溶解氧浓度显著高于其他两种植物组(P<0.05)。穗花狐尾藻组水中溶解氧浓度也显著高于底层型沉水植物刺苦草组(P<0.05)。图3A左上角显示了水柱中电导率和pH在1d中的变化趋势, 从中可以看出, 种植黑藻的水体中pH较高, 而电导率则明显低于其他处理组。
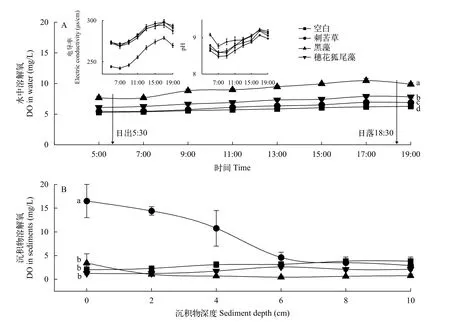
图3 各组水柱(A)和沉积物(B)中溶解氧浓度Fig.3 Dissolved oxygen in water column (A) and sediment (B) of each treatment
在实验结束时测量植物根际的沉积物溶解氧浓度, 穗花狐尾藻组、黑藻组和空白对照组沉积物溶解氧浓度随深度发生极小的变化, 两种冠层型植物组沉积物溶解氧浓度甚至在2 cm以上深度还略低于对照组(图3B)。刺苦草组沉积物中溶解氧浓度在6 cm深度之前显著大于冠层型植物组和对照组(P<0.05), 但溶解氧浓度随沉积物深度增加逐渐下降, 到6 cm深度后与其他组相同。
2.3 水和沉积物变化
水质理化指标各组别初始水柱TP含量一致(图4A), 实验结束时与初始相比, 空白组、刺苦草组、黑藻组和穗花狐尾藻组分别降低20.30%、30.46%、50.76%和77.83%。在实验结束时, 植物组水柱中TP浓度均低于对照组; 其中, 穗花狐尾藻组显著低于刺苦草组和空白组(P<0.05), 而黑藻组低于刺苦草组但差异 不显著(P>0.05), 刺苦草组与对照组无显著性差异(P>0.05)。水柱TN含量在实验开始时均为0.45 mg/L(图4B), 实验结束时与初始相比空白组、刺苦草组、黑藻组和穗花狐尾藻组分别降低1.56%、5.56%、7.84%和9.18%, 但各处理组之间没有显著性差异(图4B;P>0.05)。在实验开始时水中大部分藻类被过滤掉, 因此水柱Chl.a仅为0.66 μg/L, 实验结束时与初始相比空白组、刺苦草组、黑藻组和穗花狐尾藻组分别上升了109.07%、65.41%、84.40%和49.74%, 各处理之间也没有显著性差异(图4C;P>0.05)。
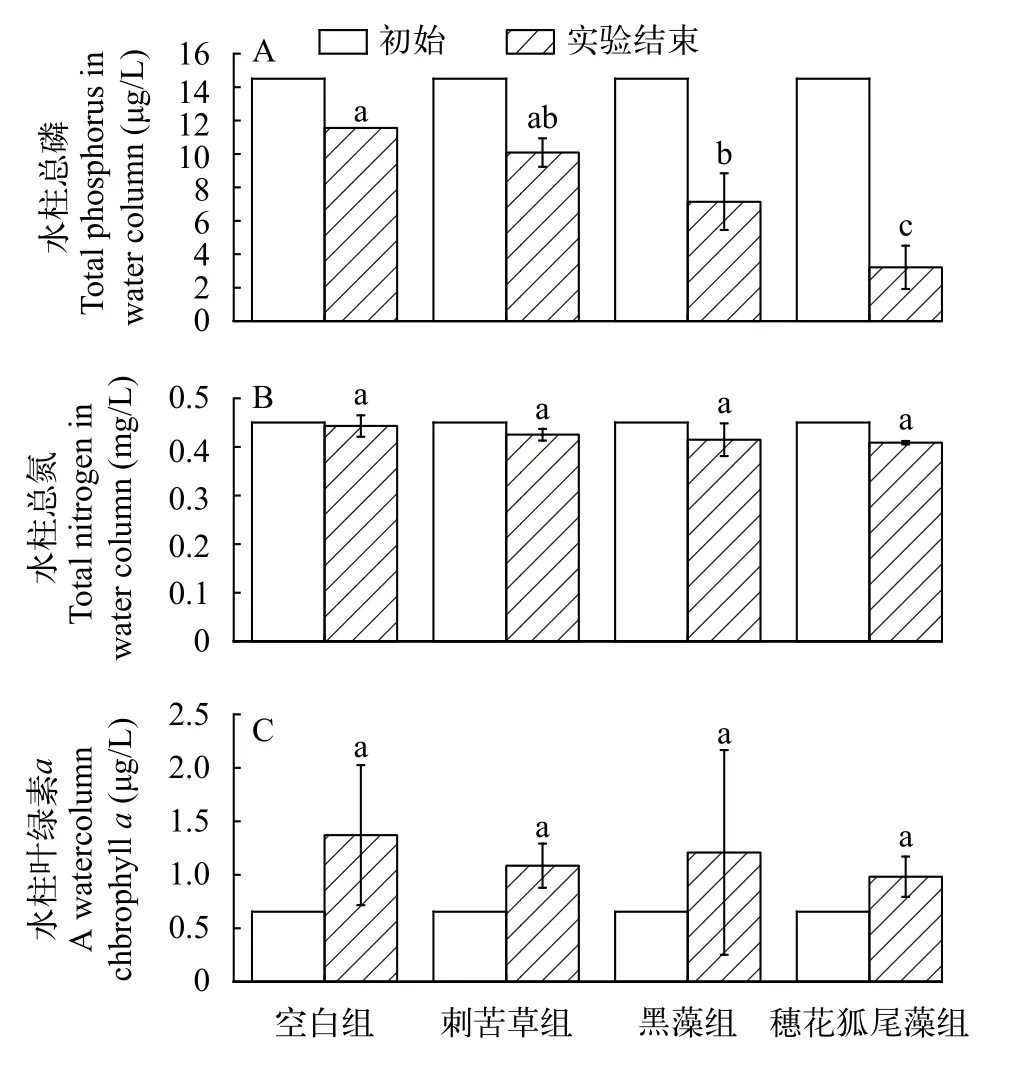
图4 各组水柱总磷(TP)(A)、总氮(TN)(B)和水柱叶绿素a(Chl.a) (C)初始与实验结束对比柱状图Fig.4 Histograms of initial vs end-of-experiment comparison of water column TP (A), TN (B) and water column Chl.a (C) for each treatment group
沉积物理化指标在实验结束时, 刺苦草组间隙水TDP浓度最低(图5A), 穗花狐尾藻组最高,空白组高于黑藻组, 但各处理组之间没有显著差异(P>0.05)。沉积物TP含量与初始相比, 空白组、刺苦草组、黑藻组和穗花狐尾藻组分别下降了3.60%、2.68%、5.10%和0.78% (图5B), 但实验结束时各处理组没有显著差异。沉积物TN含量与初始相比,空白组、刺苦草组、黑藻组和穗花狐尾藻组分别下降了10.17%、17.26%、10.46%和6.25% (图5C),刺苦草组显著低于穗花狐尾藻组(P<0.05)。实验结束沉积物TC含量与初始相比, 空白组和刺苦草组分别下降3.45%和5.33% (图5D), 而黑藻组和穗花狐尾藻组反而分别上升了1.35%和4.12%。在实验结束时, 空白组和刺苦草组显著低于穗花狐尾藻组(P<0.05)。沉积物总Fe含量实验结束时与初始相比, 空白组、刺苦草组、黑藻组和穗花狐尾藻组分别上升了1.71%、10.74%、1.12%和0.77% (图5E),实验结束时刺苦草组显著高于其他处理组(P<0.01)。植物处理组其他金属元素浓度略低于空白组(图5F),各处理组之间没有显著差异(P>0.05)。
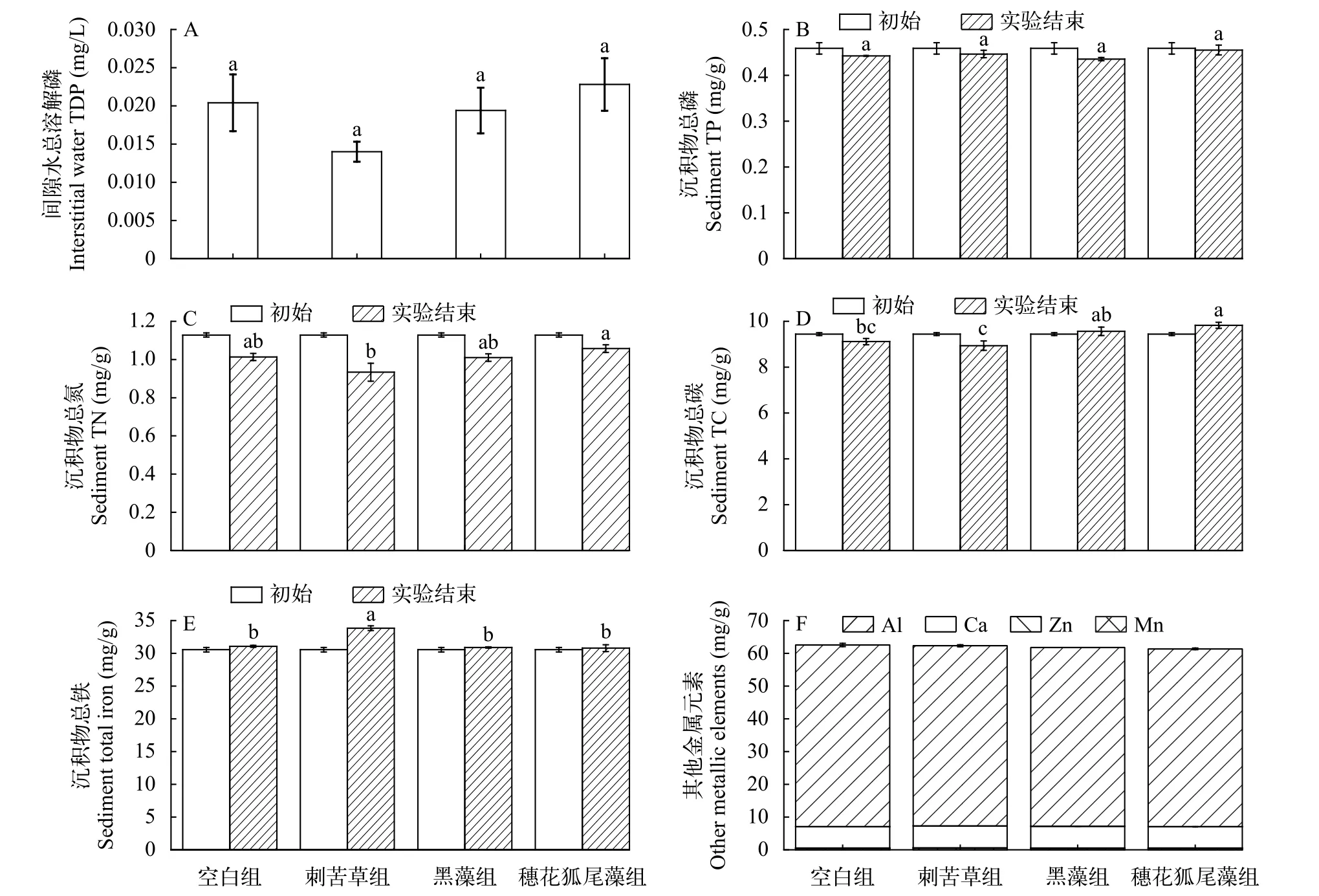
图5 间隙水总溶解磷(TDP)(A)、沉积物总磷(TP)(B)、总氮(TN)(C)、总碳(TC)(D)、总铁(E)和其他金属元素含量(F)Fig.5 Contents of interstice water TDP (A), sediment total phosphorus (B), total nitrogen (C), total carbon (D), total iron (E) and other metal elements (F)
3 讨论
3.1 不同功能型沉水植物的增氧效应
沉水植物能够显著改善水质, 促进湖泊形成清水态[30]。这是一个复杂的过程, 包括促进营养物沉降、抑制营养物再悬浮等物理过程[31]; 也包括直接抑制浮游植物生长, 以及庇护浮游动物, 促进其牧食作用从而间接抑制浮游植物等的生物过程[32,33]。最直接也最显著的是沉水植物在生长过程中通过生理活动和新陈代谢对水体产生的化学影响, 能显著影响水体离子浓度、pH和电导率等表征参数, 也极大改变碳、氮、磷、铁和锰等元素的地化循环过程[34]。然而, 这些化学过程, 甚至包括部分生物和物理过程, 都或多或少, 或直接或间接地受到沉水植物释放到水体的溶解氧的影响[35]。沉水植被区水柱中溶解氧浓度的日夜差异可高达8 mg/L[36]。在本研究中, 种植沉水植物的水柱中溶解氧浓度均高于对照组, 在1d的不同时段内, 黑藻组比对照组高出2—4 mg/L。
水中溶解氧浓度水平受制于氧气输入、生态系统呼吸水平及水体的溶解氧饱和度[37,38]。在日照时间内, 沉水植物是持续向水体增氧的, 实验系统的呼吸水平是相对固定的, 如果植物的释氧量足够, 理论上溶解氧应该会达到饱和状态。在标准大气压下,纯净水溶解氧饱和度主要受温度影响,温度越高饱和度越低[39,40]。本实验测量时间段内水温在28—33℃,对应纯净水溶解氧饱和度在7.83—7.18 mg/L[39]。在1d的时间内, 空白组和底层型刺苦草组溶解氧浓度均低于饱和溶解氧浓度7.18 mg/L,说明空白组和刺苦草组水中溶解氧尚处于不饱和状态。穗花狐尾藻组水中溶解氧浓度在下午17:00左右才接近饱和状态。冠层型黑藻组在上午9点至下午5点溶解氧浓度均大于对应最大饱和溶解氧浓度7.83mg/L[39],出现超饱和现象。这可能跟黑藻植冠功能性状(比叶面积和叶面积指数)远超过刺苦草和穗花狐尾藻, 以及冠层贴近水面能够充分利用光能进行光合作用有关。水中溶解氧浓度的垂直变化与沉水植物冠层位置有关[41],刺苦草株高显著低于穗花狐尾藻和黑藻。此外, 黑藻组水体pH较高而电导率明显偏低(图4A)。这可能是黑藻强烈的光合作用消耗了大量的CO2和, 产生的与Ca2+离子结合形成了CaCO3, 导致水中离子浓度降低的缘故[34]。水中离子浓度降低也能促进黑藻组水中溶解氧饱和度提升[7,42]。
维管植物也会氧化它们的根围。光合作用产生的氧气通过通气组织扩散到根部, 随后扩散到表皮, 进入沉积物。因此, 根系相对发达的水生植物对沉积物的氧化作用比较强。此外, 贴地生长的叶片释放的氧气也能参与沉积物表层氧化[36]。在本研究中, 生物量集中在沉积物附近的刺苦草具有较高的比根长、根冠比和单株总根长, 能够向沉积物输送氧气。但由于根长一般仅有2—10 cm, 输送的氧气进入沉积物的深度有限[36], 因此, 仅能在刺苦草根区6 cm以内的深度测出明显较高的溶解氧浓度。穗花狐尾藻虽然也有不少根, 但其根区沉积物溶解氧浓度比对照还低, 推测其根系泌氧作用有限。黑藻几乎无根, 对沉积物释氧作用也极弱。黑藻和穗花狐尾藻都具有多而且细碎的叶片, 生长过程中会有更新[43]。在实验结束时, 种植黑藻和穗花狐尾藻的沉积物表层总碳量增加, 很可能是衰亡的叶片堆积在沉积物表面, 反而引起了表层沉积物缺氧。
总而言之, 本实验的结果显示, 大量生物量贴近水面的冠层型沉水植物释放到水柱中的氧气比较多, 对水中增氧作用明显, 但对沉积物增氧作用较小。而生物量贴近沉积物的底层型沉水植物对水中增氧作用较小, 但对沉积物增氧作用明显。
3.2 不同功能型沉水植物增氧的环境效应
沉水植物的增氧具有重要的生物地球化学效应, 也能引起生态系统组分发生改变。水中的还原性金属离子会被迅速氧化, 与无机磷结合后沉降,是水中磷浓度下降的一个重要原因[5,44]。但是, 水中金属离子浓度通常较低[45], 而1 mol的DO能氧化4 mol 金属离子(如Fe2+), 因此, 只需要很少的溶解氧就能够将水中大部分的低价金属离子氧化, 并与相应数量的磷结合沉淀; 当水中低价态金属离子大部分被氧化后, 溶解氧浓度增加就不再跟磷浓度表现出相关关系。水中总磷浓度降低的另一个更重要的原因是沉水植物的吸收作用[46]。穗花狐尾藻叶片同化磷的能力高于苦草和黑藻[47], 能够从水中吸收更多的磷用于自身生长, 这可能就是黑藻水中DO浓度最高, 但TP浓度依然高于穗花狐尾藻的原因。沉水植物的增氧还导致叶片周围的硝化作用增强, 远离叶片的部分则存在反硝化脱氮作用, 从而有效降低氨氮和总氮浓度[32]。增氧作用也能降低温室气体排放量, 每1 mol的DO能氧化0.30 mol NH4-N或0.60 mol CH4[8]。营养盐浓度的降低抑制了藻类的生长, 因此Chl.a浓度也较低[48]。
沉水植物对沉积物的增氧作用影响更大, 因为沉积物中还原物质更多更复杂。铁结合态磷(Fe-P)是沉积物中磷的重要组成部分, 在氧化环境下磷伴随着铁的沉淀进入沉积物中[44,49], 避免底层磷向上释放[36]。与本研究结果一致, 底层型刺苦草根区沉积物DO浓度最高, 沉积物Fe含量最高(总铁增加量是其他处理的6倍以上), 沉积物TP下降少。当然,根生型沉水植物主要靠根部从间隙水中吸收营养盐[46], 这可能是间隙水TDP降低的原因。沉水植物增氧对沉积物有机碳和氮的影响也很大, 能促进有机质降解和脱氮作用[43,50,51]。能够为沉积物增氧的刺苦草组沉积物中TN和TC都下降较多, 对沉积物没有增氧作用的黑藻和穗花狐尾藻组TN下降较少, TC不降反增。然而, 各处理组差异并不显著,其他金属元素也没有表现出明显趋势, 这可能还是因为种植密度比较低, 刺苦草的增氧作用相对于沉积物庞大的还原物质库来说只是杯水车薪的缘故。
沉水植物的增氧作用不但能改变水柱和沉积物的理化性质, 也能引起生物群落发生变化。微生物群落响应最快, 物种多样性和好氧菌群均会增加[52]。也能支持更多的水生动物进行呼吸作用[17,18]。此外, 在复杂的野外条件下, 高密度的沉水植物还能改变水体温度、改变水流和消光等作用, 能够放大或削弱沉水植物的增氧作用, 为水生生物创造多样化的栖息环境, 有利于水生态系统多样性提高。
4 结论
本文的实验结果表明, 具有发达根系、生物量贴近沉积物的底层型沉水植物刺苦草对沉积物的增氧作用较强, 改变间隙水和沉积物中营养盐浓度和金属离子的含量; 植冠发达、生物量贴近水面生长的冠层型沉水植物黑藻对水柱增氧作用较强, 降低水中营养盐浓度。冠层型沉水植物穗花狐尾藻虽然也有根, 但其跟黑藻一样, 仅对水柱有增氧作用。因此, 在进行水体生态修复时, 考虑沉水植物功能型的差异, 释放到水中和沉积物的氧气位置和量不同, 建议对底层型沉水植物和冠层型沉水植物进行合理搭配, 打造立体增氧沉水植物群落, 使水柱上层到沉积物表层均能获得足够的氧气, 整体提升水质, 有利于长期稳定维持湖泊的清水态, 也有利于提高水生态系统多样性。
——以武汉紫阳湖为例

