氨对褶纹冠蚌钩介幼虫及稚蚌的急性毒性
乔瑞婷 李 艳 刘 苗 赵永晶 舒凤月 崔永德
(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049;3.曲阜师范大学, 曲阜 273165)
氨氮是水生态系统中普遍存在的污染物, 其浓度过高时可对水生生物产生毒害作用[1]。人类活动产生的外源氮是水中氮污染的主要来源[2], 如过度使用的农田氮肥随地表径流进入水体。近年来我国氮肥消耗量一直维持在较高水平, 且呈快速增长趋势[3]。随着经济快速发展, 氮污染已经成为世界各地水体污染的重要问题之一。确定氨氮对生物的毒性效应及阈值是管理水体氨氮浓度的重要依据。
底栖动物是水生态系统中的一大类群, 其活动能力弱, 逃逸能力差, 对环境污染和水质的干扰极为敏感[15,16], 能较好地反映出水体中受污染情况。蚌类属软体动物门(Mollusca), 双壳纲(Bivalvia), 蚌目(Unionoida), 蚌科(Unionidae), 作为典型的大型底栖动物, 其生活史复杂且寿命较长[17—19], 且相较于鱼类、两栖类而言对氨更敏感[20]。自然界中绝大多数蚌类的生活史存在一个寄生的过程, 在繁殖季节钩介幼虫从成熟母蚌的外鳃排出, 寄生在鱼体鳃丝、鱼鳍上, 完成变态发育成为稚蚌后从鱼体脱落,沉入水底, 营底栖生活[21—23]。蚌类各生活史阶段有较为明显的区分, 同时钩介幼虫和稚蚌相较于幼蚌未发育完全, 可能对毒物更为敏感。因此, 蚌类是毒性物质测试和水质状况评价的理想对象, 然而以往对于蚌类的研究主要集中于幼蚌, 对更早期生活史阶段如钩介幼虫、稚蚌的研究则较少[24]。
本文以长江中下游常见经济蚌种褶纹冠蚌(Cristaria plicata)为研究对象, 分别以其钩介幼虫和稚蚌为实验对象开展氨氮急性毒性实验, 探究氨氮对褶纹冠蚌早期生活史阶段的毒性, 以期为蚌类保护及水体中氮管理提供相关理论依据。
1 材料与方法
1.1 实验对象
实验选择长江中下游常见的经济蚌种褶纹冠蚌为研究对象。孕有钩介幼虫的母蚌、稚蚌及幼蚌均取自安徽水韵软体动物繁育科技有限公司。母蚌从养殖池塘中取出后, 用软毛刷将母蚌表面附着的着生藻清理干净, 将其放于盛有水的容器中,水深保持可以露出壳顶的高度。将母蚌置于阴凉的环境中待其自然释放出钩介幼虫, 在显微镜下观察钩介幼虫的活性, 挑选活力良好的钩介幼虫为实验对象。实验在钩介幼虫释放后2h内进行。
稚蚌是指钩介幼虫寄生在鱼鳃上发育基本成熟后脱落的个体, 实验选择5日龄的稚蚌为急性毒性实验材料。在解剖镜下挑选活力良好的稚蚌(伸出斧足活动)为实验对象。
1.2 实验设置
钩介幼虫急性毒性实验参照美国试验材料学会(American Society for Testing Material, ASTM) 发表的实验标准, 采用24h静水水生生物急性毒性实验法, 实验在250 mL烧杯中进行, 为便于观察先将钩介幼虫置于90 mm培养皿中再置于盛有实验水的烧杯中进行实验。光照周期为12L∶12D。实验用水为经充分曝气的重组水[25]。用分析纯NH4Cl配制实验所需的氨溶液母液, 通过预实验确定24h未见死亡的最大氨氮浓度和全部死亡的最小氨氮浓度。再根据预实验结果以等间距设置正式实验的6组氨氮浓度, 总氨氮浓度(TAN, 以N计)分别为: 0(对照组)、12、24、36、48和60 mg/L。每组氨氮浓度设置3个重复。实验在恒温水浴缸中进行, 以维持水温在(20.0±0.2)℃, 用NaOH稀溶液和HCl稀溶液来调节水体pH在7.5±0.1。每个烧杯中放置10只钩介幼虫。实验结束后统计幼虫的死亡率, 用镊子将盛有幼虫的培养皿取出, 用饱和NaCl溶液测试其存活状况。在解剖镜下先统计钩介幼虫闭壳数记为N0, 滴加饱和NaCl溶液后再次统计闭壳数N1, 总死亡数N=10-(N1-N0)[26]。
稚蚌急性毒性实验参照美国试验材料学会发表的实验标准, 采用48h静水水生生物急性毒性实验法,通过预实验确定48h未见死亡的最大氨氮浓度和全部死亡的最小氨氮浓度。再根据预实验结果以等间距设置正式实验的6组氨氮浓度, TAN分别为: 0(对照组)、24、36、48、60和72 mg/L。其他设置同钩介幼虫急性毒性实验。实验开始后24h检查稚蚌的存活情况, 用镊子将盛有稚蚌的培养皿取出, 在解剖镜下观察稚蚌的存活情况, 双壳打开轻触不闭壳或双壳紧闭轻触有白色絮状物视为死亡, 记录总死亡数N。实验期间, 每天更换1/2的实验水。
1.3 样品采集与分析
实验开始后在每天换水前监测1次水温、pH、溶氧等, 使用多参数水质分析仪PRO Plus (Yellow Spring Instruments, 美国)于水体中部测定。并取25 mL水样用于检测水体氨氮含量, 检测方法使用纳氏试剂光度法测定[27]。
1.4 数据处理与分析
数据处理与计算使用Excel 2016完成, 图形绘制使用Origin 2021完成。
死亡率计算公式: 死亡率(%)=死亡数/10×100
为便于比较, 将所有实验的TAN浓度结果标准化为在水温20℃、pH 7条件下(TAN7.0,20℃)的值(AVpH7), 计算公式如下:
分子氨的计算公式:
式中, pKa=0.09018+2729.92/T
式中,T为绝对温度,T=273.15+t(℃), 其中NH3为分子氨,为离子氨。
TAN与死亡率的效应-浓度曲线选择各组不同时间采集计算的AVpH7平均值作为TAN值, NH3-N与死亡率的效应-浓度曲线选用如上计算的NH3-N的平均值。半致死浓度LC50通过将死亡率=50%代入浓度效应曲线公式获得。
2 结果
2.1 氨对褶纹冠蚌钩介幼虫的急性毒性
实验系统实际水温为(20.1±0.8)℃ (平均值±标准差, mean±SD), 实际pH为7.67±0.2。在24h内各处理组平均TAN7.0,20℃浓度依次为(1±0)、(34±1)、(63±2)、(83±1)、(94±2)和(118±8) mg/L。各处理组平均NH3-N浓度依次为(0.01±0.01)、(0.30±0.17)、(0.53±0.24)、(0.65±0.19)、(0.75±0.13)和(0.92±0.13) mg/L (图1)。
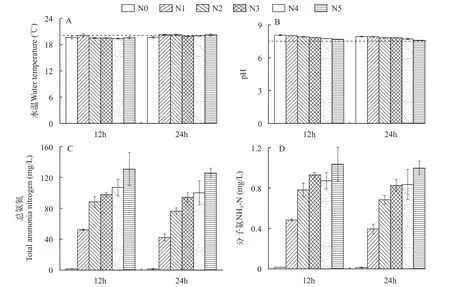
图1 褶纹冠蚌钩介幼虫急性毒性实验水体理化指标Fig.1 Physical and chemical indexes of water in acute toxicity test of glochidia
如图2显示, 随着NH3-N浓度的升高, 褶纹冠蚌钩介幼虫的死亡率是明显升高的。在各处理组中,24h钩介幼虫死亡率依次为0、3%、35%、47%、67%和100%。氨氮对褶纹冠蚌钩介幼虫的24h LC50为0.63 mg NH3-N/L和78 mg TAN7.0,20℃/L。

图2 TAN及NH3-N对褶纹冠蚌钩介幼虫的浓度-效应曲线Fig.2 Scatter plot of liner regression between total ammonia nitrogen (A) and unionzed ammonia nitrogen (B) to mortality of glochidia
2.2 氨对褶纹冠蚌稚蚌的急性毒性
实验系统实际水温为(19.2±0.7)℃, 实际pH为7.62±0.18。48h内各处理组平均TAN7.0,20℃浓度依次为(2±0)、(64±3)、(89±3)、(114±7)、(134±0)和(157±2) mg/L; 各处理组平均NH3-N浓度依次为(0.01±0.01)、(0.39±0.14)、(0.53±0.11)、(0.65±0.07)、(0.75±0.08)和(0.84±0.09) mg/L (图3)。

图3 褶纹冠蚌稚蚌急性毒性实验水体理化指标Fig.3 Physical and chemical indexes of water in acute toxicity test of newly transformed juvenile
如图4显示, 随着NH3-N浓度的升高, 褶纹冠蚌稚蚌的死亡率逐渐升高。在各处理组中, 48h稚蚌的死亡率依次为0、10%、23%、67%、93%和100%。通过计算得到氨氮对褶纹冠蚌稚蚌的48h LC50为0.60 mg NH3-N/L和104 mg TAN7.0,20℃/L; 氨氮对褶纹冠蚌稚蚌的24h LC50介于0.64—0.78 mg NH3-N/L和118—140 mg TAN7.0,20℃/L 。
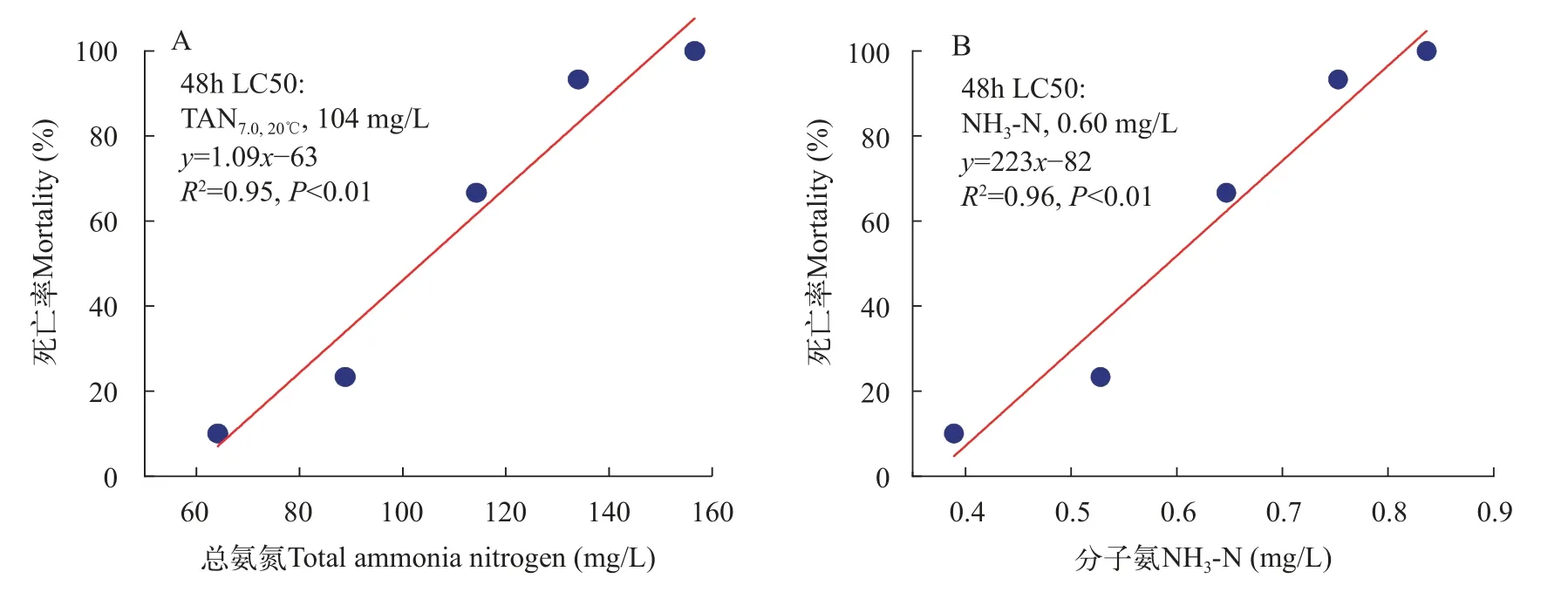
图4 TAN及NH3-N对褶纹冠蚌稚蚌的浓度-效应曲线Fig.4 Scatter plot of liner regression between total ammonia nitrogen (A) and unionzed ammonia nitrogen (B) to mortality of newly transformed juvenile
3 讨论
3.1 氨对褶纹冠蚌早期生活史阶段的毒性
本研究中氨氮对褶纹冠蚌钩介幼虫的24h LC50为0.63 mg NH3-N/L和78 mg TAN/L, 对褶纹冠蚌稚蚌的48h LC50为0.60 mg NH3-N/L和104 mg TAN/L。这些阈值高于许多国内外已有研究中氨对其他淡水蚌类毒性的阈值, 如氨对Lampsilis siliquoidea、Actinonaias ligamentina、Lampsilis rafinesqueana、Epioblasma capsaeformis、Villosa iris、Lampsilis fasciola等蚌类钩介幼虫的24h LC50为4.8—16 mg TAN/L[26,28], 对Lampsilis siliquoidea、Lampsilis rafinesqueana、Epioblasma capsaeformis、Villosa iris等蚌类稚蚌48h LC50为7.9—16 mg TAN/L[26,28]。上述结果表明相比其他淡水蚌类, 褶纹冠蚌能够耐受更高浓度的氨氮。近些年来长江中下游水体总氮含量达多年前的十倍之多, 楔形丽蚌(Lamprotula bazini)、三巨瘤丽蚌(Lamprotula triclava)等不少种类消失, 而褶纹冠蚌始终为该研究区域的优势种之一[29,30], 暗示褶纹冠蚌对环境变化有较强的适应能力。此外, 国内外现有关于蚌类氨氮耐受性的研究大多聚焦于珍稀物种或濒危物种, 这些蚌类自身对环境的变化较为敏感[31], 对污染物的耐受能力较差, 这可能也是导致本研究结果与已有报道差异的原因之一。
3.2 褶纹冠蚌不同生活史阶段氨耐受性的差异及机制
本研究结果显示褶纹冠蚌早期生活史阶段对氨氮更为敏感, 且随着个体生长发育的持续其对氨的耐受性增加。本研究中稚蚌的24h LC50(以总氨氮计)约为钩介幼虫的1.5倍, 表明相比钩介幼虫, 稚蚌能够耐受更高浓度的氨氮。关于褶纹冠蚌幼蚌,国内已有部分学者研究了氨对其毒性, 如陈莹莹等[32]发现氨氮对褶纹冠蚌幼蚌的48h LC50为274 mg TAN/L, 其值亦远高于本研究氨对稚蚌和钩介幼虫的LC50, 同样表明随着蚌个体发育的完善, 其对氨毒性耐受性增强。Wang 等[26]对北美一种淡水蚌类Lampsilis siliquoidea的研究结果与本研究类似, 氨对Lampsilis siliquoidea稚蚌的48h EC50(>16 mg TAN/L)高于其对钩介幼虫的48h EC50(8.8—13 mg TAN/L)。关于Lampsilis rafinesqueana、Epioblasma capsaeformis、Villosa iris、Lampsilis fasciola等淡水蚌类的研究结果同样与本研究类似[28,33]。
蚌类发育后期其外壳较早期明显变厚, 与钩介幼虫相比能更有效地阻隔体内组织与水体氨氮的接触, 从而利于其耐受更高浓度的氨。已有大量研究表明, 软体动物在处于危险状态时, 外部的壳对其有一定的保护作用, 如铜锈环棱螺在面对氨胁迫时会紧闭厣甲来减少与外部水环境的接触, 从而减弱了氨对其内部结构的损伤[34]。而蚌类的外壳在其早期生活史阶段薄且易碎, 对壳内组织的保护不够充分。稚蚌及幼蚌由于外壳的加厚变硬及发育的完成, 可紧闭双壳来减少体内组织暴露于有毒环境的时间, 可以对稚蚌、幼蚌起到更有力的保护作用, 因而其比钩介幼虫能耐受更高浓度的氨。
在一定范围内, 蚌类可以对氨氮进行一定程度的解毒, 且其解毒能力也可能会随着个体发育的完善有所提高。已有较多水生生物对氨解毒机制的研究表明鳃和肝胰脏(或肝脏、肾脏等)是其解毒的重要器官[35]。蚌类可通过鳃上的纤毛组织将部分体内的氨排出体外[36], 而随着蚌类个体发育, 鳃表面积变大, 其上的氨排泄速率会更高。蚌类不同于鳃对氨的转运排出作用, 蚌类的肝胰脏主要是将生物体内的氨转化为无毒或低毒性的物质储存在体内。在肝胰脏中铵可在催化酶的作用下生成谷氨酰胺(Gln)[37]、丙氨酸和天冬氨酸[38]。随着个体的生长发育, 蚌类的鳃和肝胰腺等解毒代谢器官的发育渐趋完善, 其解毒能力也逐渐增强, 从而使其能够耐受更高浓度的氨氮。
本研究仍有诸多不足, 首先研究对象仅为褶纹冠蚌1种, 关于氨氮对蚌类毒性及阈值的评估仍需更多研究, 尤其是针对一些珍稀的亟待保护的种类,如背瘤丽蚌(Lamprotula leaii)、佛耳丽蚌(Lamprotula mansuyi)和三型矛蚌(Lanceolaria triformis)等。此外, 本研究仅开展了室内急性毒性实验, 可能无法反映自然水体中蚌类对长期氨胁迫响应。本研究团队前期针对鲢、鳙和鲫等鱼类、铜锈环棱螺等底栖动物的研究表明氨对生物的毒性存在尺度依赖性, 其随研究尺度的增大而减弱。因此,关于后期需结合多尺度研究系统分析氨对蚌类的毒性效应及阈值, 从而为自然水体中氨氮对蚌类的安全阈值的确定及水体氮管理策略等提供科学依据。
4 结论
本研究结果显示氨氮对褶纹冠蚌钩介幼虫和稚蚌的LC50分别为0.63 mg NH3-N/L、78 mg TAN/L(24h)和0.60 mg NH3-N/L、104 mg TAN/L (48h), 这一结果表明褶纹冠蚌对氨氮的耐受性高于国内外许多已有研究中的蚌种。此外, 褶纹冠蚌更早期生活史阶段对氨氮更为敏感, 且随着个体生长发育的持续其对氨的耐受性增加蚌类。以上研究结果可为蚌类保护及水体氮管理策略的制定提供一定的科学依据。
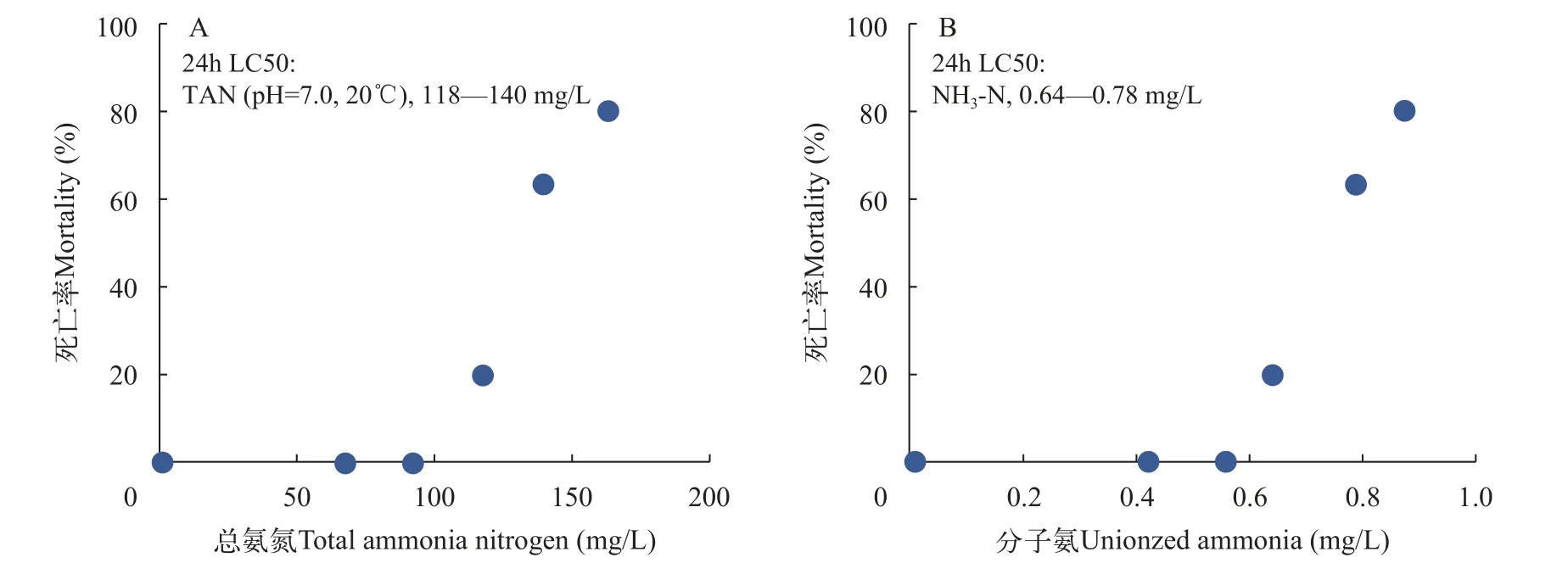
图版Ⅰ TAN及NH3-N 与褶纹冠蚌稚蚌的浓度-效应关系PlateⅠ The relationship between total ammonia nitrogen (A) and unionzed ammonia nitrogen (B) of newly transformed juvenile
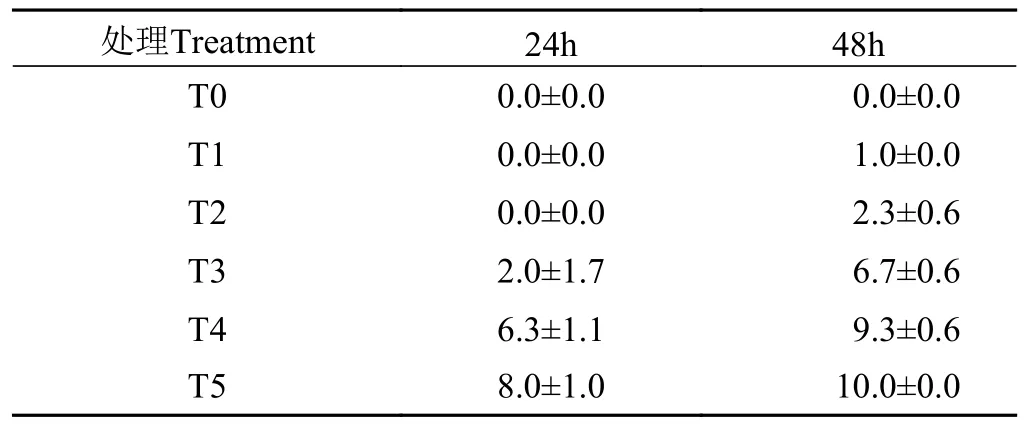
附表 S1 褶纹冠蚌稚蚌累计死亡个数变化Appendix S1 Cumulative death of newly transformed juvenile
致谢:
感谢安徽水韵软体动物繁育科技有限公司提供实验动物, 感谢张欢在实验中提供的帮助, 感谢Kazi Belal Uddin 对本文英文部分修改润色提供的帮助。

