粉防己碱减轻IL-1β诱导的体外人关节软骨细胞损伤
欧阳云朗,张 宁,陈丽萍,贾丙申,焦 拓
海南医学院第一附属医院 关节外科,海南 海口 570000
骨关节炎(osteoarthritis,OA)是一种常见的关节软骨疾病,其特征是关节软骨进行性破坏和软骨丢失[1]。软骨细胞是关节软骨中唯一的细胞,其在OA早期被激活,并伴随着白细胞介素1β(interleukin-1β,IL-1β)的释放。已知IL-1β在参与OA病理的不同类型中发挥多种作用,因此IL-1β损伤软骨细胞是建立OA细胞模型最合适的方法之一[2]。粉防己碱(tetrandrine,Tet)是具有抗炎、抗高血压及保护心脏等功能的双苄基异喹啉类生物碱,主要用于治疗矽肺、类风湿性关节炎和肺动脉高压。据报道Tet通过选择性抑制环氧合酶-2(cyclooxygenase-2,COX-2)等因子减轻骨关节炎[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成的调节因子,为血管生成提供有利的环境。低氧诱导因子-1α(hypoxia inducible factor,HIF-1α)信号转导可以参与缺氧条件下VEGF介导的血管生成[4]。研究显示,F-box/WD重复蛋白7可以通过抑制HIF-1α/VEGF途径,在IL-1β诱导的软骨细胞变性中起保护作用[5]。因此,本实验旨在探讨Tet对IL-1β诱导的关节软骨细胞损伤的作用及可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞:原代人关节软骨细胞(武汉普诺赛生命科技有限公司)。
1.1.2 药品和试剂:粉防己碱(成都植标化纯生物技术有限公司);二甲氧基雌二醇(2-ME2,Med Chem Express公司);IL-1β标准品(深圳海思安生物技术有限公司);MTT法细胞增殖检测试剂盒(上海源叶生物科技有限公司);annexin V-FITC/PI细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶3(matrix metalloproteinase 3,MMP-3)ELISA检测试剂盒(杭州联科生物技术股份有限公司);COX-2、诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA检测试剂盒(上海联迈生物工程有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活性检测试剂盒(武汉菲恩生物科技有限公司);HIF-1α、VEGF一抗(Abcam公司);山羊抗兔IgG(H&L)抗体(艾美捷科技有限公司)。
1.2 方法
1.2.1 细胞培养及分组处理:将人关节软骨细胞用含有10%胎牛血清和1%青霉素和链霉素的DMEM培养基并放在37 ℃,5% CO2的培养箱中培养。在细胞汇合达到80%后按照1∶2比例传代。将第3代生长状态良好的细胞分为对照组、IL-1β组(10 ng/mL IL-1β[6])、HIF-1α抑制剂组(2-ME2组,10 ng/mL IL-1β + 10 mol/L的2-ME2[5]),Tet低、中和高浓度组(10 ng/mL IL-1β + 5、10或20 mol/L Tet[7]),48 h后收集细胞用于后续实验。
1.2.2 MTT法检测细胞的增殖活性:将细胞以每孔4×103个的浓度接种至96孔板中,24 h后在每孔加入MTT继续培养4 h。弃上清液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min。用酶标仪测量在490 nm处每个孔的吸光度值,并分析各组的细胞活性。
1.2.3 流式细胞仪检测细胞凋亡:将细胞以每孔4×103个的浓度接种至6孔板中,收集细胞用预冷的PBS洗涤细胞,然后加入100 μL悬浮液重悬细胞,再加入5 μL的annexin V-FITC和10 μL的PI充分混匀,避光孵育15 min。最后用流式细胞仪检测细胞凋亡情况并分析细胞凋亡率。
1.2.4 ELISA检测细胞中炎性相关因子TNF-α、MMP-3、iNOS、COX-2的水平以及抗氧化因子SOD和GPx的活性:将细胞重悬并离心收集上清液。然后按照ELISA试剂盒的操作步骤,分别处理上清液并检测相应处理液中TNF-α、MMP-3、iNOS、COX-2的水平和抗氧化因子SOD和GPx的活性。
1.2.5 Western blot检测中HIF-1α、VEGF蛋白的表达:收集细胞并加入蛋白裂解液裂解,然后收集上清。用BCA法测定蛋白质浓度,每孔加入等量样品进行SDS-PAGE凝胶电泳并转膜。然后用5%脱脂牛奶4 ℃过夜孵育PVDF膜,接着用一抗稀释液(HIF-1α、VEGF稀释倍数均为1∶1 000)室温孵育1 h,再用羊抗兔IgG二抗(稀释倍数1∶2 000)室温孵育1 h,TBST洗膜,最后用显影剂避光显色,用蛋白凝胶成像系统观察蛋白条带。以GAPDH为内参,用Image J分析蛋白质表达量。
1.3 统计学分析

2 结果
2.1 Tet对关节软骨细胞增殖活性的影响
与对照组相比,IL-1β组中关节软骨细胞的存活率显著降低,差异有统计学意义(P<0.05);与IL-1β组相比,2-ME2组和Tet低、中、高浓度组中关节软骨细胞的存活率升高,差异有统计学意义(P<0.05)(表1)。

表1 各组细胞的存活率Table 1 Survival rate of cells in each
2.2 Tet对关节软骨细胞凋亡率的影响
与对照组相比,IL-1β组关节软骨细胞的凋亡率升高,差异有统计学意义(P<0.05);与IL-1β组相比,2-ME2组和Tet低、中、高浓度组关节软骨细胞的凋亡率降低,差异有统计学意义(P<0.05)(图1)。
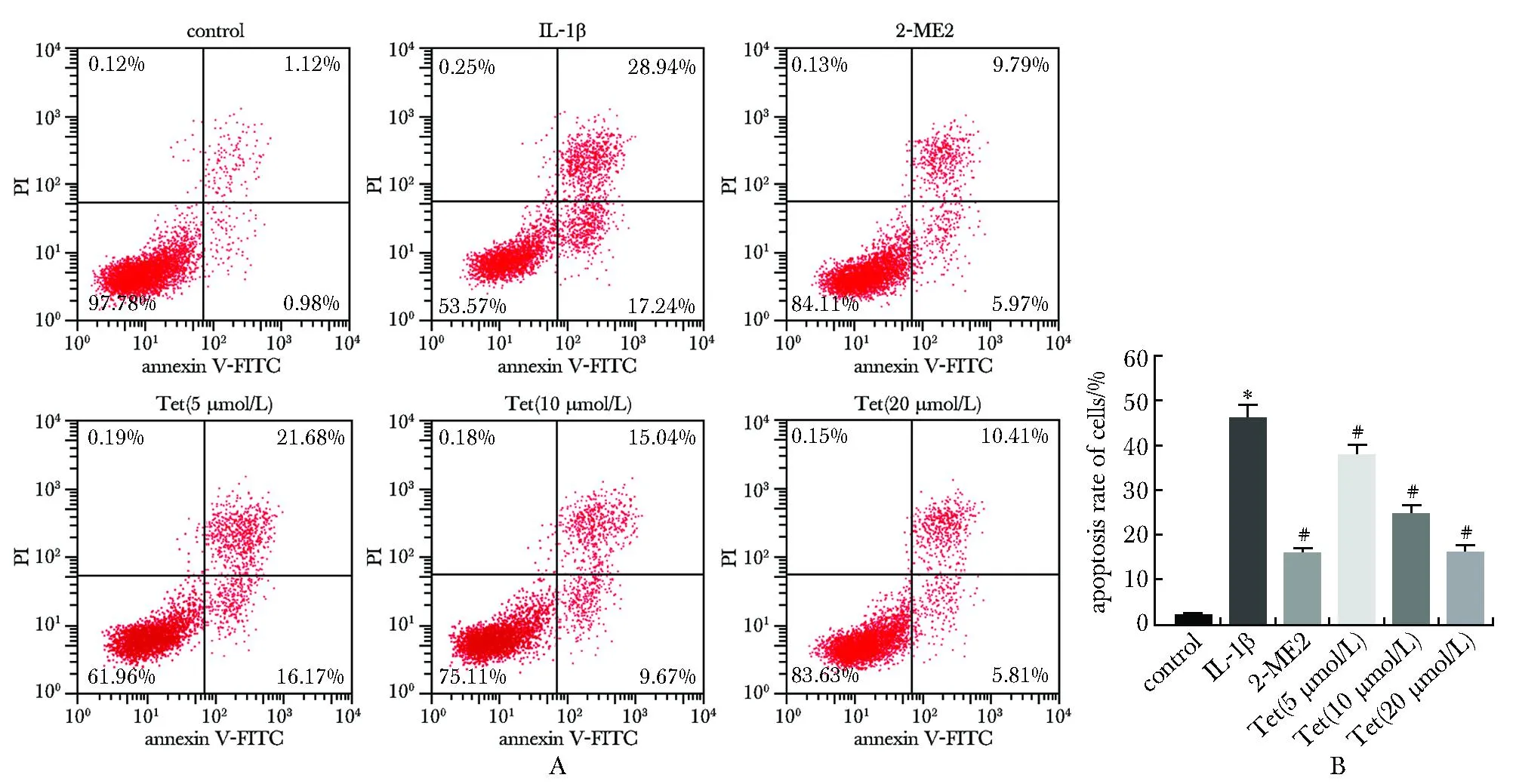
*P<0.05 compared with control;# P<0.05 compared with IL-1β.
2.3 Tet对关节软骨细胞中炎性相关因子TNF-α、MMP-3、iNOS、COX-2水平的影响
与对照组相比,IL-1β组关节软骨细胞中TNF-α、MMP-3、iNOS、COX-2的水平升高,差异有统计学意义(P<0.05);与IL-1β组相比,2-ME2组和Tet低、中、高浓度组关节软骨细胞中TNF-α、MMP-3、iNOS、COX-2的水平降低,差异有统计学意义(P<0.05)(图2)。
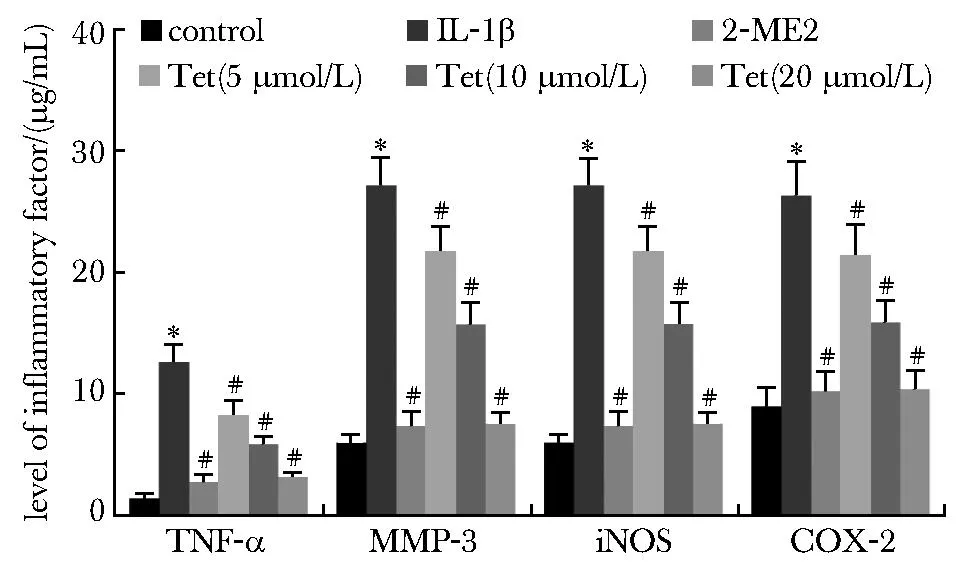
*P<0.05 compared with control;# P<0.05 compared with IL-1β.
2.4 Tet对关节软骨细胞中抗氧化因子SOD和GPx活性的影响
与对照组相比,IL-1β组关节软骨细胞中SOD和GPx活性降低,差异有统计学意义(P<0.05);与IL-1β组相比,2-ME2组和Tet低、中、高浓度组关节软骨细胞中SOD和GPx活性升高,差异有统计学意义(P<0.05)(图3)。
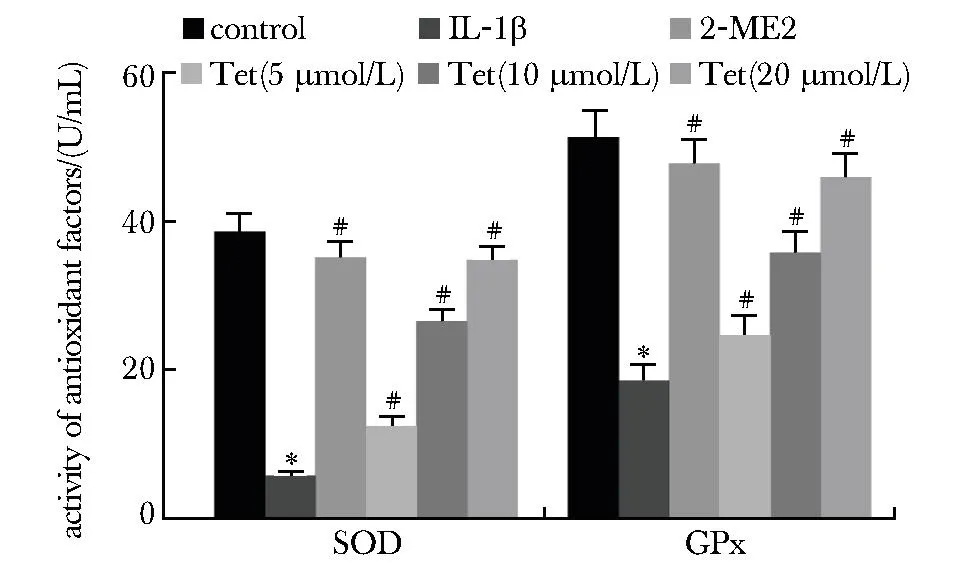
*P<0.05 compared with control;# P<0.05 compared with IL-1β.
2.5 Tet对软骨细胞中HIF-1α、VEGF蛋白表达的影响
与对照组相比,IL-1β组关节软骨细胞中HIF-1α、VEGF蛋白表达升高,差异有统计学意义(P<0.05);与IL-1β组相比,2-ME2组和Tet低、中、高浓度组关节软骨细胞中HIF-1α、VEGF蛋白表达降低,差异有统计学意义(P<0.05)(图4)。

A.expression bands of protein in cells of each group; B.relative expression of protein in cells of each group; *P<0.05 compared with control;# P<0.05 compared with IL-1β.
3 讨论
OA是慢性退行性关节疾病之一,是患者慢性疼痛和功能障碍的主要原因, 其主要特征是软骨进行性丧失,骨赘形成,基质降解和基质合成失衡,最终可能会导致活动能力丧失甚至残疾,严重影响患者的生活质量[8]。IL-1β是IL-1细胞因子家族的成员,可以参与关节软骨变性。目前IL-1β刺激软骨细胞已被广泛用于模拟体外关节软骨损伤[9]。本研究发现IL-1β组软骨细胞的存活率降低、凋亡率升高,表明IL-1β诱导了关节软骨细胞损伤。目前只有少数消炎和镇痛药物可以用来缓解OA症状。因此,临床上迫切需要一种治疗OA的有效药物[10]。本研究结果中发现,2-ME2和Tet处理后,软骨细胞的存活率升高,凋亡率降低。表明Tet能够抑制IL-1β诱导的软骨细胞凋亡,促进细胞增殖,从而减轻细胞损伤。但其中的具体机制尚未有研究。
OA的发病机制包括引发软骨代谢失衡的炎性反应和活性氧(reactive oxygen species,ROS)过量产生的氧化应激。当软骨细胞受到IL-1β的刺激时,会分泌TNF-α、MMP、iNOS和COX-2等炎性介质[11]。在ROS过量产生的条件下,细胞抗氧化防御系统中SOD和GPx等被激活,并有效清除ROS分子[12]。HIF-1α是细胞对缺氧反应的关键调节因子,其在常氧条件下能够迅速降解,但在缺氧条件下过表达,是各种MMP的有效反式激活剂。除此之外,炎性细胞因子、ROS和iNOS等介质可能诱导HIF-1α的过表达[13]。VEGF是HIF-1α的靶基因中备受关注的分子,是一种促血管生成因子,能够在OA关节软骨生长过程中表达,其水平升高可促进OA的发展[14]。有研究发现VEGF也可以导致MMP的产生增加,并诱导OA中软骨细胞凋亡和炎性反应[15]。本研究结果显示HIF-1α抑制剂2-ME2及Tet处理后TNF-α、MMP-3、COX-2、iNOS的水平降低,SOD和GPx活性升高,HIF-1α和VEGF蛋白表达降低。本文揭示了Tet可以减轻IL-1β诱导的软骨细胞炎性和氧化应激损伤,可能与HIF-1α/VEGF信号通路被抑制有关。
综上所述,Tet可以减轻IL-1β诱导的软骨细胞损伤,可能与HIF-1α/VEGF信号通路被抑制有关。本研究为OA治疗方案提供了新的药物和方向。但是本实验仅研究了HIF-1α下游靶基因中的一种,其他下游靶基因是否在OA中产生作用以及具体作用机制还有待进一步深入研究。

