68Ga-citrate对软组织感染PET-CT显像基因表达分子机制与验证
徐婷婷,江 飞,傅文会,陈 跃
1.西南医科大学附属医院核医学科(泸州646000);2.核医学与分子影像四川省重点实验室(泸州646000);3.西南医科大学核医学研究所(泸州 646000)
感染病灶迅速准确的定性与定位诊断对感染患者的临床正确处置至关重要。放射性核素显像是实现感染病灶早期诊断的重要手段之一[1]。正电子核素68Ga与citrate 标记制成显像剂成功应用于各类疾病,包括各种感染的PET-CT 显像[2-16],但68Ga-citrate 炎症显像机制并未完全清楚。在对软组织感染进行显像时,68Ga在脓肿处摄取明显[17],而有研究证实尾静脉注射68GaCl3后在软组织感染处几乎没有68Ga 摄取[18],这说明了柠檬酸在68Ga-citrate显像的分子机制中可能发挥了一定的作用。本研究首次用荧光定量PCR调查感染小鼠68Ga-citrate 炎症显像机制中相关转铁蛋白TF基因Trf、转铁蛋白受体TFRC基因Tfrc和乳铁蛋白TLF基因Ttf的表达,同时鉴定mMATE1转运子基因Slc47a1的表达,结合阻断实验和PET-CT 显像,探讨68Gacitrate感染显像的可能机制。
1 材料和方法
1.1 实验材料、试剂和设备
68Ge/68Ga 发生器购自德国ITG(Isotope Technologies Garching GmbH)公司。用0.05 M 超纯HCl 洗脱发生器获得68GaCl3。胰蛋白胨大豆肉汤购自北京酷来搏科技有限公司,胰蛋白胨大豆琼脂购自北京百奥莱博科技有限公司,2-(膦酰基甲基)戊二酸(2-PMPA),乙胺嘧啶和柠檬酸钠购自阿拉丁(上海)试剂有限公司,ITLC-SG 薄层层析纸购自GE 公司;耐甲氧西林金黄色葡萄球菌ATCC43300购自北纳创联生物科技有限公司;CRC-55tRxing 放射性核素活度计购自Capintec公司。
1.2 实验动物
7周龄SPF级ICR雄性小鼠27只,购自成都达硕实验动物有限公司。本实验经西南医科大学实验动物伦理委员会批准。
1.3 68Ga标记柠檬酸与检测
先配制0.1 M 的柠檬酸钠。用4 mL 0.05 M HCl 淋洗68Ge-68Ga 发生器,取中间2 mL;按1 mCi68Ga∶100 μL 0.1 M 柠檬酸钠的比例混合反应液,加入无菌水至500 μL,常温下反应20 min;过除菌滤膜(Merck,vented Millex-GS,0.22 μm)。
纸层析TLC 检测标记率。使用ITLC-SG 为固定相,标记产物点样后,以甲醇∶1 M 醋酸钠(1∶1,v/v)为流动相鉴定标记产物的放射性化学纯度。
1.4 炎症小鼠模型的建立与取样
取活化后的金黄色葡萄球菌至新的NB 肉汁培养基中,37 ℃200 rpm震荡培养过夜,再取培养后的金黄色葡萄球菌至新的NB 中37 ℃200 rpm 震荡培养2 h,用PBS 缓冲液重悬至OD600=0.6。取金黄色葡萄球菌5×105cfu(菌落形成单位),用胰岛素针注射至左腿排肠肌处,注射后分别在0、1、12和96 h时间点用手术刀取注射处或感染处组织,液氮速冻,-80 ℃保存备用。
1.5 RNA提取、反转录成cDNA、PCR检测和实时荧光定量PCR
用 实 时 荧 光 定 量PCR 鉴 定 基 因Trfc、Trf、Ttf、Slc47a3和SLC3A5的表达。TFRC 是转铁蛋白受体,结合Fe的转铁蛋白TF会和转铁蛋白受体结合,通过细胞内化进入到细胞中[19]。68Ga-citrate 通过尾静脉注射进入小鼠体内后,作为Fe的类似物68Ga会和TF以及乳铁蛋白TLF 结合[6,8-9],多药及毒性化合物外排转运子1(multidrug and toxin extrusion1,MATE1)可能参与转运柠檬酸的外排[19-20],预计TF 基因Trf、TLF 基因Ttf表达量会增高,因而转铁蛋白受体基因表达会增高,小鼠mMATE1 基因Slc47a1表达量也会增高,NaCT 是Na+耦联的柠檬酸内向转运子[20],选用此转运子基因SLC13A5作为基因Slc47a1的阴性对照。
按照RNeasy MicroKit 试剂盒(RNA 微量提取试剂盒,QIAGEN,Germany)提供的方法提取RNA。使用Nano Photometer 分光光度计(IMPLENCN,USA)测定RNA纯度和浓度,用变性琼脂糖凝胶电泳测定RNA的完整性。
使用强效SYBR Green Cells-to-CT™试剂盒(Thermofisher)反转录所取组织的RNA,使用1 μg RNA 和Oligo(dT)反转录成cDNA,对cDNA 用actaα基因进行检测,PCR程序为95 ℃预变性3 min;然后95 ℃1 min,53 ℃30 s,72 ℃30 s,30个循环;最后72 ℃延伸5 min。引物为:F:ATCTTCCGCCTTAATACT,R:GCCTTCATACATCAAGTT。按照试剂盒提供的方法荧光定量PCR测定Slc47a1、Tfrc、Trf、SLC13A5和Tlf基因的表达,以小鼠肌动蛋白基因actaα为内参基因。荧光定量PCR 程序为:93 ℃预变性2 min;然后93 ℃1 min,55 ℃1 min,72 ℃1 min,40 个循环;最后72 ℃延伸7 min。各基因引物为:
1.6 炎症模型和阻断实验小鼠的PET-CT显像
取金黄色葡萄球菌5×105cfu 注射至ICR 小鼠的左后腿处,4 d后形成脓肿[17-18]。形成脓肿1 d后,尾静脉注射68Ga-citrate 至炎症小鼠,使用西门子Inveon MM Gantry STDCT PET-CT 60 min 后行PET-CT 显 像;采用相同方法,以68GaCl3作为68Ga-citrate 的对照,将68GaCl3注射至炎症小鼠行PET-CT 显像;以正常小鼠作为炎症小鼠的对照,将68Ga-citrate 注射至正常小鼠行PET-CT显像。阻断实验中,mMATE1阻断剂乙胺嘧啶溶于体积比为90∶5∶5 的生理盐水、乙醇和TWeen80溶液中,通过尾静脉按每只炎症小鼠20 μmol/kg 的量注入乙胺嘧啶,1 d 后注入68Ga-citrate(15 MBq),60 min 后行PET-CT 显像。用mMATE1 非阻断剂2-PMPA 作为对照,将2-PMPA 溶于生理盐水中,通过尾静脉按每只炎症小鼠20 μmol/kg 的量注入2-PMPA,1 d 后注入68Ga-citrate(15 MBq),60 min 后行PET-CT 显像。总共5组实验,每组实验的小鼠数量为3,在同一天进行。使用西门子Inveon Research Workplace 分析软件通过感兴趣区计算感染损伤部位、对照组织、心脏、膀胱的SUVmax。
1.7 统计学分析
使用IBM SPSS 21.0 和GraphPad Prism 8.0 进行数据分析。数据表示为均数±标准差(),两个样本均数比较采用t检验,多个样本均数比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD 法,P<0.05表示差异具有统计学意义。
2 结果
2.1 68Ga标记柠檬酸和放射化学纯度测定
用洗脱下来较高浓度的68Ga(中间2 mL)标记柠檬酸,室温下反应20 min。以ITLC-SG 为固定相,甲醇∶醋酸钠(1∶1,v/v)为流动相进行薄层层析分析测定放射化学纯度。结果表明柠檬酸的68Ga 的标记率达到99%,68Ga-citrate 在前沿30 mm,保留分数(retention fraction)Rf=1,见图1A,而直接洗脱的68Ga 在前沿10 mm,Rf 值为0.3,见图1B。标记结果表明从68Ge/68Ga发生器上直接洗脱下来的68Ga在室温下就可以直接标记柠檬酸。放化纯和产率都比较高,且只需过除菌滤膜,无需进行其它处理。
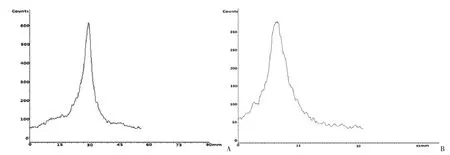
图1 68Ga-citrate放射化学纯度测定Figure 1 Radiochemical purity of 68Ga-citrate
2.2 小鼠感染组织的RNA提取与反转录
用金黄色葡萄球菌感染小鼠左后腿,分别在0、1、12 和96 h 取样,用RNeasy MicroKit 试剂盒提取小鼠感染组织的RNA,分光光度计测得所提RNA 的OD260/OD280的比值均在1.9~2.2 之间,OD260/OD230的比值均在2.0~2.3之间,纯度较好,符合要求。变性琼脂糖凝胶电泳检测完整度表明RNA3个条带清晰可见,18S条带亮度约为28S 条带的1/2,因而RNA 完整度较好,见图2A。取1 μg RNA反转录成cDNA,用actin肌动蛋白基因actaα检测cDNA,PCR扩增的条带约为296 bp,结果符合预期,因而cDNA可以用于下游的荧光定量PCR实验,见图2B。

图2 RNA检测完整性和cDNA检测Figure 2 RNA and cDNA test
2.3 68Ga-citrate PET-CT 炎症显像机制相关基因的实时荧光定量PCR检测
用金黄色葡萄球菌注射小鼠,在不同时间点取样(方法1.4),对68Ga-citrate PET-CT 炎症显像机制中相关基因Trf、Ttf、Tfrc和mMATE1 转运子基因Slc47a1在感染处的表达量用实时荧光定量PCR 进行鉴定。Tfrc基因在1 h时间点的表达量最高(1 091.36±30.76),该基因在0 h时间点表达量也很高(290.84±10.62),两者有极显著性差异(t=52.08;P<0.01),见图3A。其它预计表达量增加的Trf基因和Ttf基因在感染诱导的后期高表达,Trf在感染诱导96 h 时高表达(57.21 ±11.62),而Ttf在感染诱导的12 h 即开始高表达(43.03±6.8),见图3B,表达量与各自的0 h 小时时间点相比均有极显著性差异(t=35.35,t=12.05,P<0.01),与预期的也比较相符。而mMATE1 基因Slc47a1的表达量在1 h 时也增强(28.79 ± 2.16),与0 h 时间点表达量(8.21±1.23)相比有极显著差异(t=8.22,P<0.01),与Na+耦联的柠檬酸内向转运子NaCT基因表达量相比也有极显著的差异(1.67 ± 0.51,t=8.22,P<0.01)(图3B)。NaCT 基因SLC13A5在所有时间点都低表达,受感染诱导的基因表达都有一个特点,即转运子基因在感染诱导的初期表达,而非转运子基因Trf和Ttf在感染后期诱导表达(图3)。
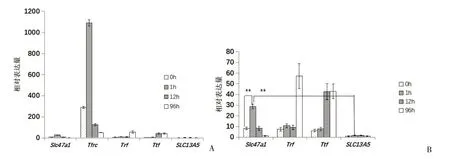
图3 荧光定量PCR鉴定68Ga-citrate炎症显像机制相关基因表达Figure 3 Identification of related gene expression for 68Ga-citrate inflammation imaging using real-time PCR
2.4 PET-CT对mMATE1转运子功能的验证
为了对mMATE1转运子在感染中可能的功能进行验证,按照方法1.6 进行各处理组的PET-CT 显像。如图4 所示,方差分析表明各处理方式对尾静脉注射68Ga-citrate 后68Ga在小鼠左后腿相应部位的聚集有显著性影响(F-检验,P<0.01),见表1,在炎症小鼠中可见在左后腿注射部位有明显的68Ga 聚集(图4A,图5,表1),在正常小鼠相应部位未见明显的68Ga聚集(图4E,图5,表1),二者差异具有统计学意义(表1),未注射的右腿也未见明显的68Ga聚集(图4E,图5,表1),除了左后腿处理部位外,炎症小鼠中68Ga 主要在膀胱聚集,而正常小鼠中可见68Ga 主要在心脏和膀胱处聚集(图4E,表1)。用mMATE1 转运子抑制剂乙胺嘧啶阻断炎症小鼠mMATE1 转运子后行PET-CT 显像,可以观察到68Ga在注射部位聚集明显减少(图4 B,表1),与未阻断炎症小鼠(图4A)相比有显著性差异(图4 B,表1),且68Ga 在心脏部位聚集明显增多(图4 A、4B,表1)。而用类似的方法,用PSMA阻断剂2-PMPA处理感染小鼠,行PET-CT 显像未见68Ga 明显减少,与乙胺嘧啶阻断相比有显著性差异,与未阻断炎症小鼠相比没有显著性差异(图4B、4C,图5,表1),且二者在心脏和膀胱处的聚焦也没有显著性差异(图4A、4C,表1)。用68GaCl3尾静脉注射炎症小鼠在感染部位并未见明显的68Ga聚集,68Ga主要在心脏部位聚集(图4D,表1),所以可以判断炎症小鼠模型构建成功,68Ga-citrate 对金葡菌诱导的感染显像效果较好,GaCl3对金葡菌诱导的感染显像效果较差,mMATE1 转运子对注射68Gacitrate 显像剂后造成的68Ga 在感染部位的富集可能发挥了一定的作用。
表1 尾静脉注射68Ga-citrate或68GaCl3各处理小鼠相应部位的SUVmax(,n=3)Table 1 SUVmax of corresponding parts or organs from mice receiving68Ga-citrate or 68GaCl3(,n=3)

表1 尾静脉注射68Ga-citrate或68GaCl3各处理小鼠相应部位的SUVmax(,n=3)Table 1 SUVmax of corresponding parts or organs from mice receiving68Ga-citrate or 68GaCl3(,n=3)
注:PYR:乙胺嘧啶;a表示与炎症小鼠+68Ga-citrate组比较,P <0.05;b 表示与炎症小鼠+PYR+68Ga-citrate 组比较,P <0.05;c 表示与炎症小鼠+PMPA+68Ga-citrate 组比较,P <0.05;d 表示与正常小鼠+68Ga-citrate组比较,P <0.05。
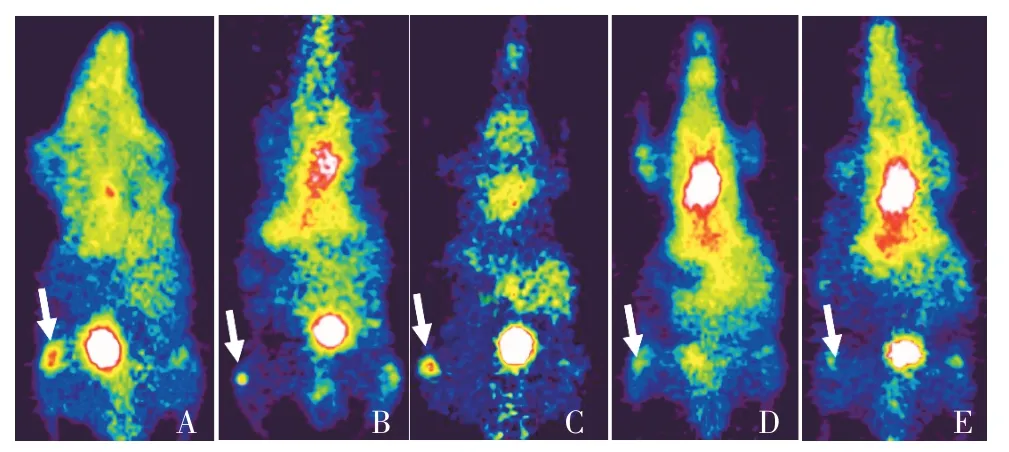
图4 炎症小鼠和正常小鼠的PET-CT显像Figure 4 PET-CT imaging of healthy mice and inflammed mice
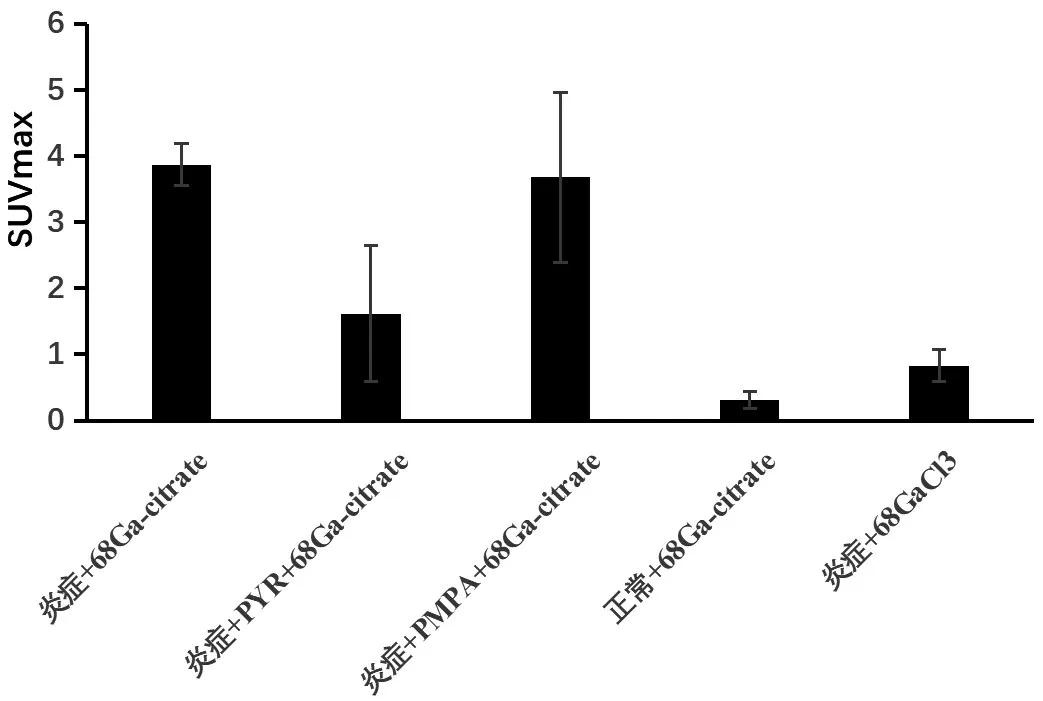
图5 注射68Ga-citrate或68GaCl3至炎症小鼠或正常小鼠各处理组左后腿相应部位SUVmax值Figure 5 SUVmax value of left hind legs in respective treatment after injection of 68Ga-citrate or68GaCl3 into inflammatory or normal mice
3 讨论
3.1 柠檬酸与68Ga-citrate炎症显像机制可能的关系
柠檬酸是一种有机杀菌剂,可对引起干腐病的镰刀菌(Fusarium sulphureum)起到抑制作用[21]。细菌的生存都需要一个特定的pH,柠檬酸的酸性可以改变细胞内的pH值并影响细菌的正常代谢,同为三羧酸循环中的中间产物琥珀酸具有抑制金黄色葡萄球菌的能力,这暗示了柠檬酸可能也具有抑制金黄色葡萄球菌的能力。柠檬酸具有收缩、增固毛细管,降低通透性,提高凝血功能及血小板数量的作用,可缩短凝血时间和出血时间,这些功能与炎症反应相反。高粱(Sorghum bicolor)在受到铝毒胁迫时,在外排机制中,可由转运子MATE 分泌出柠檬酸以络合有毒的铝离子,阻止其进入细胞内从而避免植物根细胞遭受铝毒胁迫[22]。人类的hMATE1 基因主要在肝和肾中表达,hMATE1 是H+耦联的电中性转运子,定位在泌尿小管和胆汁小管的腔膜上,介导有毒有机阳离子转运进入尿和胆汁中。小鼠mMATE1 基因Slc47a1除了在肾和肝上表达外,也在脑神经胶质细胞、毛细血管、胰腺管细胞和膀胱上皮等位置表达,表明mMATE1 除了从机体中转运有毒有机阳离子之外,也可能涉及到多种生物学功能[20]。因而推测转运子MATE 可能转运68Gacitrate,在68Ga-citrate 的感染显像中发挥了一定的作用。
3.2 68Ga-citrate的标记及PET-CT显像
68Ga的半衰期为68 min,能量为2.92 MeV,具有较高的能量和易定量的特征。68Ga每单位的剂量是2.6×10-2mSv/MBq,无论是在半衰期、辐射剂量、检测的灵敏度,还是在诊断疾病的广度和潜力上,68Ga-citrate都要优于67Ga-citrate[3-16]。68Ga 前处理比较繁杂,从68Ge-68Ga发生器上淋洗下来的68Ga 的纯化需要阳离子交换树脂,80%丙酮盐酸去除金属杂质,98%丙酮盐酸纯化和加热煮沸。68Ga 的半衰期比较短,其繁杂的纯化过程必然会降低68Ga-citrate 的产量,王玲等[17]用68Ga 和柠檬酸钠直接反应,产物过滤膜调pH值至4,结果表明标记产物68Ga-citrate能够很好的对金黄色葡萄球菌诱导的感染进行PET-CT 显像,且不同时间点的PET-CT 显像结果显示脓肿处于75 min 摄取显像剂最多,不同时间点的正常Balb/c 裸鼠显像结果显示68Ga 在膀胱处摄取最多,心脏次之。而本研究中的标记方法也是采用直接标记法,且不用调节pH值,方法更加简单易行,标记产物同样能对金黄色葡萄球菌诱导的感染进行PET-CT 显像(图4A)。柠檬酸是三羧酸类化合物,含有三个羧基,酸性较强,柠檬酸电离后的主要存在形式和pH值有关,pH值在7左右时,柠檬酸全部电离成citrate3-,容易与68Ga3+形成配位键且不易解离。故本研究中标记产物没有调节pH值,反应体系的pH值在6左右,恰好是柠檬酸易于络合68Ga3+的酸碱度。
3.3 Tfrc、Trf、Ttf和Slc471基因在感染处的表达
临床上各炎症显像剂的显像机制已得到部分阐明[23]。67Ga/68Ga-citrate 作为炎症病灶显像剂在临床应用已有几十年的历史,但其机制并未完全阐明,炎症病灶67Ga/68Ga-citrate显像剂摄取增高机制可能是多种机制的共同作用结果,除了血供增加、血管通透性增加、代谢增高、肿胀导致的病灶回流降低(淋巴及血液回流)之外,还包括转铁蛋白转运和白细胞富集导致的乳铁蛋白在炎症病灶处富集等。当pH 值在7.4 左右,转铁蛋白TF 会与Fe3+结合形成Fe-TF 复合体,Fe-TF 可靶向转铁蛋白受体TFRC,通过细胞内吞作用进入胞内,而在酸性条件下,Fe3+会从Fe-TF 复合体上解离下来。TFRC 在需要大量铁的癌细胞,破骨细胞,激活的淋巴细胞和有核红细胞上高表达。67Ga作为Fe的类似物,在血液中同样会和TF结合,通过TFRC介导的细胞内吞作用在各种实体瘤上富集[24]。但也有研究指出67Ga-TF是通过非特异性的结合在肿瘤细胞上富集,而非通过TFRC 介导的细胞内吞作用[25]。68Ga-citrate尾静脉注射炎症小鼠后,68Ga 会和转铁蛋白TF 结合,到达炎症处,由于pH 值降低,68Ga-TF 发生解离,68Ga会和结合力更强的乳铁蛋白TLF结合[23,26-27],乳铁蛋白也是转铁蛋白家族中的一员,所有的乳铁蛋白都有相同的铁结合位点,相较于TF,在更低的pH 值条件下也能结合Fe。有研究指出67Ga在炎症处的富集是由于迁移到炎症处的白细胞释放的乳铁蛋白结合67Ga 造成的[19]。故推测TF 和TLF 对应的基因在炎症处会高表达,而68Ga-TF 复合体会结合到转铁蛋白受体TFRC上,进一步推测TFRC 基因Tfrc在炎症处也会高表达,我们用荧光定量PCR 技术鉴定这些基因的表达量,首次从分子水平上证实了这些基因受到感染诱导而高表达。且在上述所有基因中Tfrc基因在感染部位受促炎因子诱导表达量最高,且在0 h 时间点表达量也很高(图3A)这表明了转铁蛋白受体是持家基因,有重要的生物学功能,在感染形成的初期会被诱导大量表达,印证了在感染处转铁蛋白受体TFRC 会和68Ga-TF 结合,形成68Ga-citrate 炎症显像分子机制之一。mMATE1基因Slc47a1受感染诱导在1 h 左右高表达,显著高于同时间点的NaCT 基因SLC13A5的表达,这暗示了mMATE1转运子可能参与炎症显像机制。转运子基因在感染初期被诱导,非转运子基因后期被诱导表达的可能原因是转运子随着感染的形成逐渐在感染部位先组装好,感染后期TF 和TLF 基因被诱导表达,与相应的转运子相互作用,以对感染做出应答。
3.4 mMATE1转运子可能参与对感染的应答
人类MATE1基因有两个成员hMATE1和hMATE2,hMATE1主要在肝、肾和骨骼肌上表达,hMATE2主要在肾上表达。小鼠的mMATE1 蛋白和人类的hMATE1蛋白序列相似性高达78.1%,表明了小鼠的mMATE1转运子和人类的hMATE1在表达部位和转运特性上都较为相似。mMATE1 除了在肝和肾中高表达之外,一个显著的特点就是在导管和腔体的表皮细胞上高表达[20]。在有机阳离子被位于肾小管和肝细胞上的有机阳离子转运子(organic cation transporter,OCT)转运进细胞后,mMATE1 转运子在糖蛋白的配合下将有机阳离子转运至体外,即mMATE1 转运子转运有机阳离子是介导有机阳离子转运出细胞的最后一步[20]。本研究首次证实mMATE转运子基因Slc47a3受金葡菌感染诱导表达,阻断实验表明mMATE1 转运子可能参与感染应答。mMATE1是H+偶联的反向转运子,感染处pH值降低,这可能为mMATE1 转运68Ga-citrate 或其它68Ga复合物至感染处提供驱动力。68GaCl3尾静脉注射进炎症小鼠后,在感染部位68Ga聚集较少,主要积聚在心脏处,这可能说明了68GaCl3不能作为mMATE1 的底物而在感染处聚集。但是和68GaCl3在未处理部位相比,SUVmax值却有明显差异(图4D,表1,t检验,P<0.05),说明血管通透性增加的确是炎症显像机制之一。各处理组中,68GaCl3注射进炎症小鼠体内后主要在心脏中聚焦,而在膀胱中聚集比较少,动态显像也证实了这一点[18],而68Ga-citrate 注射进炎症小鼠或正常小鼠体内后在膀胱聚集比较多,说明mMATE1 与68Ga-citrate 注射进小鼠体内后68Ga 在膀胱处聚焦可能有一定的关系。mMATE1 在感染处早期被诱导表达后,推测在感染部位组装,具体的组装部位可能在围绕脓肿腔体壁的细胞膜上,为转运68Ga-citrate 或其它有机阳离子做准备。本研究鉴定了SLC13 转运子家族成员NaCT 的基因SLC13A5的表达,与mMATE1不同,NaCT是Na+耦联的内向的柠檬酸转运子,对pH值敏感。鉴定结果表明NaCT 转运子基因SLC13A5在任何时间点的表达量都维持在本底水平(图3),可能的原因:一是该转运子的驱动力是Na+,二是该转运子转运方向是向细胞内,与机体对感染的应答无关。这进一步验证了了mMATE1转运子在炎症处可能的功能。阻断实验证实mMATE1被阻断,注射68Ga-citrate 后,感染处仍然有相当量的68Ga(表1,图5)摄取,这表明mMATE1转运子在感染处可能的功能是炎症显像多种机制之一。综上,我们得出mMATE1转运子在68Ga-citrate炎症显像机制中可能参与的功能是:68Ga-citrate 注射体内后,部分通过毛细血管内皮连接处渗漏进炎症组织,可能由有机阳离子转运子OCT将其转运至围绕在脓肿的腔体细胞内,再由mMATE1转运子将其转运至脓肿处,对脓肿起到抑制作用或其它生物学功能。
3.5 本研究的不足之处
本研究在为荧光定量PCR 鉴定相关基因表达进行取样时,前期所设时间点较少,这可能捕捉不到mMATE1 基因Slc47a1或TFRC 基因Tfrc表达的最高值,相较于Tfrc,Slc47a1在前期的最大表达量较小可能与此有关系。另外,没有取每个时间点的未感染组织作为对照,而只用注射后0 h 代替未感染组织,也可能有一定的误差。
4 结论
本研究首次用荧光定量PCR 技术鉴定了与68Gacitrate 炎症显像机制密切相关的转铁蛋白受体TFRC基因Tfrc、转铁蛋白TF基因Trf和乳铁蛋白TLF基因Ttf在感染处的表达,证实了Tfrc、Trf、Ttf在感染处高表达,多药及毒性化合物外排转运子mMATE1 基因Slc47a1也受细菌感染诱导高表达。阻断实验使用PET-CT 技术证实了mMATE1转运子在68Ga-citrate炎症显像中可能有一定的功能,即与有机阳离子转运子OCT 配合,将68Ga-citrate转运至脓肿处行使相应的生物学功能。

