体外生产红细胞:进展与挑战
王 辉,张进进,陈立力,邢颜超
1新疆医科大学研究生院,乌鲁木齐 830054 2新疆军区总医院输血医学科,乌鲁木齐 830000
血液短缺是世界范围内的普遍问题。临床上使用的血液主要来源于公民无偿献血,2021年我国千人献血率仅为12%[1],临床用血需求与献血量之间存在巨大缺口。特别是COVID-19暴发后,健康献血者减少等因素使多地血液库存告急,捐献血液的供需矛盾在突发卫生事件发生时更加突显。此外,传统输血还有可能传播疾病和导致同种异体免疫风险[2]。研究者们曾使用全氟化氮等氧气载体试图替代捐献血液,但由于其具有副作用,仅可在特殊情况下使用,无法替代红细胞输注[3]。目前研究主要集中于体外生产红细胞,从理论出发,采用此种技术生产的红细胞可大量扩增,若能进一步证明其安全有效,则将成为红细胞捐献的理想替代品[4]。本文就体外生产红细胞的来源及应用(图1、表1)进行综述,并分析目前所面临的挑战,以期为输血治疗提供新思路。

表1 不同途径体外生产红细胞的区别Tab.1 Differences in in vitro production of red blood cells by different approaches
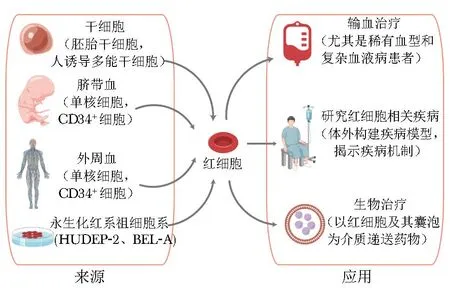
图1 体外生产红细胞的来源及应用Fig.1 Sources and applications of red blood cells produced in vitro
1 体外生产红细胞的来源
1.1 多能干细胞
1.1.1 人胚胎干细胞分化为红细胞
胚胎干细胞最突出的优点是无限的自我更新能力,可在适当培养条件下分化为多种细胞。最初研究者们对这一来源十分乐观,然而实验结果却并不尽如人意。研究者们使用血管内皮生长因子、干细胞因子、白细胞介素等细胞因子成功从人胚胎干细胞中分化出红细胞,但得到的红细胞扩增率和去核率均不理想,终末期成熟也受到限制[10-12],相关研究在过去10余年间进展缓慢,且人胚胎干细胞的使用在伦理上饱受争议,因此研究者们对这一途径的关注度逐渐降低。值得注意的是,Wang等[5]发现人胚胎干细胞衍生的红细胞中,细胞周期相关基因的表达水平较脐带血来源的红细胞显著降低,这一发现有助于提高扩增率。
1.1.2 人诱导多能干细胞分化为红细胞
通过转录因子从人体细胞中诱导产生的多能干细胞,其性质类似于胚胎干细胞[13]。由于人诱导多能干细胞来源广泛,且无伦理和免疫排斥问题,很快受到研究者的关注。随着研究的推进,人诱导多能干细胞存在的问题也逐渐暴露出来,如需复杂的造血分化系统来获得造血干细胞、生产的红细胞表现出原始红细胞特征、扩增率和去核率低[14-15],限制了其实用性。因此,探索人诱导多能干细胞分化为红细胞的过程、改进分化方法以及提高去核率是近年来研究者们关注的重点。Trakarnsanga等[16]研究了人诱导多能干细胞来源的红细胞分化期间波形蛋白的表达,表明此类细胞会在分化早期失调,影响去核率。而Bernecker等[6]构建了更加简单灵活且低成本的模型,该方法生产的红细胞可达到平均40%的去核率。
以人胚胎干细胞和人诱导多能干细胞为来源建立的细胞系在扩增潜力和基因编辑可行性方面较其他来源更胜一筹,但较低的扩增率和去核率制约了这一来源的发展。令人惊喜的是,人诱导多能干细胞在改进了分化方法后为该途径注入了新的希望,值得持续关注。
1.2 脐带血
脐带血含有的未成熟原始祖细胞具有优越的增殖和分化潜力。1 U脐带血的红细胞产量在理论上相当于500 U红细胞,且脐带血很少会被血源性感染因子污染或者发生衰老相关的细胞异常[13]。因其扩增潜力大、不易污染且易获取,研究者曾尝试从脐带血衍生的造血干细胞中扩增红细胞。Zhang等[17]在小鼠和非灵长类动物模型中验证了脐带血可生产有效的功能性人红细胞,特别是使用了转瓶装置使红细胞产量大增。Rallapalli等[7]使用注射药物替代培养基中的动物源性成分,从人脐带血中分离出的单核细胞生成红细胞。Xie等[18]认为除继续突破技术难题外,还应尽早制订细胞鉴定、纯度、安全性和有效性相关质控指标,进一步推动脐带血来源红细胞的临床应用。但这一来源因其原始细胞数量有限、生产的红细胞为胎儿表型而非成人表型,限制了其临床转化。
1.3 外周血
外周血是最易获取的来源,目前无须分离CD34+细胞,直接使用外周血单核细胞体外生产红细胞已得到研究者的普遍认可。使用外周血作为来源在体外生产红细胞的研究主要聚焦于提高扩增量,Heshusius等[19]利用生物反应器可扩增3×106倍,Liu等[8]通过BMI1基因的异位表达使转导红细胞扩增1012倍,且随着研究方案的不断改进,红细胞产量呈指数增加,去核率可达90%,在血红蛋白和血型的表达、变形性、氧饱和度等方面均与正常成人红细胞相似[19]。此外,由于外周血的供应很大程度上依赖于健康志愿者,因此难以避免伦理问题[13]。从需要分离CD34+细胞到直接使用单核细胞,再到生物反应器的加入,外周血来源生产红细胞的扩增量不断提升,且该技术限制少,有望最先成为捐赠血液的替代来源。
1.4 永生化红系祖细胞系
永生化红系祖细胞系是由影响细胞周期的病毒诱导的,可长时间稳定增殖并分化产生大量红细胞的细胞系[20],近年来成为探索体外生产红细胞途径的研究热点,主要涉及两种永生化红系祖细胞系,其中HUDEP-2(human umbilical cord blood derived erythoid progenitor-2)是Kurita等[21]于2013年建立的第一个体外生产去核红细胞的永生化人红细胞系,其使用四环素诱导系统构建表达人乳头瘤病毒(human papilloma virus,HPV)16-e6/e7基因的慢病毒载体以诱导脐带血来源的CD34+细胞产生HUDEP-2。而BEL-A(bristol erythr-oid line adult)则是2017年Trakarnsanga等[22]报道的第一个完全重现正常红细胞生成的永生化红系祖细胞系。在该研究中,来自成人骨髓的CD34+细胞经过培养去核产生的成熟网织红细胞,与成人网织红细胞在功能和分子水平上均无差异。与HUDEP-2相比,BEL-A的分化速率、红细胞产量、γ珠蛋白水平均更高[23]。然而从骨髓中分离CD34+细胞的高度侵入性限制了这一研究的发展,因此研究者尝试从更易获得的外周血中建立永生化红系祖细胞系。2021年,Bagchi等[24]从外周血单核细胞中生成了永生化红系祖细胞系,在形态、红细胞特异性表面标志物、增殖分化能力及去核率方面均优于HUDEP-2,且与BEL-A相似。Daniels等[9]使用BEL-A的永生化方法从脐带血和外周血中亦成功生成了BEL-C和BEL-P细胞系,二者在蛋白质组、珠蛋白表达、分化谱等方面分别表现出胎儿及成人红细胞的特征。此外,最新研究指出,即使不终止HPV16 e6/e7的表达,从骨髓建立的永生化红系祖细胞系也能进行正常分化[25]。需要注意的是,目前所建立的永生化红系祖细胞系需由病毒转化,这可能会影响细胞特征,对其未来应用产生一定限制。但永生化红系祖细胞系仍展现出非凡的潜力,不仅对研究红细胞生成过程有重要意义,而且稳定可重复,有利于新型治疗产品的研发,相信未来将有更多针对该技术的改进和扩展。
2 体外生产红细胞的应用
2.1 临床输血治疗
红细胞是主要的血液输注成分,但来自献血者的红细胞不足以满足临床需求,且输血存在传播疾病的潜在风险。体外生产的红细胞在扩增能力和安全性等方面均展现出令人满意的前景。近期研究表明,BMI1转导的成人红细胞扩增倍数可以达到1012倍,并且保留了末端分化成熟的能力,去核率近50%[8]。除了巨大的扩增潜力,体外生产的红细胞在安全性上也更具优势,不仅无传播疾病的风险,且可以生产出缺少血型抗原的通用型红细胞,突破目前血型分型方法的限制[26],避免不匹配的输血所导致的严重后果,这对于稀有血型人群意义非凡。体外大规模生产红细胞用于全面的临床输血治疗尚需时日,但优先生产少量通用型红细胞用于稀有血型人群相信为时不远。此外,Kupzig等[27]首次报道了体外生产的红细胞较传统红细胞的存活时间更长,这说明体外生产的红细胞更加年轻,对于需要长期依赖输血治疗的患者,可延长输血的时间间隔,减少多次输血带来的铁沉积不良反应等问题。
2.2 疾病模型研究
目前,在探索体外生产红细胞的过程中取得了诸多技术突破,为利用体外生产红细胞技术制定疾病研究新策略带来更多可能。Trakarnsang等[28]利用血红蛋白E/β-地中海贫血患者的外周血干细胞分化出早期红细胞并生成永生化红系祖细胞系的疾病模型,了解患者红系细胞的球蛋白谱和无效红细胞生成水平,该模型可用于研究疾病机制和筛选新疗法,且能提供可持续的疾病细胞用于研究。红细胞是疟原虫无性复制的宿主,疟疾入侵和发育需要红细胞蛋白参与,然而这一过程的具体机制尚不明确,Satchwell等[29]研究表明,BEL-A体外分化产生的网织红细胞支持恶性疟原虫的侵袭和细胞内发育。此外,体外生产红细胞技术可持续产生用于研究的红细胞,为遗传学操作提供了可能,有助于疟疾相关发病机制研究[30]。这一技术克服了成熟红细胞无核的限制,实现了基因编辑技术的应用,使研究者对细胞学机制的探索有了新的切入点。
2.3 生物治疗
以细胞膜包裹纳米药物进行递送是近年来备受关注的治疗热点,基于细胞膜的仿生纳米颗粒能够逃离免疫系统监视,将药物靶向递送至病变部位。红细胞及其囊泡是膜的最佳来源,具有高生物相容性、低免疫原性、表面可修饰等优点,还可改善负载药物的稳定性,提高低渗透性药物的生物利用度,增强治疗效果[31-33]。目前已有诸多以红细胞及其囊泡为递送介质递送药物的治疗方法,且用于三阴性乳腺癌、胰腺癌、共济失调毛细血管扩张等疾病的治疗已进入Ⅲ期临床试验[34-35]。基于红细胞进行研究和应用的关键之一是获取大量红细胞,传统方法是将捐献血液离心,分离出红细胞,这一过程会使红细胞失去大量血红蛋白,同时膜的性质也会发生改变,导致药物输送效率降低[31],而体外生产红细胞可为研究者提供大量获取红细胞的新方式,极大促进该领域的发展[36]。因此以红细胞及其囊泡为递送介质进行生物治疗是体外生产红细胞技术最实用的应用方向。
3 体外生产红细胞面临的挑战
3.1 功能与寿命
为使体外生产的红细胞携氧、变形等能力与天然红细胞相当,确保红细胞的正常功能以及降低致瘤风险,需要去除细胞核,这也是体外生产红细胞的关键技术之一[11,37]。过去10年间,红细胞相关分子机制和信号通路相关研究众多,但仅有组蛋白脱乙酰基酶2(histone deacetylase2,HDAC2)被证实在体外产生红细胞的去核过程中发挥重要作用[38-39]。近几年体外生产红细胞主要通过各种红系分化培养基诱导红细胞成熟,然后过滤纯化获取无核红细胞,然而尚缺乏去除细胞核的具体方法。目前有研究认为巨噬细胞与红细胞去核有关,在去核阶段添加模拟巨噬细胞幼红细胞黏附蛋白(erythroblast macrophageprotein,EMP)可作为新的去核方法[20,40]。此外,研究发现尽管不同细胞来源的体外生产的红细胞携氧能力有所不同,但其表现均与相应的成人红细胞类似,这种差异可能是由血红蛋白的表达类型不同造成的[21-22],而就体外生产的红细胞寿命而言,研究者将成人供体红细胞和体外生产的红细胞输注进小鼠体内,二者的存活率无统计学差异[22]。在另一项研究中,体外生产的红细胞输注后的半衰期为26 d[37],也与天然红细胞的寿命一致,尚有待体内试验进一步加以验证。
3.2 生产规模受限
体外生产红细胞技术为大规模生产红细胞提供了可能性,但既往大部分研究中的生产规模较小,若要实现生产更多数量的红细胞,则需借助生物反应器[17,19,41]。相较于烧瓶,生物反应器数据更加可靠,还可降低劳动成本,缩小生产所需空间,减少人为错误[42]。虽然由于技术的限制,目前尚无可满足需要的生物反应器[43],但最新研究中生物反应器的培养体积已从300 mL扩大至2500 mL[44]。生物反应器的技术亟待改善,体外生产红细胞的高成本也是临床应用的主要障碍。针对这一问题,研究者提出可选择不需要CD34+分离的起始细胞,替换培养成分中的昂贵成分,增加培养细胞密度等方式降低生产成本[17,19,42]。
3.3 输血可行性测试尚少
Giarratana等[45]2011年首次将体外生产的红细胞输注到人体内,为其应用于临床输注提供了研究证据。Zhang等[17]在小鼠和非人灵长类动物模型中进行体外产生红细胞的安全性研究,经过对血细胞计数、血液生化、食欲、行为等参数的分析,未发现注射体外生产红细胞的不良影响。此外,小鼠和灵长类分别在注射后6个月、18个月正常存活,说明输注体外生产的红细胞具有长期安全性,这在一定程度上表明体外生产的红细胞可作为传统血液成分的替代品。一项RESTORE(REcovery and survival of STem cell Originated REd cells)试验报道了世界上首个同种异体输血临床试验,该试验纳入超过10名志愿者并接受来自其他供体的体外生产红细胞的输注,表明体外生产红细胞对稀有血型和有复杂输血需求的患者治疗具有重要意义[46]。体外生产的红细胞能够在循环中存活,但是否可安全用于人体仍有待更多研究。
4 小结与展望
体外生产红细胞是一项艰巨的生物技术挑战。在过去几年间,研究者们突破重重困难,优化了培养体系,提高了扩增率和去核率。虽然使用“人造红细胞”代替捐献血液还有很长的路要走,但体外生产红细胞对于输血治疗具有重要意义。这一技术将推进疾病模型的构建、纳米药物的递送以及输血治疗的发展,为输血治疗提供新的可能。未来需进一步探索体外去核方法且兼顾生物反应器的高产能与低成本,以及开展更多相关研究以证实体外生产的红细胞输注于人体安全可行。
作者贡献:王辉负责文献检索及论文撰写;张进进、陈立力负责论文修订;邢颜超负责选题设计及论文审校。
利益冲突:所有作者均声明不存在利益冲突

