肝硬化患者发生急性肾脏病预测模型的建立与验证
欧阳晶,常 虹,杨梦娇,张 梦,田 梦,郑 亚,王玉平,陈兆峰
1兰州大学第一临床医学院,兰州 730000 2兰州大学第一医院消化科,兰州 730000 3甘肃省消化系疾病临床研究中心,兰州 730000
肝硬化是以肝功能进行性降低及肝组织弥漫性纤维化为主要特征的晚期慢性肝病,随着病情进展可引起全身多脏器损伤并增加不良预后的风险[1]。由于有效循环血容量不足及肾内血流重分布等带来的影响[2],肝硬化患者常出现肾功能损伤[3],早期表现为功能性肾损伤,经积极治疗病情具有可逆性;若肾损害持续进展,可引起急性肾功能衰竭并危及患者生命[4]。因此,加强肝硬化患者肾功能监测、早期识别肾功能损伤具有重要意义[5]。
2017年改善全球肾脏病预后组织首次提出了急性肾脏病(acute kidney disease,AKD)的诊断标准[6],与现行定义不同,其早期定义为急性肾损伤(acute kidney injury,AKI)启动事件后≥7 d,出现AKI 1 期或更严重的肾功能异常,且持续时间超过90 d的 AKD 被认为是慢性肾脏病(chronic kidney disease,CKD)[7]。Tonon等[8]在研究中强调了AKD对于肝硬化人群的重要性。该研究共纳入324例肝硬化患者,随访期间共113例(34.88%)发生AKD;组间比较显示,发生AKD患者的5年死亡率明显高于未发生AKD者(P<0.001);多因素分析显示,AKD进展是5年死亡率的独立预测因子(HR=3.27,P<0.001)。Kellum等[9]研究表明,包括肝硬化在内的晚期肝病患者是AKD的极高危人群,临床应予以密切关注并制定科学的治疗、随访方案。列线图预测模型是一种可视化的风险评价方法,可直观反映个体发生某种疾病的概率,为临床医生制订临床决策提供了重要依据[10]。本研究旨在探索导致肝硬化患者发生AKD的独立危险因素,并建立列线图预测模型,以期为临床决策的制订提供有益指导。
1 资料与资料
1.1 研究对象
本研究为回顾性队列研究,连续纳入2017年1月—2022年1月于兰州大学第一医院消化科住院的肝硬化患者。纳入标准:(1)结合临床表现、血液学指标、影像学检查及肝穿刺结果,确诊为肝硬化;(2)年龄≥16岁。排除标准:(1)诊断肝硬化前即有慢性肾脏病史;(2)妊娠及哺乳期女性;(3)合并恶性肿瘤;(4)AKI诊断相关指标存在缺失者。
根据住院期间是否发生AKD,将入组的肝硬化患者分为AKD组与非AKD组,并按7∶3比例随机分为训练集和验证集。其中AKD被定义为存在AKI[11],或血肌酐(serum creatinine,SCr)增加>50%,或估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2),或eGFR较基线降低≥35%,持续时间<3个月,具体诊断标准符合2021年改善全球肾脏病预后组织发布的共识[12]。AKI诊断标准:7 d内SCr较基线升高>50%,或2 d内SCr升高>26.5 μmol/L,或尿量<0.5 mL/(kg·h),持续6 h。
本研究已通过兰州大学第一医院伦理审查会员会审批(审批号:LDYYLL2023-407),并豁免患者知情同意。
1.2 研究方法
1.2.1 资料收集
通过电子病历系统收集患者的临床资料(多次住院患者每次住院时的临床资料均被纳入),包括性别、年龄、住院时间、体质量指数、吸烟、饮酒、家族史(家族中是否有肝炎、肝硬化、肝癌病史)、基础疾病、肝硬化病因、用药史、既往内镜下治疗史、并发症、终末期肝病模型(model for end-stage liver disease,MELD)评分、血液学指标等。其中并发症包括:腹水、肝性脑病、消化道出血、感染、肝肾综合征等、门静脉血栓/门静脉海绵样变等[13]。血液学指标(AKD组为入院确诊后首次检测结果,非AKD组为入院后首次检测结果)包括:(1)血常规:红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)、红细胞压积(hematocrit,Hct)、红细胞分布宽度标准差(standard deviation of red blood cell distribution width,RDW-SD)、红细胞分布宽度变异系数(coefficient variation of red blood cell distribution width,RDW-CV)、白细胞(white blood cell,WBC)、中性粒细胞百分比(neutrophil percent,Neut%)、中性粒细胞绝对值(neutrophil,Neut)、淋巴细胞绝对值(lymphocyte,Lymp)、单核细胞绝对值(monocyte,Mono)、血小板(platelet,PLT);(2)肝肾功能:谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶/谷丙转氨酶、白蛋白(albumin,ALB)、总胆红素、直接胆红素、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰基转移酶(Gamma-glutamyl transfer-ase,GGT)、二氧化碳、血尿素、SCr;(3)电解质及生化:血钠(natrium,Na)、血钾(kalium,K)、血氯(chlorine,Cl)、血钙(calcium,Ca);(4)凝血指标:凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、国际标准化比值(international normalized ratio,INR)、纤维蛋白原(fibrinogen,FIB)。
1.2.2 检验效能估算
由于预测模型的准确性受所采用的模型构建方法、数据处理、变量选取等多方面因素的影响,难以进行准确的样本量估算。参照既往文献[6,9,14-15],根据EVP10标准,多因素回归分析筛选的自变量为10个时,AKD组和非AKD样本均需达到100例为宜,本研究拟纳入肝硬化患者796例,其中AKD组103例,非AKD组693例,符合该标准。
1.3 统计学处理
采用R 4.2.3软件进行统计学分析。年龄、体质量指数、MELD评分等不符合正态分布计量资料以中位数(四分位数)表示,组间比较采用Man-WhitneyU检验;性别、肝硬化病因、并发症等计数资料以频数(百分率)表示,组间比较采用卡方检验。在数据分析过程中,若缺失数据小于该变量总数据的3%,则使用中位数插补法进行填补;若某变量/病例缺失数据较多且对整体数据影响不大时,直接剔除该变量/病例。采用LASSO回归法对肝硬化患者发生AKD的影响因素进行初筛,并采用多因素Logistic回归法进一步筛选AKD的独立影响因素。采用“rms”程序包绘制列线图,以便对个体发生AKD的风险进行展示。采用受试者工作特征(receiver operating characteristic,ROC)曲线、校准曲线和临床决策曲线分别从区分度、校准度和临床实用性3方面对模型的性能进行评价。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的肝硬化患者796例。其中AKD组103例,非AKD组693例;训练集561例,验证集235例。
AKD组与非AKD组在年龄、肝硬化病因、并发症、MELD评分方面以及多种血液学指标水平差异均具有统计学意义(P均<0.05),见表1、表2。训练集与验证集在患者年龄、肝硬化病因、并发症、MELD评分以及多种血液学指标方面差异均无统计学意义(P均>0.05)。
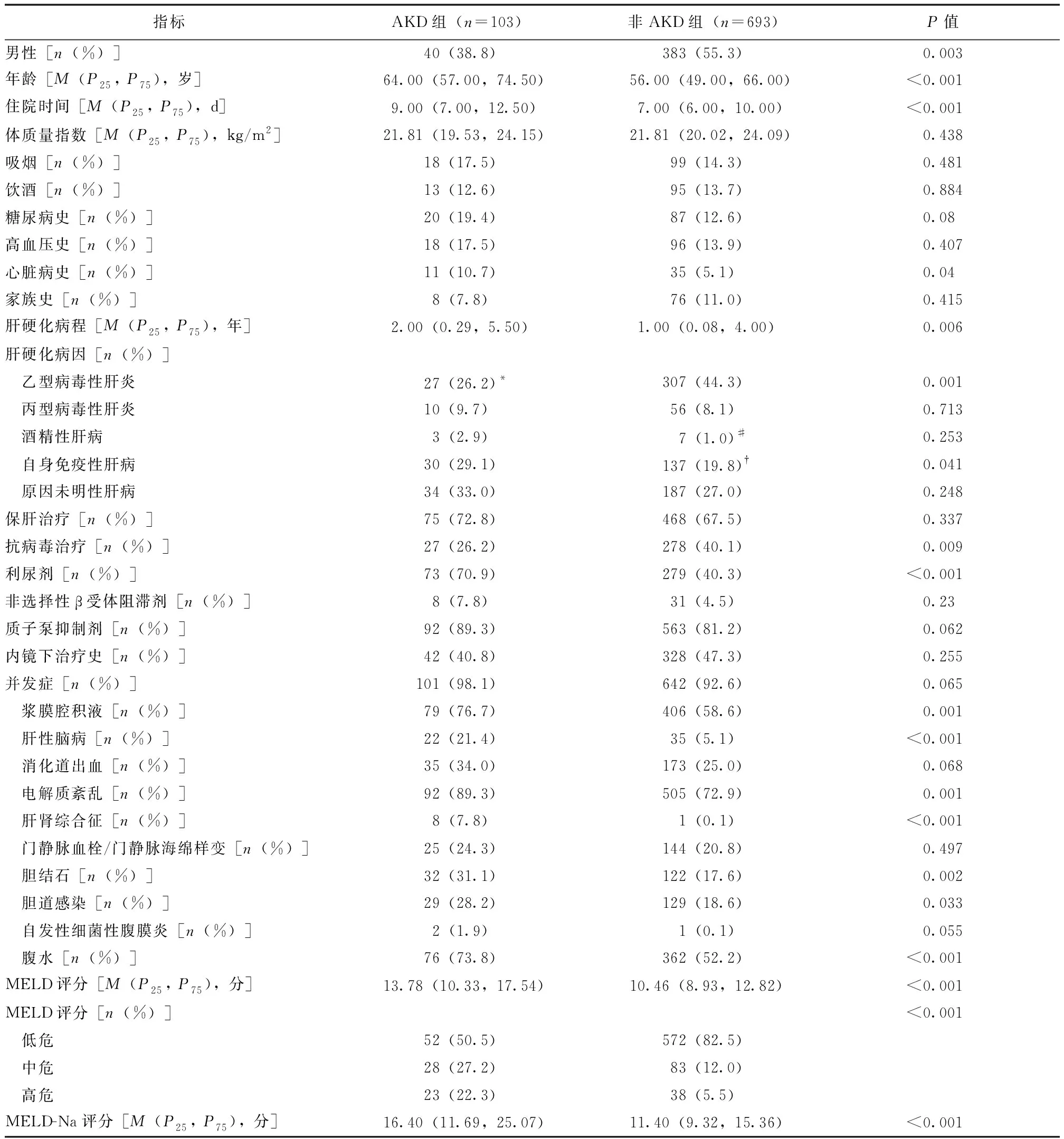
表1 AKD组与非AKD组临床资料比较Tab.1 Clinical datas between AKD and non-AKD groups

表2 AKD组与非AKD组血液学指标比较[M(P25,P75)]Tab.2 Hematologic indices between AKD and non-AKD groups[M(P25,P75)]
2.2 肝硬化患者发生AKD影响因素筛选及预测模型构建
在训练集中,首先通过LASSO回归分析进行变量初筛,采用十倍交叉验证法选取Lambda.1se为最佳λ值,初步选取了可能影响肝硬化患者发生AKD风险的10个因素,分别为性别、糖尿病史、肝硬化病程、肝性脑病、消化道出血、胆道感染、腹水、Hb、ALB、TT(图1),然后采用多因素Logistic回归法进一步对上述影响因素进行筛选,结果显示男性、糖尿病史、肝性脑病、消化道出血、腹水、Hb、ALB、TT为肝硬化患者发生AKD的独立影响因素(表3)。根据LASSO回归和Logistic回归分析结果,建立肝硬化患者发生AKD的预测模型。
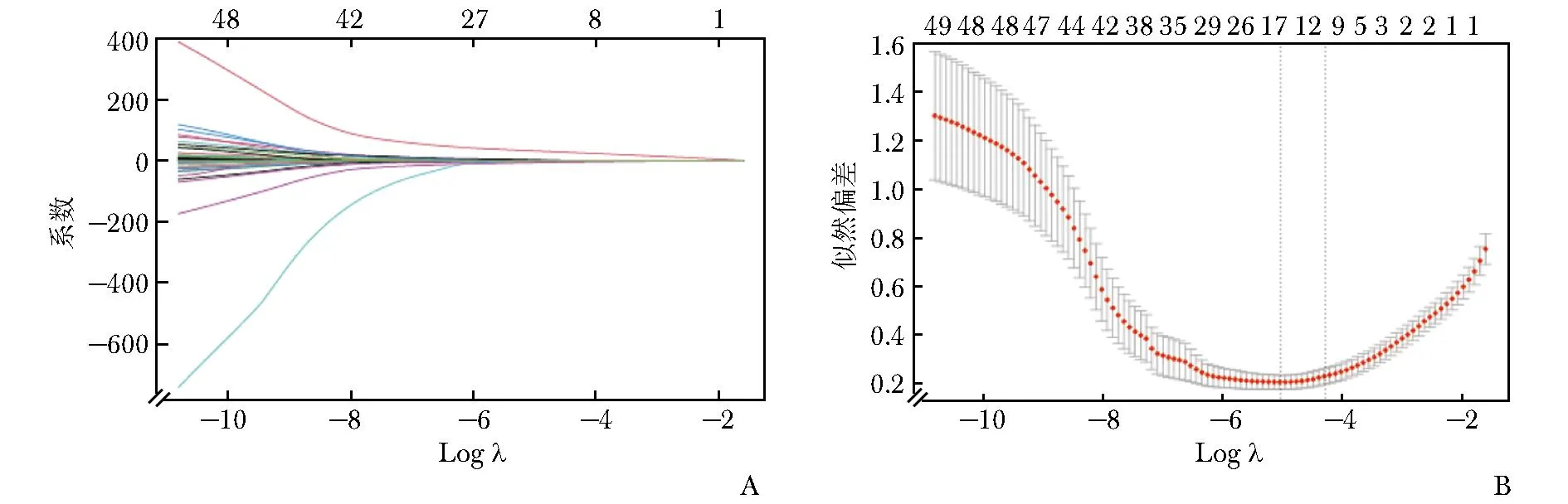
图1 基于LASSO回归的特征变量筛选A.十倍交叉验证图;B.收缩系数图Fig.1 Screening of feature variables based on LASSO regressionA.tenfold cross-validation plot;B.contraction factor plot
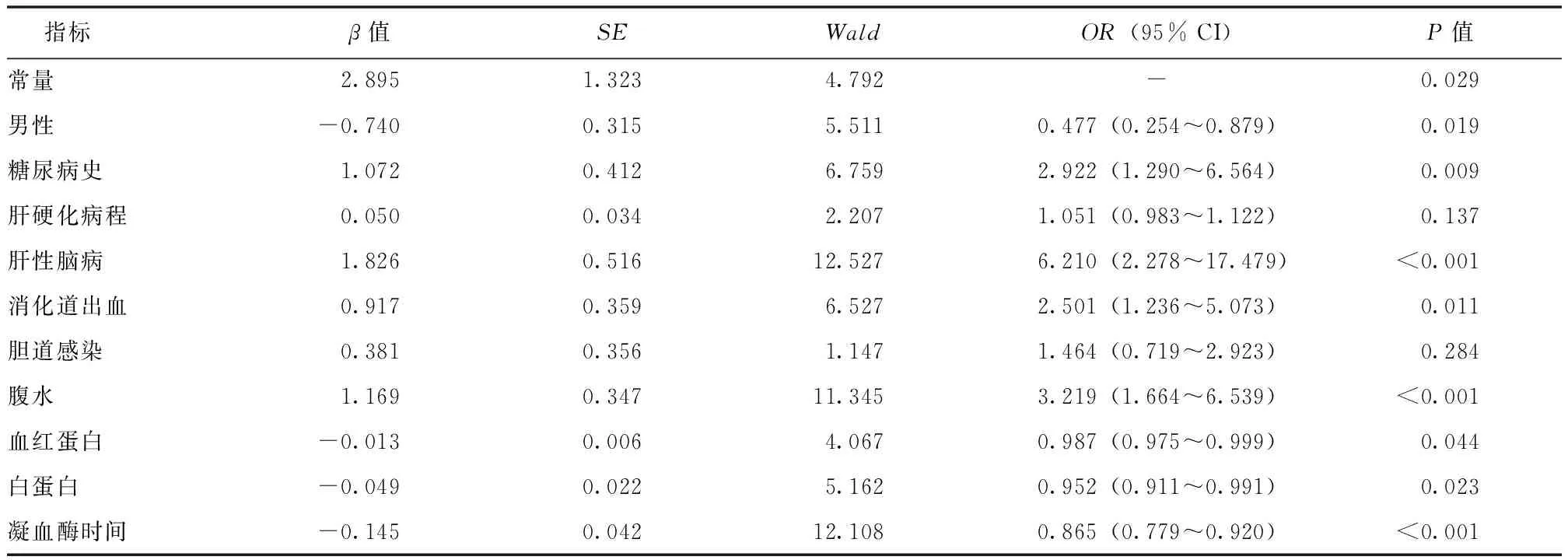
表3 肝硬化患者发生AKD影响因素的多因素Logistic回归分析结果Tab.3 Multifactorial Logistic regression analysis of factors influencing the occurrence of AKD in patients with liver cirrhosis
2.3 预测模型可视化
基于LASSO回归和多因素Logistic回归分析筛选的影响因素,采用“rms”程序包绘制肝硬化患者发生AKD列线图(图2),其可对个体化患者发生AKD的风险进行预测。临床使用时,根据患者临床资料首先可通过标尺获得各独立影响因素所对应的单项分值,然后将其相加获得总分值,最后在总分值数轴上,向下投射所对应的预测概率即为该肝硬化患者发生AKD的风险。
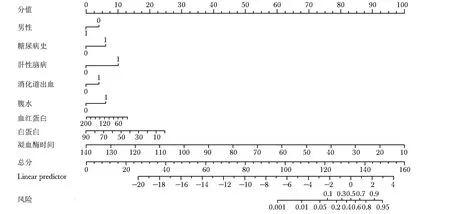
图2 肝硬化患者发生AKD的列线图预测模型Fig.2 Nomogram prediction model for the occurrence of AKD in patinets with liver cirrhoticAKD:同表1
2.4 预测模型评价
2.4.1 区分度
训练集中,模型预测肝硬化患者发生AKD的ROC曲线AUC为0.895(95% CI:0.865~0.925),最佳截断值为0.17,灵敏度为88.6%,特异度为80.7%。验证集中,模型预测肝硬化患者发生AKD的ROC曲线AUC为0.869(95% CI:0.807~0.930),最佳截断值为0.23,灵敏度为78.8%,特异度为87.6%。在训练集和验证集中AUC均>0.85,提示模型对AKD具有良好的区分度(图3)。
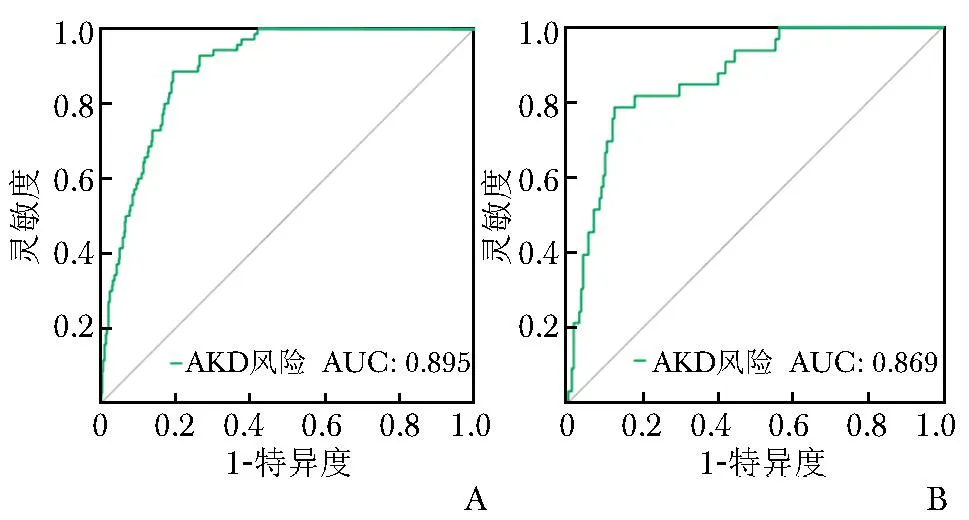
图3 模型预测肝硬化患者发生AKD的受试者工作特征曲线A.训练集;B.验证集Fig.3 Receiver operating characteristic curve predicted the development of AKD in patients with liver cirrhoticA.training set;B.validation setAKD:同表1
2.4.2 校准度
不管在训练集或是验证集,H-L检验示均显示模型的拟合度良好,P值分别为0.727、0.357。AKD预测值分布曲线与校准曲线贴合良好,即模型预测的AKD发生概率与实际情况较一致,提示预测模型具有较高的拟合度和一致性(图4)。

图4 预测模型在训练和验证人群中的校准曲线A.训练集;B.验证集Fig.4 Calibration curves of the prediction model in the training and validation setA.training set;B.validation setAKD:同表1
2.4.3 临床实用性
临床决策曲线显示,在两组数据集中,当阈值概率处于0.2%~62%范围内时,选择该模型预测AKD发生风险可使肝硬化患者临床获益,提示预测模型具有较好的临床实用性(图5)。

图5 预测模型的临床决策曲线A.训练集;B.验证集Fig.5 Clinical decision curves for predictive modelA.training set;B.validation setAKD:同表1
3 讨论
本研究基于796例肝硬化患者的临床资料,采用于LASSO回归和多因素Logistic回归法建立了肝硬化患者发生AKD的预测模型,并对模型的性能进行了评价,结果显示性别、糖尿病史、肝性脑病、消化道出血、腹水、Hb、ALB、TT为肝硬化患者发生AKD的独立影响因素,基于此影响因素建立的模型在训练集、验证集中预测肝硬化相关AKD的AUC分别为0.895、0.869,且具有较好的校准度及临床实用性,提示该模型在肝硬化患者发生AKD的风险预测方面性能较高,具有良好的应用前景。
肝硬化患者在病情进展过程中易出现肾功能损伤。文献报道[16-19],肾功能受损是肝硬化患者的严重并发症之一,发病率可高达20%~80%,而AKD是肾功能损伤的一种类型,为非急性AKI中不符合CKD的肾功能损伤状态,其可由AKI进展而来也可独立发生,并对患者临床预后造成不利影响。数据显示,相较于非AKD患者,AKD患者合并CKD与终末期肾病的风险约增高5倍,死亡风险增高3.5倍[20],故加强AKD的预防与识别具有重要意义。既往文献显示,肝硬化患者合并AKD的比例分布于14%~32%[9,21-22]。本研究结果显示,796例肝硬化患者中发生AKD者103例(13%),其发病率略低于文献报道,可能与入组人群或地域差异相关。
分析AKD发生的影响因素,并建立适宜的预测模型是提升临床对肝硬化相关AKD高危人群筛查与管理水平的重要辅助手段。本研究结果显示,糖尿病史、肝性脑病、消化道出血、腹水是肝硬化患者发生AKD的独立危险因素。糖尿病患者体内血糖升高可导致血管病变,而肾脏为其主要靶器官之一[23]。此外,糖基化蛋白亦可对肾脏产生不利影响,表现为肾小球滤过率降低,肾小球基底膜损伤,严重时可并发糖尿病肾病,增加AKD发生风险[24-25]。肝性脑病是肝硬化患者常见并发症之一,其与肾功能损伤呈现相互影响、互相促进的关系。一方面,肝性脑病可损伤中枢神经细胞,影响大脑调节功能[26],并诱发神经功能异常,引起酸碱失衡、水和电解质紊乱,直接影响肾小球滤过功能,导致肾功能损伤;另一方面,肾功能损伤可引起尿液中氨类物质排泄减少并通过血脑屏障进入脑脊液,加重肝性脑病[27-28]。上消化道出血时由于液体丢失过量可导致机体有效循环血容量快速减少,而合并腹水者由于液体重新分布亦可导致有效循环血容量减少,故消化道出血、腹水均可引起血容量降低,进而活化肾素-血管紧张素-醛固酮系统,引起血流重分配和肾脏缺血;此外,二者均可增加感染的风险,诱发炎症反应,导致肾损伤[12]。
本研究结果显示,男性、Hb、ALB、TT为肝硬化相关AKD的保护因素。受体表面积的影响,多数女性的肾小球数量少于男性,故当发生肾血管收缩、肾缺血灌注性损伤时,女性患者早期肾小球滤过率下降更为明显,AKD发生风险随之升高,但部分研究认为男性是AKD的重要促进因素[29]。低Hb浓度诱发AKD的详细原因尚不清楚,可能是多种机制共同作用的结果[30-31]:(1)Hb不足可降低血液携氧能力,以致肾髓质缺氧,在肾损伤的发生中起重要促进作用;(2)贫血患者可能存在亚临床肾脏疾病,提升了肾小管耗氧量并加剧其氧化应激反应,从而增加肾损伤的易感性。ALB是评估机体营养状况的重要参数,肝硬化患者由于肠黏膜损伤导致营养摄入不足,而营养不良将增加感染风险,过量的内毒素和炎症因子进入体循环可使肾小管周围毛细血管壁纤维蛋白沉着[32],继而引起肾脏损伤。此外,随着肝脏功能衰竭持续性进展,ALB逐渐减少可引起循环系统胶体渗透压降低,大量液体进入细胞间隙,有效循环血容量减少,亦可激活肾素-血管紧张素-醛固酮系统和交感神经,引起肾血管收缩、肾缺血灌注性损伤。TT变化与AKD相关性的机制尚未明确,TT缩短多发生于高纤维蛋白血症或血标本pH呈酸性时,此时血液呈高凝状态或机体酸中毒,肾小球灌注及代谢异常,可能诱发AKD。
目前肝硬化患者发生AKD预测模型的相关研究较为匮乏。基于筛选的影响因素,本研究建立了肝硬化患者发生AKD的预测模型,并从区分度、校准度和临床实用性方面对模型的性能进行了评价。结果显示,模型在验证集中预测肝硬化AKD的AUC为0.895,灵敏度为88.6%,特异度为80.7%;而在验证集中AUC、灵敏度、特异度分别为0.869、78.8%、87.6%,提示模型对于AKD具有良好的区分度。校准曲线显示模型的拟合度、一致性均良好;而临床决策曲线显示,当阈值概率处于0.2%~62%范围时,通过模型预测AKD可使肝硬化患者获益,提示预测模型具有良好的临床实用性,故整体而言,本研究建立的模型对于肝硬化AKD的预测具有较高的性能和准确性,有利于肝硬化相关AKD的早期识别和诊断。
本研究局限性:(1)为单中心回顾性研究,可能存在一定程度的信息偏倚;(2)受回顾性研究固有属性的影响,纳入的观察指标受限,可能存在其他影响AKD发生风险的因素未纳入分析。
综上,作为肝硬化病情进展的常见并发症,AKD可对患者预后产生不利影响,加强AKD的预防与早期识别具有重要意义。本文采用LASSO回归和Logistic回归方法筛选的8个影响因素成功建立了肝硬化AKD的预测模型,经验证性能良好,有望应用于肝硬化AKD的早期筛查,以期做到早发现、早诊断、早治疗。
作者贡献:欧阳晶负责研究构思、资料收集及论文撰写;常虹、杨梦娇、张梦负责文献检索、研究设计;田梦负责资料整理;郑亚、王玉平负责数据分析;陈兆峰负责论文写作指导及修订。
利益冲突:所有作者均声明不存在利益冲突

