基于碳点变色性能的紫外-可见分光光度法测定脱硫液和废水中硫离子的含量
文 蓉,李乔惠,罗亚雄,赵 霞,李永生*,高秀峰
(1.四川大学 化学工程学院,成都 610065;2.南京农业大学 工学院,南京 210095;3.四川大学 华西基础医学与法医学院,成都 610064;4.中石油西南油气田分公司,重庆 401259)
硫离子(S2-)是污染环境的有害物质。含硫天然气会导致输气管管道腐蚀,其燃烧会形成酸雨,因此S2-含量是衡量天然气质量的指标之一,也是水质的重要监测项目[1-2]。天然气厂需要对天然气进行脱硫净化处理后才能将其投入市场使用,而脱硫过程会产生含S2-的脱硫液。因此,建立一种简单、灵敏测定脱硫液和废水中S2-含量的方法具有重要的环保意义。
关于含硫样品的前处理,一般需要经过加酸-鼓气处理[3],天然气脱硫液还需高温加热使H2S分离,这些处理过程耗时较长、重现性差。目前,水中S2-的测定方法主要有碘量法[4-5]、亚甲基蓝分光光度法[6-7]、电化学法[8-9]、化学发光法[10-11]、色谱-质谱法[12]、荧光光谱法[13-14]等。其中,碘量法操作繁琐,测定范围较窄;亚甲基蓝分光光度法是目前测定S2-含量的标准方法之一,其检测原理是S2-与N,N-二甲基-对苯二胺(DMPD)在含氧化剂(通常是Fe3+)的酸性溶液中生成亚甲基蓝染料,采用紫外-可见分光光度计于665 nm进行检测,其吸光度与S2-含量成正比,但该方法使用的试剂种类多、配制繁琐;电化学法易受电磁干扰,选择性较低;色谱-质谱法设备较为昂贵;化学发光法及荧光光谱法使用的试剂有毒且成本较高。
由于碳点(CDs)具有原料便宜、来源广泛、合成简单、毒性低、水溶性好等优点,利用CDs开发新的分析方法备受关注。文献[15]采用电解法合成了棕色CDs,并将其用于测定水中Hg2+的含量;文献[16]采用基于CDs的荧光猝灭法测定了尿液中阿霉素的含量。然而这些研究没有用此类CDs进行光度分析。鉴于此,本工作在前期研究的基础上[17],设计了一种H2S分离系统;然后以尿素为氮源,柠檬酸(CA)为碳源,采用水热法合成CDs,考察其变色性能,并将其用于脱硫液和废水中S2-含量的测定。
1 试验部分
1.1 仪器与试剂
UV-1800型紫外-可见分光光度计;RF-5301PC型荧光光度仪;Tecnai GZ F20型透射电子显微镜;DZF-6020型电热恒温鼓风干燥箱;KL-UP-IV-10型超纯水器;AUW型电子天平;K30经济型干式恒温器。
S2-标准溶液:取一定量Na2S·9H2O于布氏漏斗小烧杯中,用水淋洗,去除表面杂质,再用滤纸吸去水分;分取0.075 0 g Na2S·9H2O于25 mL烧杯中,用水溶解,然后转移至100 mL棕色容量瓶中,再用水定容,摇匀;以硫代硫酸钠标定其质量浓度后,再用水将其稀释至所需质量浓度。
100 mg·L-1CDs溶液:取0.010 0 g 干燥后的CDs粉末,用水溶解后转移至100 mL容量瓶中,再用水定容,摇匀。
CA、尿素、硼氢化钠、无水亚硫酸钠、碘化钾、溴化钾、抗坏血酸、FeSO4·7H2O、Na2S·9H2O、30%(质量分数)H2O2溶液等均为分析纯;试验用水为纯水。
1.2 试验方法
1.2.1 CDs的制备
分别取7.5 mL 2 mol·L-1CA溶液和7.5 mL 4 mol·L-1尿素溶液置于25 mL水热反应釜中,混匀,于160 ℃的真空干燥箱中加热3 h,待反应釜自然冷却至室温后,得到黄色CDs原液;然后加入1 mL 3 mol·L-1H2O2溶液,使CDs原液快速氧化为蓝色;将该蓝色CDs原液置于60 ℃恒温烘箱中干燥24 h,得到CDs粉末,置于干燥器中保存备用[18]。
1.2.2 样品预处理
循环预处理系统见图1,图中吸收管长度为50 cm,解吸温度为50 ℃,吸收液为0.5 mol·L-1NaOH溶液,流量为1 mL·min-1,HCl溶液浓度为5 mol·L-1。将2 mL脱硫液或废水样品和2 mL 5 mol·L-1HCl溶液注入解吸瓶,样品中的S2-酸化形成H2S,在蠕动泵的作用下,H2S通过透气管被流动的吸收液循环吸收20 min,得到待测样品溶液。

图1 循环预处理系统Fig.1 The cyclic pretreatment system
1.2.3 S2-的测定
分取0.5 mL待测样品溶液,与4.5 mL 100 mg·L-1CDs溶液混合,用1 mol·L-1NaOH溶液调节体系酸度至pH 8,于30 ℃反应15 min,反应结束后用冷水将反应液快速冷却至室温,利用紫外-可见分光光度计测定体系在610 nm处的吸光度A。同时,测定100 mg·L-1CDs溶液在610 nm处的吸光度A0,计算吸光度差值ΔA(A0-A)。
2 结果与讨论
2.1 CDs的紫外-可见吸收光谱图和荧光光谱图
用水将1.2.1节得到的黄色CDs原液稀释10倍,利用紫外-可见分光光度计,在波长400~800 nm内对其进行扫描,并考察存放时间(0,0.5,1.0,1.5,2.0 h)对体系吸光度的影响,结果见图2(a)和(b)。

图2 紫外-可见吸收光谱图、荧光光谱图和透射电镜图Fig.2 UV-Vis absorption spectra, fluorescence spectra and transmission electron microscopy image
由图2(a)和(b)可知:CDs在230,345 nm处有紫外吸收峰,分别对应π→π*跃迁(C=C)、n→π*跃迁(C=N、C=O),并且在610 nm可见光区出现显色基团的特征吸收峰;随着存放时间的延长,230,345 nm处体系的吸光度变化较小,但610 nm处体系的吸光度逐渐增大,并且CDs原液由黄色逐渐变为蓝绿色,表明CDs可能是一种混合物或其表面含有两种类型的基团,一种是稳定基团,另一种是还原性基团,在常压空气中能被氧化,发生变色。
为了确认该物质,分别对稀释10倍和稀释100倍的黄色CDs原液进行荧光扫描,结果见图2(c)和(d)。
结果表明:稀释10倍的CDs溶液具有激发依赖性,其发射波长随激发波长的增大而增大;而稀释100倍的CDs溶液不具有激发依赖性,在300~420 nm激发波长下CDs产生稳定的蓝光,并且仅在230,336 nm处有特征吸收峰,610 nm处的特征吸收峰消失[图2(e)],表明稀释100倍的CDs表面610 nm处的显色基团消失。
基于上述结论,本工作认为该CDs主要表现为量子限域效应[19]:稀释10倍的CDs溶液中含多种粒径的CDs[图2(f)左边照片],小粒径会附聚成较大颗粒,导致荧光发射波长红移,发射不同荧光,从而表现出激发依赖性;当稀释100倍时,大粒径CDs被溶剂分散成小颗粒[图2(f)右边照片],导致荧光发射波长不再变化,说明CDs在溶剂作用下解聚,达到它的最小极限粒径, 接近CDs的碳核粒径, 碳核sp2发射蓝色荧光的区域占主导地位。
2.2 氧气及不同还原性物质对CDs变色的影响
为了验证CDs变色是氧化导致的,于两个试管中各加入4 mL稀释10倍的CDs溶液,将其分别置于空气和真空环境中,每隔0.5 h检测一次,考察了氧气对体系在610 nm处吸光度的影响,结果见图3(a)。

图3 氧气和还原性物质对体系吸光度的影响Fig.3 Effects of oxygen and reducing substance on the absorbance of system
结果表明:与空气接触的CDs溶液颜色很快变绿,并且吸光度逐渐增大,长期观察发现,在空气中放置48 h后其颜色变为蓝色;而真空环境中的CDs溶液颜色和吸光度基本保持不变。向该溶液(真空)中加入0.1 mL 8 mol·L-1H2O2溶液,30 min后CDs溶液变为蓝色,表明CDs变色是氧化导致的。

2.3 反应条件的优化
取1 mmol·L-1S2-标准溶液0.5 mL和100 mg·L-1CDs溶液4.5 mL,混匀,用1 mol·L-1HCl溶液或1 mol·L-1NaOH溶液调节体系酸度,考察了酸度对反应前后体系吸光度差值ΔA的影响,结果见图4(a)。

图4 反应条件对体系吸光度的影响Fig.4 Effect of reaction conditions on the absorbance of system
由图4(a)可知,当体系酸度为pH 7和pH 8时,ΔA值较大,说明此时CDs褪色明显。由于体系酸度为pH 7时S2-与CDs反应容易受到空气中CO2的影响,试验选择的体系酸度为pH 8。
结果表明,仅S2-能使CDs褪色,其他还原性物质的加入对体系吸光度基本无影响。因此,确定在pH 8条件下该CDs可用于S2-的测定。
接着,试验考察了反应时间和反应温度对体系吸光度的影响,结果见图4(c)。
由图4(c)可知:当反应温度为12 ℃时,CDs与S2-反应大约45 min才可达到平衡:当反应温度为30 ℃时,仅需15 min体系吸光度便可明显降低。因此,试验选择的反应温度为30 ℃,反应时间为15 min。
2.4 标准曲线和检出限
按照1.2.2节试验方法对质量浓度为0.05,0.10,0.20,0.50,1.00,2.00,5.00,10.00,15.00 mg·L-1的S2-标准溶液系列进行预处理,将其分别与100 mg·L-1CDs溶液反应,测定体系吸光度差值ΔA。以S2-的质量浓度为横坐标,其对应的ΔA值为纵坐标绘制标准曲线。结果显示,S2-的质量浓度分别在0.05~1.00 mg·L-1和1.00~15.00 mg·L-1内与对应的ΔA值呈线性关系,线性回归方程分别为y=5.742×10-2x+1.530×10-3和y=3.282×10-2x+2.641×10-2,相关系数均为0.999 6。
以3倍信噪比(S/N)计算检出限(3S/N),结果分别为0.043 mg·L-1和0.073 mg·L-1。
2.5 精密度和回收试验
按照试验方法对2个脱硫液样品和1个废水样品进行3个浓度水平的加标回收试验,计算回收率和测定值的相对标准偏差(RSD),结果见表1。
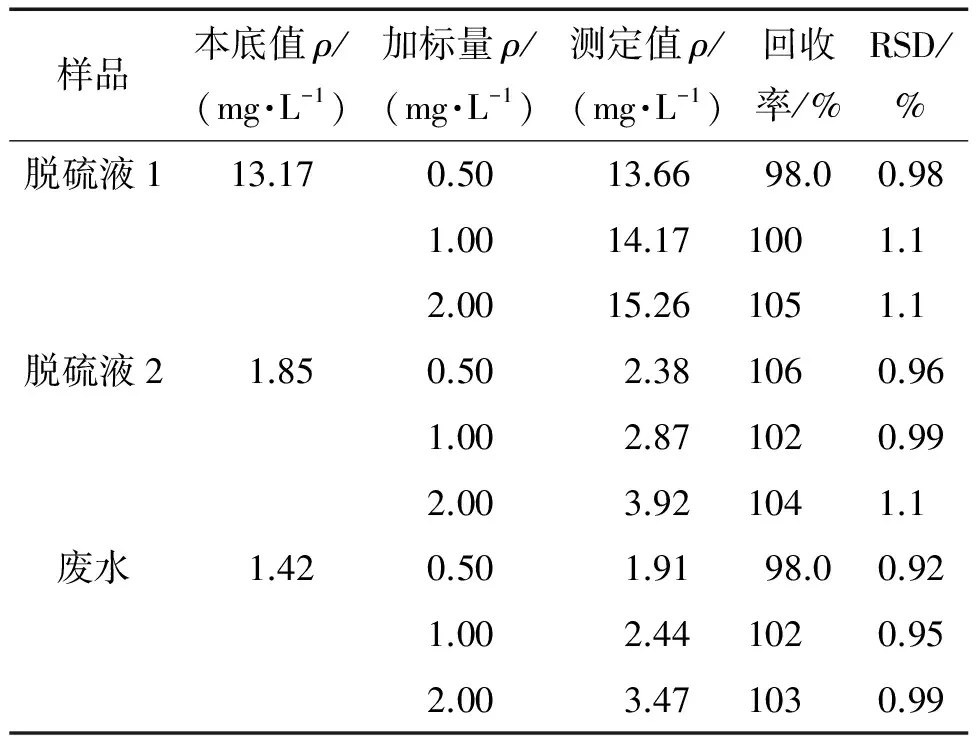
表1 精密度和回收试验结果(n=6)
由表1可知,样品中S2-的回收率为98.0%~106%,测定值的RSD为0.92%~1.1%,符合分析的要求。
2.6 样品分析
按照试验方法和国家标准GB/T 16489-1996《水质 硫化物的测定 亚甲基蓝分光光度法》对6个脱硫液样品(来自中石油西南油气田分公司天然气脱硫净化过程)和6个废水样品进行测定(高浓度水平样品将其稀释至线性范围内),结果见表2。

表2 样品分析结果
结果显示:脱硫液样品中S2-含量较高,说明脱硫净化可去除大量的含硫物质,但净化过程产生的废水中也含有一定的S2-,因此天然气厂必须对废水进行处理达到标准后才可排放。接着,采用t检验法分析本法与GB/T 16489-1996是否具有显著性差异。对于脱硫液样品,t值为0.984,P值为0.585;对于废水样品,t值为0.941,P值为0.572,表明两种方法所得结果无显著性差异。
本工作以CA为碳源,以尿素为氮源,采用水热法合成了具有氧化变色性能的CDs; 将脱硫液和废水中的S2-经循环预处理系统分离出来,基于该CDs与S2-的褪色反应,采用紫外-可见分光光度法测定其中S2-的含量;在最佳反应条件下,该方法测定S2-的检出限较低,并且准确度较高。

