葛根蛋白酶解物大孔树脂吸附工艺优化及其体外抗氧化活性研究
岳奕含 严铭铭 邵 帅 丁奕元 江 婷
(长春中医药大学,吉林 长春 130117)
葛根为豆科植物野葛Puerarialobata(Willd.) Ohwi的干燥根,习称野葛,始载于《神农百草经》,具有生津止渴、升阳止泻等功效[1]。葛根作为药食同源药品,在改善心血管功能[2]、解酒保肝[3]、抗氧化、保护神经、预防骨质疏松[4]等方面具有良好的疗效。有研究[5]表明,将植物蛋白酶解生成多种活性肽,能够提高其生物活性及蛋白质功能,且具有良好的抗氧化潜力。庞会娜等[6]将葛根蛋白酶解,酶解后蛋白分子量降低,且体外抗氧化活性较酶解前显著提高。但由于蛋白质酶解产物多样(其中包括游离氨基酸、部分未水解蛋白质以及多肽),选择合适的纯化方法能够进一步评估蛋白酶解物结构及提高其生物活性[7-8]。目前,蛋白多肽纯化方法主要包括超滤、凝胶色谱、大孔树脂纯化、离子交换色谱、反向高效液相色谱、电渗析等[9-11]。目前对葛根蛋白多肽的研究多限于提取工艺的优化,对其纯化工艺的研究尚未见报道。研究拟通过大孔树脂吸附脱去葛根蛋白酶解物中无机盐等杂质,提高葛根蛋白酶解物的纯度及抗氧化活性,为葛根蛋白多肽添加于食品中的开发与利用提供依据。
1 材料与方法
1.1 材料与试剂
葛根蛋白:含量9.35%,课题组前期研究产物;
碱性蛋白酶:200 U/mg,上海源叶生物科技有限公司;
无水乙醇:分析纯,无锡市晶科化工有限公司;
1,1-二苯基-2-三硝基苯肼(DPPH):分析纯,上海麦克林生化科技股份有限公司;
FeCl3、HCl、NaH2PO4、Na2HPO4、K3[Fe(CN)6]、NaOH、FeSO4·7H2O:分析纯,西陇科学股份有限公司;
牛血清蛋白、PBS(pH 7.4):北京索莱宝科技有限公司;
三氯乙酸(TCA):天津化学试剂有限公司;
大孔树脂(AB-8、D101、HPD-450、LX-8):厦门柏嘉生物科技有限公司。
1.2 仪器与设备
紫外分光光度计:UV-1700型,日本岛津(中国)有限公司;
集热式恒温加热磁力搅拌器:DF-101S型,上海豫康科教仪器设备有限公司;
赛多利斯台式数显酸度计:PB-10型,上海诺萱科学仪器有限公司;
低温离心机:5804R型,美国贝克曼库尔特有限公司;
冷冻干燥机:DRC-2L型,北崎国际贸易有限公司;
恒温水浴锅:HH-6数显型,金坛市佳美仪器有限公司。
1.3 试验方法
1.3.1 葛根蛋白酶解物制备 取适量葛根蛋白与蒸馏水配制成质量浓度为2%的底物溶液,加入酶底比为2%的碱性蛋白酶,在55 ℃、pH为9的条件下酶解3 h,酶解结束后,立即于100 ℃水浴灭酶10 min,冷却至室温,将pH值调至中性,4 ℃、8 000 r/min离心15 min[6]。
1.3.2 葛根蛋白多肽含量测定 采用福林酚法[12],其标准曲线为y=0.000 6x+0.001 3(R2=0.999 9)。
1.3.3 大孔树脂筛选 选用4种不同极性的大孔树脂进行吸附—解吸试验。取预处理好的大孔吸附树脂各1.0 g,分别加入到150 mL锥形瓶中,加入质量浓度为3.0 mg/mL的葛根蛋白酶解物溶液50 mL,25 ℃下,160 r/min震摇12 h,抽滤,取滤液,按式(1)计算葛根蛋白酶解物质量浓度与吸附率。取上述饱和的大孔树脂用蒸馏水洗至流出液澄清透明,加入50 mL 95%乙醇,相同条件振摇12 h,测定吸光度并按式(2)计算解吸率[13-14]。
(1)
(2)
式中:
R1——吸附率,%;
R2——解吸率,%;
C0——吸附液中葛根蛋白酶解物质量浓度,mg/mL;
C1——吸附后溶液葛根蛋白酶解物质量浓度,mg/mL;
C2——解吸液中酶解物质量浓度,mg/mL。
1.3.4 单因素试验 称取预处理后的大孔树脂,湿法装柱,装柱约为柱体积的3/4。固定葛根酶解物质量浓度为10 mg/mL、上样液流速为2 mL/min、上样液体积为40 mL,吸附时间为3 h,上柱、收集、测定,考察上样液质量浓度(5,10,15,20,25 mg/mL)、上样液流速(0.5,1.0,1.5,2.0,2.5,3.0 mL/min)对吸附率的影响。固定洗脱液乙醇体积分数为70%,上样液流速为2.5 mL/min,洗脱液体积为160 mL,考察洗脱液乙醇体积分数(0%,30%,50%,70%,90%)、洗脱液流速(1.5,2.0,2.5,3.0,3.5 mL/min)、洗脱液体积(40,80,120,160,200,240 mL)对解吸率的影响。
1.3.5 响应面试验优化 在单因素试验基础上,以上样液质量浓度、洗脱液流速以及洗脱液乙醇体积分数作为自变量,葛根蛋白酶解物解吸率作为响应值,使用Design-Expert 8.0.6.1软件进行Box-Behnken三因素三水平试验设计,优化葛根蛋白酶解物大孔树脂吸附工艺。
1.3.6 葛根蛋白酶解物的体外抗氧化活性
(1) DPPH自由基清除能力测定:根据文献[15]并修改。取2 mL质量分数为0.004%的DPPH溶液,加入2 mL不同梯度浓度的葛根蛋白酶解物溶液,涡旋混匀,避光反应30 min,测定517 nm处吸光度。以甲醇为样品对照组,蒸馏水为空白对照组,维生素C为阳性对照,按式(3)计算DPPH自由基清除率。
(3)
式中:
S1——DPPH自由基清除率,%;
A0——空白对照组吸光度值;
A1——样品对照组吸光度值;
A2——样品吸光度值。
(2) 羟自由基清除能力测定:根据文献[16]并修改。将 2 mL浓度为0.2 mol/L的PBS缓冲溶液(pH 7.4)加入到1 mL浓度为0.75 mmol/L邻二氮菲溶液中,再加入1 mL不同梯度浓度的葛根酶解物溶液,涡旋混匀,加入1 mL 0.75 mmol/L硫酸亚铁溶液以及0.75 mmol/L硫酸亚铁溶液,混匀后反应0.5 h (37 ℃),测定536 nm处吸光度。将样品液替换为蒸馏水,测定空白对照组吸光度。将过氧化氢溶液替换为蒸馏水,测定样品对照组吸光度。以维生素C作为阳性对照,按式(4)计算ABTS自由基清除率。
(4)
式中:
S2——羟自由基清除率,%;
A0——空白对照组吸光度值;
A1——样品吸光度值;
A2——样品对照组吸光度值。
(3) ABTS+自由基清除能力测定:根据文献[17]并修改。取0.2 mL ABTS+工作液,用pH 7.4 PBS缓冲溶液稀释至734 nm处吸光度值为0.7±0.2,取稀释后的ABTS+溶液0.2 mL,加入10 μL不同梯度浓度的葛根酶解物溶液,混匀,常温暗室反应6 min,测定734 nm处吸光度。以PBS溶液为样品对照组,维生素C作为阳性对照,按式(5)计算ABTS+自由基清除率。
(5)
式中:
S3——ABTS+自由清除率,%;
A0——样品对照组吸光度值;
A1——样品吸光度值。
(4) 还原能力:根据文献[18]并修改。分别取不同梯度浓度的葛根蛋白酶解物溶液2.5 mL,加入0.2 mol/L磷酸盐缓冲溶液2.5 mL,再加入1% K3Fe(CN)6溶液2.5 mL,反应20 min (50 ℃)后冷却至室温,加入10%三氯乙酸2.5 mL,离心,取上清液1 mL,加入1 mL蒸馏水以及5 mL 0.1%的FeCl3溶液,涡旋混匀,静置后测定700 nm处吸光度值。将1% K3Fe(CN)6溶液替换为蒸馏水,测定吸光度值。蒸馏水作为空白组调零,维生素C作为阳性对照,按式(6)计算还原力。
A=A1-A2,
(6)
式中:
A——还原能力;
A1——样品吸光度值;
A2——样品对照组吸光度值。
1.3.7 数据统计与分析 每组试验均重复3次,利用SPSS 21.0软件进行统计学分析,Origin2019软件绘制图表,Design-Expert 8.0.6.1软件进行响应面试验设计及数据分析。
2 结果与分析
2.1 大孔树脂型号筛选
由表1可知,不同型号大孔树脂对于葛根蛋白酶解物的静态吸附—解吸率不同,综合吸附率、解吸率来看,AB-8大孔树脂的效果最好,可能是由于AB-8型大孔树脂极性较弱,具有网状结构及高比表面积,适合蛋白多肽的吸附纯化[19]。故后续试验选用AB-8型大孔树脂。

表1 各型号大孔树脂的静态吸附性能
2.2 单因素试验
2.2.1 上样液质量浓度 由图1可知,大孔树脂的吸附率随葛根蛋白酶解物质量浓度的增大呈先增大后减小的趋势,当上样液质量浓度为10.0 mg/mL时,吸附率达到最大值87.54%。继续增大葛根蛋白酶解物质量浓度,吸附率逐渐降低,可能是葛根蛋白酶解物质量浓度较低时,大孔树脂不能完全吸附,而质量浓度过高,则会超出大孔树脂的吸附量,并且葛根蛋白酶解液中的杂质成分也会竞争吸附位点,大孔树脂不能将其完全吸附[20]。因此,最佳上样质量浓度确定为10 mg/mL。

图1 上样液质量浓度对大孔树脂吸附性能的影响
2.2.2 上样液流速 由图2可知,随着葛根蛋白酶解物上样液速度的加快,大孔树脂对葛根蛋白酶解物的吸附率呈先上升后下降的趋势,当上样液流速为2.0 mL/min时,吸附率达到最大值。当上样液流速>2.0 mL/min时,吸附率反而降低,可能是葛根蛋白酶解液在大孔树脂中需要一个吸附与扩散的过程,流速过大,酶解液还未充分吸附就被泄露,导致葛根蛋白酶解液浪费。因此,最佳上样液流速为2 mL/min。

图2 上样液流速对大孔树脂吸附性能的影响
2.2.3 洗脱液乙醇体积分数 由图3可知,随着洗脱液乙醇体积分数逐渐增大,大孔树脂对葛根蛋白酶解物的解吸率呈先增大后减小趋势,当洗脱液乙醇体积分数为70%时,解吸率达到最大值82.55%,当洗脱液乙醇体积分数>70%时,解吸率则下降。这可能是乙醇体积分数会导致洗脱液的极性发生改变,进而影响了洗脱液对葛根蛋白酶解物的洗脱能力[21]。因此,选择50%,70%,90% 3个水平进行后续研究。
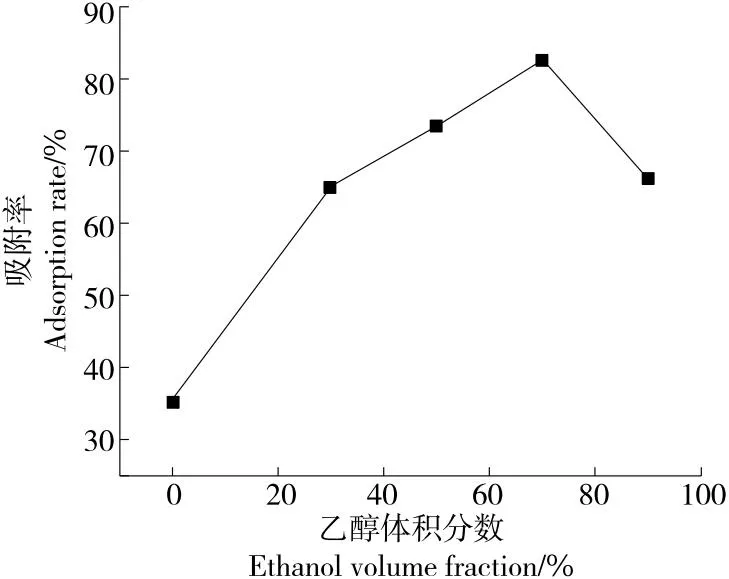
图3 乙醇体积分数对大孔树脂解吸性能的影响
2.2.4 洗脱液流速 由图4可知,随着洗脱液流速的增加,大孔树脂对葛根蛋白酶解物的吸附率呈先上升后下降的趋势,当洗脱液流速为2.5 mL/min时,解吸率达到最大值89.75%。当洗脱液流速>2.5 mL/min时,解吸率开始下降,可能是洗脱流速过快,洗脱液不能与大孔树脂很好接触,葛根蛋白酶解物不能被有效洗脱[22]。

图4 洗脱液流速对大孔树脂解吸性能的影响
2.2.5 洗脱液体积 由图5可知,随着洗脱液体积的上升,大孔树脂对葛根蛋白酶解物的解吸率呈先上升后趋于平缓的趋势,当洗脱液体积为160 mL时,解吸率达到最大值84.50%。继续增大洗脱液体积,解吸率几乎不再变化,说明此时流出液中酶解物含量已经很少,大部分葛根蛋白酶解物已被洗脱下来,可能剩余部分葛根蛋白酶解物出现死吸附的情况,不能被继续洗脱。
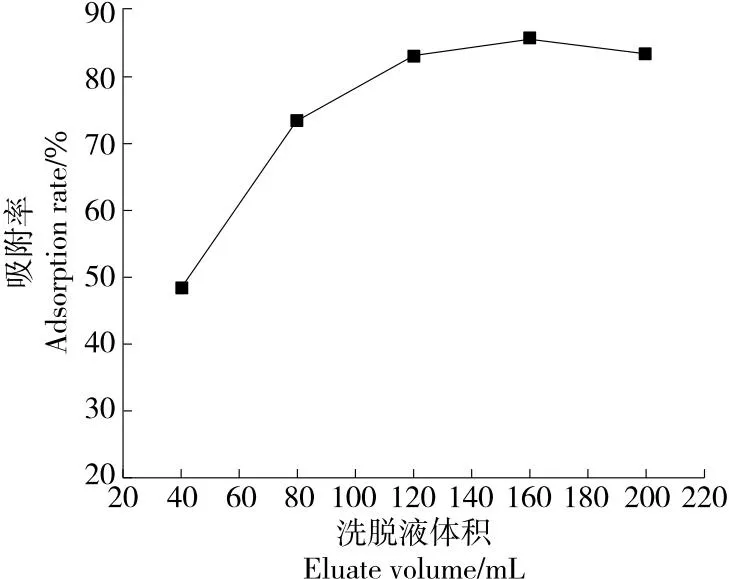
图5 洗脱液体积对大孔树脂解吸性能的影响
2.3 响应面试验优化
2.3.1 试验模型建立与方差分析 根据单因素试验结果,以上样液质量浓度、洗脱液流速和洗脱液乙醇体积分数为自变量,以解吸率为响应值,进行三因素三水平响应面分析。试验因素水平见表2,试验设计及结果见表3。利用Design-Expert软件进行线性方程拟合,拟合回归方程为:
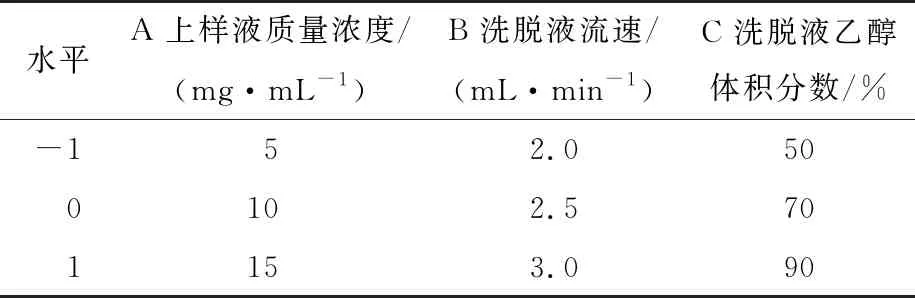
表2 响应面试验因素水平
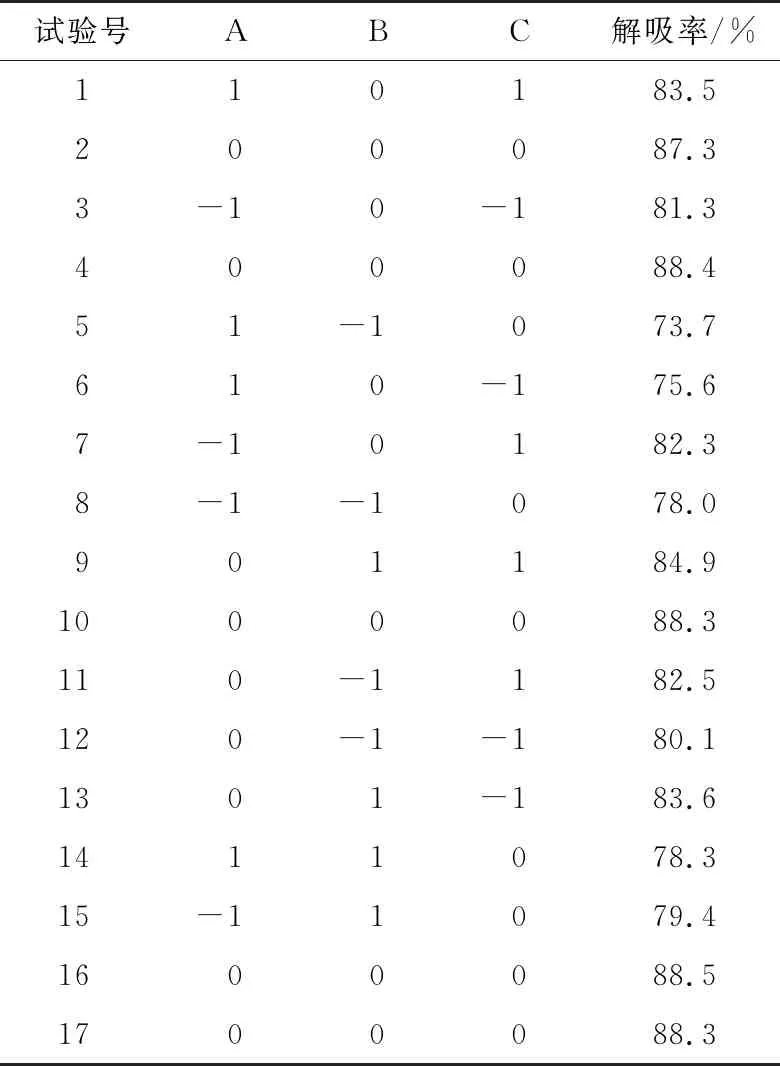
表3 响应面设计方案与结果
Y=88.02-1.24A+1.49B+1.58C+0.80AB+1.73AC-0.27BC-6.39A2-4.28B2-0.96C2。
(7)
由表4可知,模型P<0.01,极显著;失拟项P=0.105 3,不显著;R2为0.986 4,说明误差对实际结果影响较小,模型可靠,可以对葛根蛋白酶解物解吸率有准确的分析和预测。在该模型中,一次项A、B、C,二次项A2、B2,交互项AC对葛根蛋白酶解物解吸率影响极显著(P<0.01),二次项C2对葛根蛋白酶解物解吸率影响显著(P<0.05)。根据F值可以判断出各水平对试验结果影响排序为C(洗脱液乙醇体积分数)>B(洗脱液流速)>A(上样液质量浓度)。
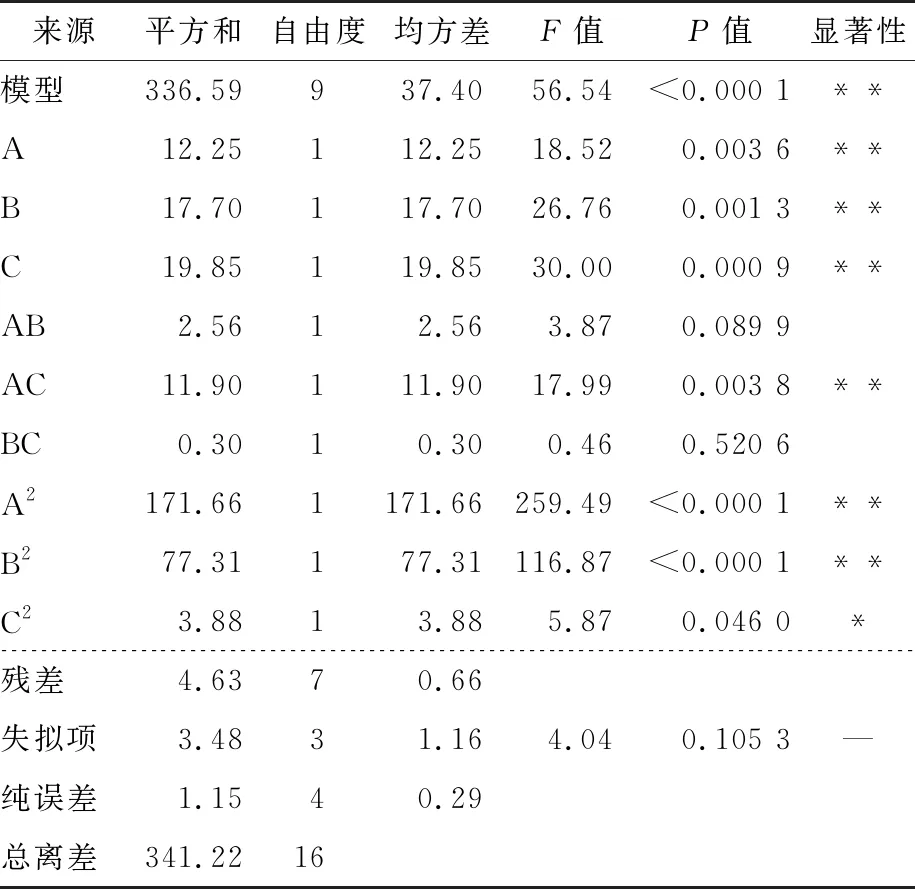
表4 回归方程方差分析结果†
2.3.2 响应面结果分析 由图6可知,随着上样液质量浓度与洗脱液乙醇体积分数的增加,解吸率呈先上升后下降的趋势,其曲面坡度较陡峭,等高线呈椭圆形,说明上样液质量浓度与洗脱液乙醇体积分数的交互作用对葛根酶解物的解吸率影响显著,与模型方差结果一致。上样液质量浓度与洗脱液流速交互作用的曲面坡度陡峭,但其等高线呈圆形,说明二者交互作用对结果影响不显著,与模型方差结果一致。洗脱液流速与洗脱液乙醇体积分数交互作用等高线呈椭圆形,但曲面坡度平缓,说明二者交互作用对结果影响不显著,与模型方差结果一致。
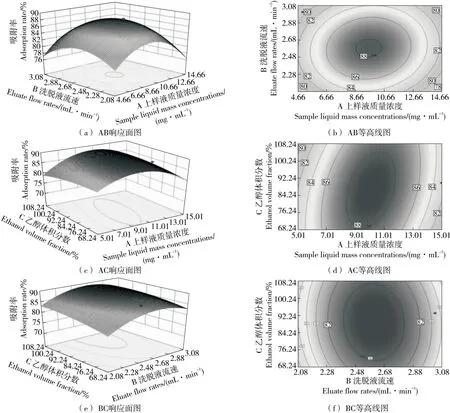
图6 响应面与等高线分析图
2.3.3 最佳吸附工艺结果分析与验证 通过对拟合模型进行分析,响应面优化大孔树脂吸附葛根酶解物的最佳工艺为上样液质量浓度9.33 mg/mL,洗脱液流速2.61 mL/min,洗脱液乙醇体积分数74.44%,此工艺条件下预测葛根蛋白酶解物解吸率为88.54%。考虑到后续验证实验的可操作性,将最佳工艺调整为上样液质量浓度10 mg/mL,洗脱液流速2.6 mL/min,洗脱液乙醇体积分数74%。此时葛根蛋白酶解物的解吸率为(86.78±1.27)%,与预测值基本相同,且最佳工艺下葛根蛋白酶解物含量由10.81%增加至37.19%,证明此工艺优化可行且效果较好。
2.4 葛根酶解物的体外抗氧化活性
2.4.1 DPPH自由基清除能力 由图7可知,当样品质量浓度为0.1~3.2 mg/mL时,样品对DPPH自由基清除能力随质量浓度的增大而增强,当样品质量浓度为0.8 mg/mL时,DPPH自由基清除率达(89.34±1.26)%,且趋于平稳。维生素C、葛根蛋白酶解物吸附前后的IC50值分别为0.002,0.083,0.063 mg/mL,IC50值越小,证明其清除能力越强,抗氧化效果越好[23],三者自由基清除能力由强到弱为维生素C>纯化后>纯化前。因此,经大孔树脂纯化后,葛根蛋白多肽含量上升导致其体外抗氧化活性增强。

图7 纯化前后葛根蛋白酶解物对DPPH自由基清除能力的影响
2.4.2 羟自由基清除能力 由图8可知,当样品质量浓度为0.1~3.2 mg/mL时,纯化前后的样品对羟自由基的清除率均低于维生素C的,但经大孔树脂纯化后的葛根酶解物对羟自由基的清除率从(78.72±2.29)%增加到(85.74±2.24)%。维生素C、纯化前后的IC50值分别为0.126,0.423,0.304 mg/mL,三者对羟自由基清除率能力排序为维生素C>纯化后>纯化前。因此,葛根酶解物经大孔树脂纯化后,其抗氧化活性增强,与吕凯波等[24]的研究结论一致。
2.4.3 ABTS+自由基清除能力 由图9可知,葛根酶解物纯化前后对ABTS+自由基清除能力随样品质量浓度的增加而增强,且纯化后对ABTS+的清除率最高可达(93.14±2.38)%。维生素C、纯化前后的IC50值分别为0.141,0.642,0.408 mg/mL,三者对ABTS自由基清除能力大小排序为维生素C>纯化后>纯化前,其抗氧化能力结果与马萌等[25]的一致。
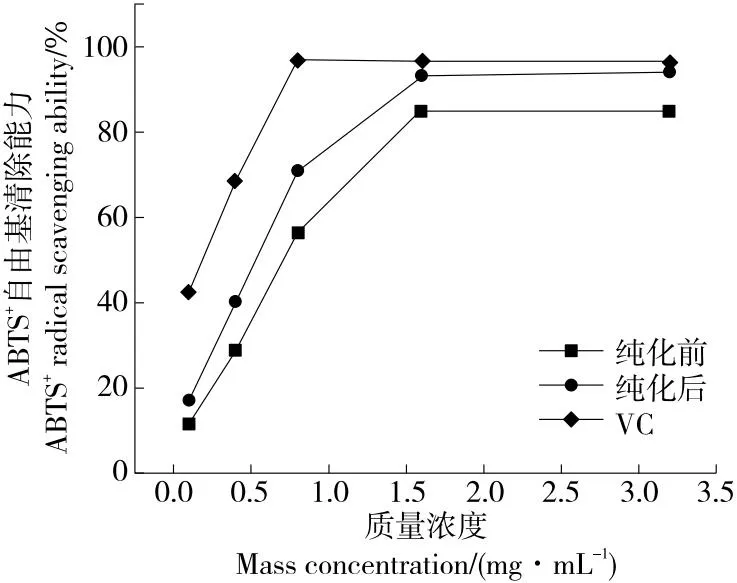
图9 纯化前后葛根蛋白酶解物对ABTS+自由基清除能力的影响
2.4.4 还原能力 由图10可知,当样品质量浓度为0.1~3.2 mg/mL时,大孔树脂纯化前后的葛根酶解物呈现出不同的还原能力,随着质量浓度的增加,还原能力增加。当葛根蛋白酶解物质量浓度增加至1.5 mg/mL时,其还原能力基本与维生素C的持平,纯化后的葛根蛋白酶解物具有更强的还原能力。
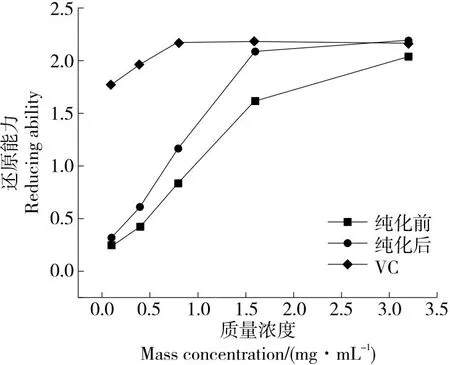
图10 纯化前后葛根蛋白酶解物对还原能力影响
3 结论
试验表明,AB-8型大孔树脂为吸附葛根蛋白酶解物的最佳材料,大孔树脂吸附葛根蛋白酶解物的最佳工艺条件为上样液质量浓度10.0 mg/mL,洗脱液流速2.6 mL/min,洗脱液乙醇体积分数74%。该条件下葛根蛋白酶解物含量以及抗氧化活性较吸附前明显提高,说明优化工艺可行。但将其作为一种有效的食源性抗氧化肽来源应用于保健食品中,需进行动物以及临床试验,以探究葛根蛋白酶解物的抗氧化活性机制。

