高糖高脂促进人脐静脉内皮细胞间充质转化*
宁宇阳,尧 青,徐 魁,刘 超**
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖北科技学院附属第二医院内二科)
内皮细胞间充质转化(endothelial-mesenchymal transition,End-MT)是一个复杂的细胞分化过程,在一定的生理和病理条件下,内皮细胞向间充质细胞转化,降低内皮特性,获得间充质特征[1]。内皮细胞覆盖于所有的血管腔表面,是一个重要的功能性界面。在各种内外因素如高血压,吸烟的刺激下,内皮细胞发生间充质转化,导致内皮细胞迁移能力增强,使内皮细胞更容易脱离原来的位置,影响血管内膜层完整性[2];此外,内皮细胞维护血管收缩舒张平衡的功能在此情况下明显受损。因此,可以说End-MT损伤了内皮细胞的物理及生化等多方面功能。
目前,End-MT的发生发展常用体外细胞培养系统进行研究。通常,原代内皮细胞(ECs)或ECs系通过化学或物理刺激诱导发生End-MT。有研究表明,转化生长因子-β(transforming growth factor-β,TGF-β)与IL-1β、IL-6、TNF-α等炎症因子可引起End-MT,参与内皮功能障碍[3-4]。在其中应用最广泛的是TGF-β1刺激5~8d[5],从而引发End-MT。随着研究的不断深入,End-MT在动脉粥样硬化,心脏和肾脏纤维化、肺动脉高压、癌症等多疾病中的作用被逐渐重视[6-7]。
慢性高糖(high glucose,HG)是糖尿病血管并发症的主要诱因,糖尿病患者因胰岛素抵抗可致能量利用与消耗的失衡,造成糖脂代谢紊乱,使得内皮细胞间充质从而转化成为平滑肌细胞,导致血管内膜增厚,管腔狭窄,引发血管病变[8]。目前高糖高脂是否对End-MT有刺激效果,以及是否参与内皮功能障碍尚不确定。本文拟探究高糖高脂刺激对内皮细胞(HUVEC)的End-MT作用,为未来间充质转化实验提供新思路。
1 材料与方法
1.1 材料
仪器:倒置荧光显微镜(日本Olympus公司);全自动酶标仪(美国Bio-Tek公司);化学凝胶成像系统(英国Syngene公司);二氧化碳培养箱(美国Eppendorf公司);高速冷冻离心机(德国Eppendorf公司);Milli-Q Synthesis超纯水系统(美国Millipore公司)。
试剂:游离脂肪酸游离牛血清白蛋白(BSA,批号SRE0098)、棕榈酸(PA,批号P0500)为Sigma公司产品;内皮细胞培养基ECM(Cat No.1001)为Sciencell公司产品;胎牛血清(FBS)和胰酶为Gbico公司产品;BCA蛋白定量试剂盒(批号P0012S)、RIPA细胞裂解物(批号P0023A)均为碧云天公司产品;一抗稀释液(武汉塞维尔生物);一抗,兔抗VE-Cadherin (批号A22659);兔抗α-Smooth Muscle Actin(ACTA2)(批号A7248);兔抗Platelet endothelial cell adhesion molecule-1(PECAM-1/CD31)(批号A0378);兔抗N-Cadherin(批号A19083)等为ABclonal公司产品;β-actin(批号58169)为CST公司产品。
细胞:人脐静脉内皮细胞(HUVEC细胞,武汉华联科生物公司)
1.2 方法
1.2.1 细胞培养及分组
人脐静脉内皮细胞(HUVEC细胞,武汉华联科生物公司),37℃ 5.0%CO2培养箱培养,当细胞密度铺满约90%培养皿底时,采用0.25%胰酶消化后进行传代。从第6代HUVEC细胞开始进行刺激,先将培养细胞所用的ECM培养基换为无血清培养基,然后随机分组。分别采用20ng/mL的TGF-β1或者33mmol/L高糖加0.15mmol/L棕榈酸,来对人脐静脉内皮细胞(HUVEC)进行转化刺激。根据处理条件的不同,第6代HUVEC将细胞分为CON组、HG+HP组(33mmol/L高糖加0.15mmol/L处理)、TGF-β1组(20ng/mL处理)。
1.2.2 Western blot法
对HG+HP组和CON组的HUVEC细胞加入细胞裂解液,冰上裂解10~15min然后刮下细胞离心提取蛋白,使用BCA蛋白质测定试剂盒测量各组细胞的蛋白质浓度。校正浓度后,每组以校正后体积进行8%SDS-PAGE凝胶电泳,后将蛋白以350mA、90min湿转至PVDF膜上,脱脂牛奶封闭后,在4℃孵育所需的一抗(1∶1000)12~16h,然后用TBST洗膜,加入相对应的二抗(1∶5000),以ECL化学发光底物显色后成像,ImageJ软件分析测试结果。
1.2.3 免疫荧光检测
选取处于对数生长期的细胞,消化、重悬后将悬液接种于含有细胞爬片的24孔板中,于37℃细胞培养箱中培养12h,采用20ng/mL的TGF-β1或者33mmol/L高糖加0.15mmol/L棕榈酸进行刺激,72h后进行免疫荧光实验,甲醛室温固定10min,0.1%Triton处理10min,3%BSA室温封闭1h,加入一抗4℃避光过夜,二抗室温避光孵育1h,加入适量DAPI染色5min,以上各步骤之间均用PBS缓冲液洗涤3~4次,5min/次,然后用抗荧光淬灭剂封片,并在荧光显微镜下观察和拍照。
1.3 统计学方法
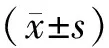
2 结 果
2.1 高糖高脂刺激对HUVEC细胞形态的影响
CON组细胞边界清晰,胞质丰富,形态为圆形、短梭形或扁平形,细胞间连接紧密,可融合成片呈铺路石样。在经过TGF-β1或高糖高脂处理72h后,细胞形态发生显著改变。TGF-β1组细胞形态逐渐向长梭形转变,细胞间连接变少,间隙变大,HG+HP组细胞形态与TGF-β1组相似,且细胞更加稀疏(图1)。

图1 高糖高脂刺激对于HUVEC细胞的影响
2.2 高糖高脂对HUVEC细胞间充质转化相关蛋白的影响
高糖高脂刺激后,HUVEC间充质转化的标志性蛋白表达增加,内皮细胞向间充质细胞转化特征就是内皮细胞特异性标志物表达相应减少,而对应的是间充质细胞特异性标志物相应增加。如图2A、B、C所示,与CON组相比,HG+HP组内皮细胞标志物血管内皮钙黏蛋白(VE-cadherin)丢失,表达明显下调(P<0.05)。而间充质细胞标志物平滑肌肌动蛋白(α-SMA)表达明显上调(P<0.05)。同时与CON组相比,HG+HP组血小板内皮细胞黏附分子CD31表达下调(P<0.05),而神经钙黏素(N-cadherin)表达上调(P<0.05)。证明经高糖高脂的刺激后HUVEC细胞发生了明显间充质转分化。

与CON组相比,*P<0.05,n=3。
2.3 免疫荧光测定高糖高脂刺激后HUVEC间充质转化相关蛋白表达情况
采用免疫荧光检测高糖高脂干预72h后细胞蛋白CD31、α-SMA及VE-cadherin的表达。免疫荧光结果显示高糖高脂组和TGF-β1组较正常组血小板内皮细胞黏附分子CD31表达下调(图3),间充质细胞标志物平滑肌肌动蛋白(α-SMA)表达明显上调(图4)。同时如图5,TGF-β1组与高糖高脂组较正常组内皮细胞标志物血管内皮钙黏蛋白(VE-cadherin)表达明显下调。证明经高糖高脂刺激后,HUVEC细胞发生了明显间充质转分化。

图3 免疫荧光测定CD31表达情况(标尺:5μm)

图4 免疫荧光测定α-SMA表达情况(标尺:5μm)

图5 免疫荧光测定VE-cadherin表达情况(标尺:5μm)
3 讨 论
血管内皮细胞结构和功能改变是血管病变发生的重要因素。正常血管内皮不仅覆盖在血管腔表面保护血管平滑肌,而且是重要的内分泌器官和效应器官[9]。血管内皮细胞参与机体的凝血、免疫、物质转运和生物活性物质释放等重要的生命活动,可以产生内皮依赖性因子,起调节血管张力、血管生长、血小板功能和凝血功能等作用。同时内皮功能失调会导致血管舒缩性受损,增加炎症细胞黏附[10]。内皮功能失调在心血管等疾病的发生发展中起重要作用,同时也是糖尿病高血糖损伤血管的重要靶标[11]。糖尿病造成的持久性高血糖会对血管造成弥散、广泛损伤,导致血管结缔组织基质成分显著改变,平滑肌细胞增殖,胶原过度表达,血管壁纤维化、硬化、管腔狭窄,并且可能引发血流紊乱,最终造成血流动力学障碍[12],这种血流动力学障碍成为动脉粥样硬化等血管疾病发生发展的力学基础。综上所述,糖尿病血管病变基础是可能是由于血管内皮细胞损伤所致,因此,保护血管内皮细胞对糖尿病及其并发症的治疗非常重要。
内皮功能障碍的机制复杂,End-MT可部分参与内皮功能障碍的过程,且内皮损伤导致的血管功能障碍与动脉粥样硬化关系密切[13]。而动脉粥样硬化被认为是心血管疾病共同的病理基础,这种血管内皮细胞的功能障碍是导致动脉粥样硬化的前期病变因素[14]。有研究表明,内皮细胞在剪切应力、促炎因子、缺氧等生理或病理因素的刺激下,相关通路包括转化生长因子-β,Notch、Ras等被激活,进而促进End-MT的发生发展,End-MT在血管疾病发生发展的各个阶段——早期内皮功能紊乱、斑块形成、斑块不稳定性及晚期血管钙化都发挥重要作用[15]。
本文研究发现高糖高脂刺激可以促进人脐静脉内皮细胞HUVEC表达间充质细胞标志物,发生表型转化;同时,在该刺激下内皮细胞标志物表达下调。值得注意的是,本文中的HUVEC在经历细胞传代6代,给予TGFβ1和高糖高脂刺激会取得最好的间充质转化效果。糖尿病血管并发症是否由高糖高脂刺激引发的End-MT而造成尚未明确,同时,高糖高脂引起End-MT的具体分子机制和作用靶点有待进一步研究。未来可进一步探索End-MT与糖尿病血管并发症之间的联系,为减轻糖尿病血管病变提供新策略和理论依据。

