应用光学相干断层扫描研究1型糖尿病患者视网膜及脉络膜的血流变化
张煜 庞淑度 雷艳芸 夏如悦 查屹 张艳玲
作者单位:1温州医科大学附属第二医院&育英儿童医院眼科,温州 325027;2苍南县第三人民医院眼科,温州 325800;3深圳市龙华区妇幼保健院眼科,深圳 518110
1型糖尿病(Type 1 diabetes mellitus,T1DM)是一种多器官微血管病变的自身免疫性疾病,相对2型糖尿病发生各种并发症的概率更高[1]。目前糖尿病引起视网膜病变的机制并未完全清晰,有研究表明高血糖可能会引起视网膜的微血管变化,包括毛细血管的重塑、退缩以及血流密度的减少[2]。另外,有研究提出,在确诊糖尿病性视网膜病变(Diabetic retinopathy,DR)前,糖尿病患者已经出现了糖尿病性脉络膜病变(Diabetic choroidopathy,DC)[3]。2 型糖尿病患者不同区域视网膜及脉络膜眼底疾病的发病率也不同[4-5],而关于T1DM视网膜病变这方面的研究相对较少。相较于2型糖尿病患者,T1DM患者眼底受高血压等其他全身疾病影响更小,本研究通过纳入对比T1DM患者眼底血流改变探寻早期DR的发病机制。
(续表)
光学相干血管成像(O p t i c a l c o h e r e n c e tomography angiography,OCTA)是一种新型的无创的眼底血管检查手段,能够精确定位视网膜及脉络膜的血管密度,在DR诊治中已广泛应用[2,6]。相对于眼底荧光素血管造影(FFA),OCTA检查视网膜具有非侵入性且可量化的优点[7]。在脉络膜数据采集方面,目前新型的扫频OCTA,应用了长波长的光源,减少了视网膜色素上皮层对脉络膜数据采集信号的影响,能得到更清晰的脉络膜血流图像,同时具备扫描速率快的优点,能够有效提高患者采集时的配合度,同时自动分区分层,减少了手动分层分区在数据采集时产生的误差。本研究主要通过新型扫频光学相干断层扫描血管成像系统(SSOCTA,swept-source optical coherence tomographic angiography)采集数据对比T1DM患者与对照组各分区内的视网膜及脉络膜血流灌注面积的地形变化,从而探究T1DM患者发生DR的机制。
1 对象与方法
1.1 对象
纳入标准:①已经确诊为TIDM;②年龄18~50岁;③无全身疾病病史。排除标准:①合并白内障、青光眼、角膜炎等影响OCTA成像的眼部疾病;②合并其他视网膜疾病以及视神经疾病,包括中心性浆液性脉络膜视网膜病变、年龄相关性黄斑变性、缺血性视神经病变等;③眼部手术史、眼底激光治疗史;④患有影响眼底血管状态的全身疾病,包括高血压和肾脏病;④矫正视力低于0.8;⑤眼压大于21 mmHg(1 mmHg=0.133 kPa);⑥眼轴大于26.5 mm。⑦等效球镜度(SE)>2.00 D或<-6.00 D。
随机抽取2022 年1—5 月在温州医科大学附属第二医院内分泌科住院的T1DM确诊患者19 例(36眼)作为TIDM组,年龄(32.6±10.6)岁,病程(7.03±7.02)年;另随机抽取同时间段年龄匹配的无眼部及全身相关疾病的眼科门诊体检人员18 例(35眼)作为对照组。DR分期遵循美国ETDRS制定的糖尿病临床分型[8]标准。所入选T1DM患者均无眼底微血管瘤、硬性渗出、棉绒斑以及视网膜新生血管等DR体征。本研究通过温州医科大学附属第二医院伦理委员会批准(伦理号:2022-YL-62-01),遵循赫尔辛基宣言,所有受检者均签署知情同意书。
1.2 检查方法
1.2.1 一般检查 所有受检者均完成眼部视力、裂隙灯显微镜、眼底、验光、非接触眼压测量(TX-20P,日本佳能公司)、眼轴测量(IOL Master 500,德国卡尔蔡司公司)、眼底彩照检查(CRO plus,江苏苏州微清医疗公司)以及OCTA检查(VG200,河南洛阳视微影像公司)。T1DM患者同时记录糖尿病病程、糖化血红蛋白(Glycosylated hemoglobin,HbA1c)、身高、体质量以及体质量指数(Body mass index,BMI)。所有T1DM组患者眼底均未出现明显的DR的体征。
1.2.2 OCTA机器介绍 本研究采用的OCTA机器为河南视微影像公司的VG200,其光源波长1 050 nm,扫描速度达到20 000次/s,组织内成像深度达2.7 mm,最高分辨率达1 024×1 024像素。其内置的视网膜及脉络膜血流的灌注面积计算方式把区域范围内的血管图像中每个点的亮度转化为数值,超过某一阈值的亮点区域标记为血管,再通过量化软件计算得到。本研究OCTA检查均采用机器自带血流“6 mm×6 mm”模式,扫描图像信号强度均大于8,运用系统自带软件对图像进行分区分层测量,并进行人工校对,如出现自动分层分区错误,将重新进行数据采集。
1.2.3 数据测量及分区 以黄斑中心凹为圆心划分半径为1、3、6 mm圆形区域,并在1~<3 mm、3~6 mm的环形区域划分上方(Superior,S)、下方(Inferior,I)、鼻侧(Nasal,N)、颞侧(Temporal,T)4 个象限的区域,并分别计算其灌注面积(Flow area,FA)。在视网膜分层方面,将视网膜及脉络膜分为4层,分别为视网膜浅层血管(神经纤维层/节细胞层-节细胞复合体外1/3,Superficial vascular plexus,SVP)、视网膜深层血管复合体(节细胞复合体外1/3-内核层/外丛状层,Deep capillary complex,DCC)、脉络膜毛细血管(Choriocapillaris,CC)及脉络膜层(包括脉络膜大中血管),并分别计算血流FA。同时测量获得各分区的脉络膜层厚度(Choroid thickness,CT)。
1.3 统计学方法
横断面研究。采用SPSS 24.0统计学软件进行数据分析。所有计量资料均采用±s表示,并通过正态性检验,2 组的各层FA比较采用独立样本t检验,2 组性别比较采用卡方检验,对血流灌注的影响因素分析采用多元线性回归分析。 以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
T1DM 组病程(7.02±7.01)年,空腹血糖(8.47±3.74)mmol/L,HbA1c为7.64%±1.58%,BMI为20.79±1.90。T1DM组与对照组的性别、年龄、眼轴、SE差异均无统计学意义(均P>0.05)。见表1。

表1.受检者基本信息Table 1.Basic characteristics of the subjects
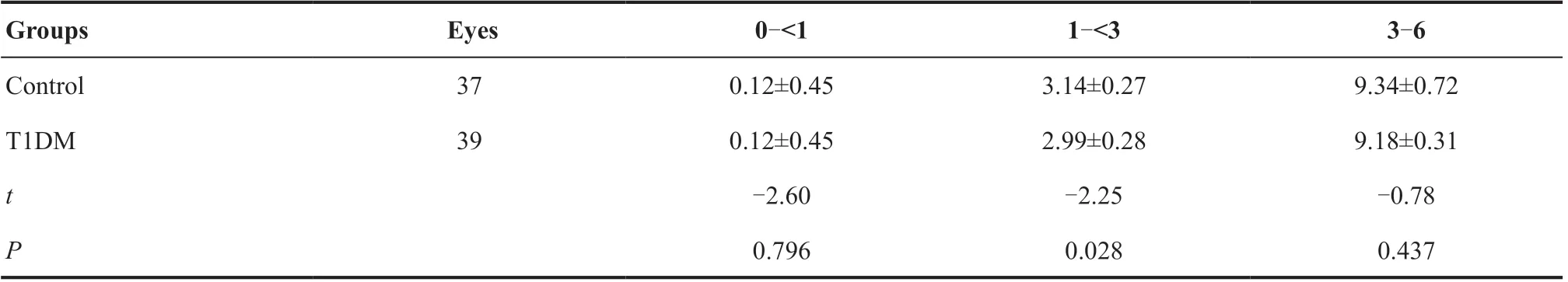
表2.2组间浅层血管网各分区灌注面积(mm2)比较Table 2.Comparison of flow areas in each zone of the superficial vascular plexus (mm2) between two groups

表3.2组间深层血管复合体各分区灌注面积(mm2)对比Table 3.Comparison of flow areas in each zone of the deep capillary complex (mm2) between two groups

表4.2组间脉络膜毛细血管层各分区灌注面积(mm2)对比Table 4.Comparison of flow areas in each zone of choriocapillaris (mm2) between two groups

表5.2组间脉络膜层各分区灌注面积(mm2)对比Table 5.Comparison of flow areas in each zone of choroid (mm2) between two groups
2.2 灌注面积变化
2.2.1 SVP层灌注面积比较 在黄斑区1~<3 mm中,T1DM组较对照组血流灌注面积减少(t=-2.25,P=0.028),见表2。主要减少的区域为鼻侧(t=-2.16,P=0.034)及下方(t=-2.68,P=0.009)。而3~6 mm各分区内在2组间差异均无统计学意义(均P>0.05)。
2.2.2 DCC层灌注面积比较 在DCC层中,相比对照组,T1DM组在1~<3 mm和3~6 mm均存在灌注面积的明显减少(t=-3.00,P=0.004;t=-2.16,P=0.034),见表3。而其中1~<3 mm区域的下方(t=-2.85,P=0.006)、鼻侧(t=-3.09,P=0.003)、颞侧(t=-2.42,P=0.018)的灌注面积均减少;而3~6 mm区域的灌注面积减少只集中在下方(t=-3.03,P=0.003),余分区在2组间差异均无经统计学意义(均P>0.05)。
2.2.3 CC层灌注面积比较 在CC层中,相比对照组,T1DM组在中心凹1 mm区域内的CC灌注面积显著性减少(t=-2.63,P=0.011),见表4。1~<3 mm区域灌注面积的减少集中在上方(t=-2.90,P=0.005)及鼻侧(t=-2.40,P=0.020);上方3~6 mm区域内灌注面积也显著减小(t=-2.21,P=0.030),余分区在2组间差异均无统计学意义(均P>0.05)。
2.2.4 脉络膜灌注面积比较 在1~<3 mm(t=-2.24,P=0.028)以及3~6 mm(t=-2.81,P=0.008)区域内,T1DM组脉络膜灌注面积较对照组均减少,见表5。其中1~<3 mm的变化体现在鼻侧(t=-2.26,P=0.027),而3~6 mm的减少表现在鼻侧(t=2.74,P=0.009)、下方(t=-2.07,P=0.046)及颞侧(t=-2.08,P=0.044),余分区在2组间差异均无统计学意义(均P>0.05)。2组间CT在各分区内差异均无统计学意义(均P>0.05)。
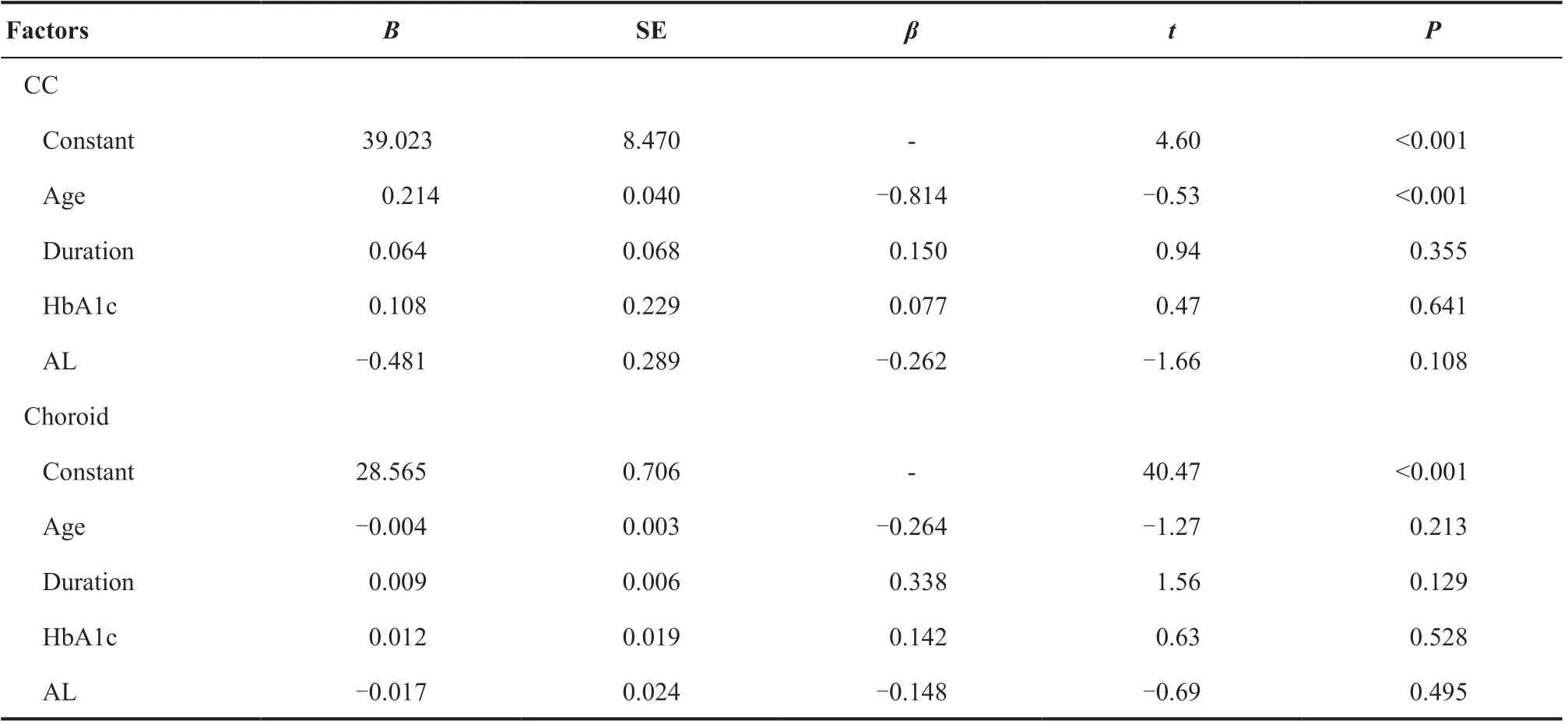
2.2.5 各层血流与相关因素的多元线性回归分析 T1DM组中,SVP与眼轴呈负相关(β=-2.09,P=0.046),CC与年龄呈负相关(β=-0.81,P<0.001)。正常组中,SVP、DCC层与眼轴呈负相关(β=-0.34,P=0.037;β=-0.46,P=0.008),CC层与年龄呈负相关(β=-0.68,P<0.001)。见表6。

表6.T1DM组及对照组各层血流相关影响因素多元线性回归分析Table 6.The multiple linear regression analysis of flow area in each layer in T1DM group and control group
3 讨论
本研究应用新型SS-OCTA分析了T1DM组患者眼底视网膜与脉络膜各层的血流灌注面积。相比对照组,T1DM组各分区分层的血流灌注均有不同程度的减少,其中浅层血管血流灌注面积的减少集中在1~<3 mm鼻侧及下方;DCC层FA在1~<3 mm下方及鼻侧,颞侧区域内均减少,而3~6 mm区域的灌注面积减少只集中在下方;CC灌注面积在不同分区均出现相应的变化。T1DM组和对照组脉络膜的灌注面积在1~<3 mm的减少均体现在鼻侧,而3~6 mm的灌注面积减少主要在鼻侧、下方及颞侧。
在糖尿病的众多并发症中,DR是视力下降的重要原因之一,约35%的糖尿病患者会出现DR[9]。既往有研究表明,已经确诊DM的患者在发生DR前,视网膜已经出现一系列功能失代偿。近年来针对DR的视网膜血流密度已进行了一定的研究,然而由于仪器分析水平的差异,目前针对不同视网膜及脉络膜区域的血流对比分析较少。
Fleissig等[10]应用OCTA分析了1型与2型成年无DR糖尿病患者黄斑区3 mm×3 mm视网膜血管密度的变化发现,与正常对照组相比,2 组糖尿病患者视网膜浅层与深层毛细血管密度具有显著的下降。 然而Forte等[11]的研究提示1型成年无DR糖尿病患者仅黄斑中心凹1 mm区域内浅层毛细血管密度发生了改变。Li等[12]研究分析了T1DM儿童眼底血流的变化发现,黄斑区视网膜内环(1~3 mm)血管存在不同程度的减少。本研究对黄斑区6 mm范围内不同分层分区的视网膜浅、深层毛细血管密度进行了完整的分析。本研究中T1DM组的浅层和深层血管灌注面积均出现减少,这与Fleissig等[10]的研究结果有一定相似。但是,SVP血流灌注面积的减少集中在1~<3 mm区域鼻侧及下方;DCC灌注面积在1~<3 mm鼻侧、颞侧及下方区域内都出现减少,其变化范围明显大于SVP。有研究发现,在DR出现任何临床表现之前,血流灌注已发生了显著的减少[13]。另有研究提示视网膜深层的毛细血管更容易受到进行性阻塞的影响[14]。血流灌注的变化究竟由于血流动力学的因素还是神经胶质-血管耦合等更复杂的功能障碍仍未可知。DCC是视网膜毛细血管单元的终止,其中血液来自浅表毛细血管层,并通过DCC流入深静脉。视网膜血流减慢可能优先影响DCC灌注[15-16]。因此,结合本研究结果提示,在早期无DR糖尿病患者中,视网膜的血流密度变化更趋向于早期影响深层毛细血管,DCC可以作为临床预测早期DR的一个重要指标。
本研究中,T1DM组中SVP和DCC的下方血流灌注面积更容易出现下降的趋势。人体标本的解剖研究[17]发现中央凹上方4 mm处的神经节细胞密度比中央凹下方4 mm处的神经节细胞密度多65%,提示眼上下视网膜解剖结构的不同。动物实验研究[18]提示下方视网膜更易受氧化应激的影响。Huynh等[19]搜集了1 700多例儿童的视网膜OCT数据,发现上方的视网膜比下方的要更厚。Tomita等[20]通过激光散斑流图测量视网膜血流发现在任何体位上半部分的视网膜血流均比下半部分大。也有视网膜电图的研究发现上方视网膜的电信号振幅比下方的大[21]。结合本研究中的结果,我们认为,下方网膜在T1DM发病过程中更具易感性,由此推断在T1DM的病程中,下方视网膜和脉络膜可能更早出现相关的并发症。
在视网膜解剖结构发生变化之前,视网膜的氧代谢率已经发生了增加。如有研究显示,在糖尿病发病早期,视网膜的氧化应激反应会对视网膜细胞氧代谢产生影响,从而触发微血管异常[22]而微血管异常改变包括毛细血管壁的增厚和血管弯曲度的变化。由于视网膜由视网膜与脉络膜血管系统共同滋养,脉络膜循环滋养外层视网膜,视网膜循环支持内层视网膜。因此,早期的糖尿病更倾向于出现脉络膜循环灌注的变化,进而进一步影响视网膜的氧代谢[22]。脉络膜结构学的研究同样支持这个观点[23]。然而由于仪器检测的受限,近年来关于糖尿病脉络膜血流密度的研究极少,关于T1DM的更是寥寥无几,且都只局限于无完整分层分区的血流测量。Carnevali等[13]研究18~26岁T1DM患者发现黄斑中心凹3 mm内的CC灌注与正常人相比无显著差异。Silva等[24]研究了糖尿病肾病眼底的CC血流密度,并没有发现显著性的改变。Tan等[25]的研究将不同严重程度DR患者CC的密度进行对比,虽然并未进行黄斑分区,但研究显示CC的血流密度在提高早期DR的鉴别上具有更显著的意义。Zhang等[26]发现糖尿病患者黄斑区中央2 mm的CC血流密度较正常人群明显降低。
本研究对黄斑中央6 mm内脉络膜的血流灌注进行了完整的地形分析,研究发现CC血流灌注在不同区域都发生了变化,不仅累及了外环3~6 mm区域,还影响了1~<3 mm区域和中央区,提示在早期DR中CC的影响范围更大。而脉络膜层的血管灌注同样发生了一定的变化,然而其减少主要集中在外环(鼻侧、下方及颞侧均有减少)。这可能与本研究中T1DM患者的糖尿病患病时间长,在较长的病程过程中,先于视网膜,脉络膜首先发生血管灌注的改变有关。CC由于和视网膜外层紧密相连,在视网膜的氧化应激过程中更易受到影响,从而导致血流灌注的大面积变化。而本研究中的脉络膜厚度各区域无显著性变化,进一步证明了CC的血流改变要早于脉络膜厚度的变化,同时提示脉络膜血流在早期预测DR的重要作用[27]。
在多元线性回归分析中,T1DM组各层血流与病程以及HbA1c均无显著相关性,这可能与本研究中所选的T1DM患者病程较短,同时作为HbA1c的测量点难以得到统一有关。眼轴和年龄对于视网膜及CC的影响在T1DM以及对照组变化趋势较为接近,表明二者对于血流的影响可能与血糖关系不大,其趋势有待进一步更大样本量研究证实。
本研究尚存在一定的局限性:首先,纳入受检者的样本量不足,无法进行更为细致的分组,后续研究设计将会加入2型糖尿病患者以及细化糖尿病的分期;其次,未在发现脉络膜血流灌注变化的同时,对视网膜外层结构,如椭圆体带等进行进一步的研究。再者,未来可加入电生理检查、血氧分析等其他血流及视网膜功能指标。今后需进一步完善,将血管灌注与结构变化有机结合,以期进一步探索DR的发病机制。
综上,本研究通过采集并分析T1DM患者和正常人群的OCTA数据发现,在DR发生之前,T1DM患者的视网膜及脉络膜血流均存在不同程度的下降,且视网膜血流变化集中在DCC,脉络膜血流变化则集中在毛细血管层,且CC的灌注面积减少比视网膜毛细血管的灌注面积减少更明显。
利益冲突申明本研究无任何利益冲突
作者贡献声明张煜:收集数据,参与选题、设计及资料的分析和解释;撰写论文;对编辑部的修改意见进行修改。庞淑度:参与选题、设计和修改论文的结果、结论。雷艳芸:收集数据,参与选题、设计及资料的分析和解释。夏如悦:收集数据。查屹:参与选题、设计、资料的分析和解释,修改论文中关键性结果、结论,对编辑部的修改意见进行核修。张艳玲:参与选题、设计

